7.doc
(1364 KB) Pobierz
VII. Układ okresowy pierwiastków
VII.1. Struktura elektronowa atomu a położenie
pierwiastka w Układzie okresowym
Pierwiastek jest to zbiór atomów o jednakowej
liczbie atomowej Z, określającej całkowitą liczbę
elektronów w jego atomach i całkowitą liczbę
protonów w jądrach atomowych.
Jądra atomów tego samego pierwiastka mogą jednak
mieć różną liczbę neutronów. Oznacza to, że taki
pierwiastek ma dwa lub więcej izotopów, zwanych
nuklidami, różniących się względną masą atomową.
Dodatnio
naładowane
protony
i elektroobojętne neutrony są powszechnie nazywane
nukleonami. Całkowita liczba wszystkich nukleonów w
jądrze atomowym, A, nosi nazwę liczby masowej.
Izotop pierwiastka jest to zbiór atomów o takiej samej
liczbie atomowej Z i jednakowej liczbie masowej A.
Izotop danego pierwiastka X oznacza się symbolem X
lub X.
Obecnie jednostką masy atomowej, 1u, jest 1/12
(dokładnie) masy nuklidu lżejszego izotopu węgla 12C.
1u = 1,6605·10-24 g
Masa spoczynkowa protonu wynosi 1,0072764 u,
masa spoczynkowa neutronu jest równa 1,0086650 u.
Masa spoczynkowa elektronu, równa 5,483∙10-4 u, jest
znikomo mała w porównaniu z masami nukleonów, np.
masa protonu jest 1837 razy większa.
Względna masa atomowa pierwiastka jest średnią
ważoną względnych mas atomowych jego
izotopów.
Z poprzedniego wykładu wiemy, że rozbudowa
powłok elektronowych przez obsadzanie elektronami
poszczególnych orbitali w atomach kolejnych, cięższych
od wodoru pierwiastków odbywa się na ogół zgodnie z
następującym schematem:
1s22s22p63s23p64s23d104p65s24d105p66s25d14f145d2-106p6
7s26d15f146d2-……,
co w konsekwencji skutkuje tym, że każdy znany nam
pierwiastek ma swoje miejsce w Układzie okresowym
wyznaczone przez liczbę atomową Z.
Główna liczba kwantowa n zewnętrznej powłoki
elektronowej atomu danego pierwiastka wyznacza
położenie tego pierwiastka w danym okresie (wierszu)
Układu okresowego. Pierwiastki, których atomy
obsadzają elektronami orbitale s lub p należą do grup
głównych tego układu i noszą nazwę odpowiednio
pierwiastków bloku s i bloku p.
Pierwiastki, których atomy obsadzają elektronami
orbitale d nazywamy przejściowymi lub pierwiastkami
bloku d. Pierwiastki, których atomy obsadzają
elektronami
orbitale
f
nazywamy
wewnątrzprzejściowymi lub pierwiastkami bloku f.
Idea Układu okresowego pierwiastków pochodzi
od
genialnego
chemika
rosyjskiego
Dymitra
Mendelejewa, który w 1869 roku uszeregował znane
wówczas pierwiastki według wzrastających mas
atomowych, jednak z pewnymi tylko wyjątkami,
i wykorzystał regularność podobieństwa właściwości
chemicznych wyrażone empirycznym prawem oktaw,
odkrytym wcześniej (1864) przez Newlandsa. Genialnym
osiągnięciem Mendelejewa było pozostawienie pustych
miejsc dla nieznanych wówczas pierwiastków, z których
trzy, mianowicie skand, german i gal, odkryto jeszcze za
jego życia.
Portret Dymitra Mendelejewa, 1834 - 1907
Układ Okresowy pierwiastków można przedstawić w
formie krótkiej z siedmioma wierszami (okresy) i
ośmioma kolumnami, w których wyróżniono kolumny A
(rodziny główne pierwiastków) oraz kolumny B (rodziny
dodatkowe pierwiastków).
Obecnie posługujemy się zalecaną przez IUPAC
(International Union of Pure and Applied Chemistry –
Międzynarodowa
Unia
Chemii
Czystej
i
Stosowanej) formą długą Układu Okresowego, która
jest bardziej przejrzysta, bowiem w jej osiemnastu
kolumnach wyróżnione są pierwiastki bloków s, p, d
i f.
VII.2. Okresowość zmian niektórych właściwości
pierwiastków w funkcji liczby atomowej
Chemiczna bierność gazów szlachetnych (He, Ne,
Ar, Kr, Xe, Rn) wynika z wyjątkowo trwałej struktury
elektronowej ich atomów, które ostatnią powłokę
elektronową mają obsadzoną odpowiednio przez 2 (He) lub
8 elektronów. Dlatego atomy każdego bardziej aktywnego
chemicznie pierwiastka, o liczbie atomowej Z, posiadające w
powłoce walencyjnej k elektronów wykazują tendencję, aby
w odpowiednich warunkach, tzn. wchodząc w reakcje
chemiczne z innymi atomami, uzyskać strukturę
elektronową atomów odpowiedniego gazu szlachetnego. W
zależności od położenia pierwiastka w Układzie okresowym
należy brać pod uwagę dwa sąsiadujące z nim gazy
szlachetne o liczbach atomowych Z’= Z – k i Z’ = Z + (8–k).
Mamy więc dwa przypadki:
- Z > Z’, gdy atomy pierwiastka Z po oddaniu k
elektronów walencyjnych przechodzą w jony o
ładunku k+ uzyskując w ten sposób taką samą
strukturę elektronową, jaką posiadają atomy gazu
szlachetnego o liczbie atomowej Z’= Z – k;
- Z < Z’, gdy atomy pierwiastka przyjmują (8-k)
elektronów i przechodzą w jon o ładunku (8-k)–
uzyskując taką samą strukturę elektronową, jaką
mają atomy gazu szlachetnego o liczbie atomowej Z’
= Z + (8–k).
VII.2.1. Potencjał i entalpia jonizacji atomów
Od atomu pierwiastka można odpowiednim nakładem
energii oderwać jeden, dwa lub więcej elektronów, w wyniku
czego uzyskuje się dodatnio naładowane jony z ładunkiem
1+, 2+, ..., k+. Nakład energii w przeliczeniu na jeden atom
nazywamy potencjałem jonizacji (Ej) i zwyczajowo
wyrażamy
w elektronowoltach (eV), gdzie 1 eV = 1,6022·10-19 J.
Dodatni nakład energii (ΔHojon) potrzebny do jonizacji N
atomów pierwiastka, gdzie N = 6,023·1023 jest liczbą
Avogadro, nosi nazwę molowej entalpii jonizacji
pierwiastka.
Szczególne znaczenie ma proces jonizacji atomu
z utratą pierwszego elektronu, np.:
H(g) = H+(g) + e– , Ej = 13,606 eV, ΔHojon = 1313 kJ/mol,
Na(g) = Na+(g) + e– , Ej = 5,202 eV, ΔHojon = 502 kJ/mol,
Al(g) = Al+(g) + e– , Ej = 5,984 eV, ΔHojon = 577,5 kJ/mol,
gdzie indeks (g) odnosi się do fazy gazowej.
Potencjały i molowe entalpie jonizacji pierwiastków
wykazują
charakterystyczne
okresowe
zmiany
w funkcji liczby atomowej. Najwyższe potencjały
i entalpie jonizacji mają gazy szlachetne, a najniższe
pierwiastki rodziny litowców.
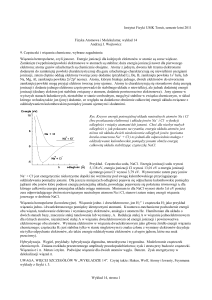
Rys. 1. Potencjały jonizacji atomów pierwiastków
Rys. 2. Molowe entalpie jonizacji pierwiastków
VII.2.3. Powinowactwo elektronowe
Powinowactwo elektronowe (PE) jest molową
entalpią procesu przyłączenia elektronów przez atomy
danego pierwiastka:
X(g) + e– = X–(g), ΔHoPE < 0
Entalpia tej reakcji jest zwykle ujemna, co oznacza, że
przyłączanie elektronów przez atomy X jest procesem
egzotermicznym. Maksymalne wartości powinowactwa
elektronowego
wykazują
pierwiastki
rodziny
fluorowców.
Rys. 3. Powinowactwo elektronowe pierwiastków
VII.2.3. Objętości molowe
Objętość molową pierwiastka definiuje wzór:
gdzie M jest jego masą molową, a d jego gęstością
w ustalonej temperaturze i pod stałym ciśnieniem, zwykle w
warunkach standardowych: t = 25...
Plik z chomika:
twoj.inzynier
Inne pliki z tego folderu:
1.pdf (102 KB)
10.doc (386 KB)
11.doc (176 KB)
12.doc (1083 KB)
13.doc (165 KB)
Inne foldery tego chomika:
Egzaminy - Wszystkie wersje (2)
Zgłoś jeśli naruszono regulamin
Strona główna
Aktualności
Kontakt
Dział Pomocy
Opinie
Regulamin serwisu
Polityka prywatności
Copyright © 2012 Chomikuj.pl
Wykłady