Ściąga eksperta
Budowa atomu i układ okresowy pierwiastków
Budowa atomu i układ okresowy pierwiastków
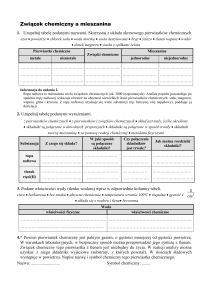
Materia jest częścią wszechświata. Składnikami materii są substancje, które posiadają swoją masę i objętość. Substancje to np. cukier, sól,
żelazo czy woda. Substancją nie są natomiast mieszaniny. Mieszaniną nazwa się zmieszane ze sobą substancje są to np: mleko, herbata z
cukrem, sól z makiem, piasek z opiłkami żelaza, benzyna czy woda z sokiem. Substancja to jednorodny materiał o ściśle określonym składzie
chemicznym.
Substancje w zależności od warunków mogą ulec rozkładowi lub połączeniu z innymi przy czym powstają wtedy substancje o nowych
właściwościach. A zatem: substancje, które nie ulegają rozkładowi na dalsze będziemy nazywać substancjami prostymi czyli pierwiastkami,
substancje powstałe poprzez połączenie dwóch lub więcej substancji prostych – substancjami złożonymi inaczej związkami chemicznymi.
Związek chemiczny nie jest prostą mieszaniną pierwiastków. Pierwiastki są ze sobą powiązane w specyficzny sposób za pomocą wiązań
chemicznych. Substancje chemiczne posiadają swoje właściwości czyli cechy charakterystyczne, które pozwalają ja zidentyfikować czy też
wydzielić ją z mieszaniny różnych substancji. Mieszanina powstaje poprzez zwykłe zmieszanie dwu lub większej liczby substancji natomiast
związek chemiczny poprzez połączenie różnych substancji prostych. W mieszaninie składniki zachowują swoje właściwości są one takie same
przed i po zmieszaniu w związku chemicznym tak nie jest. Otrzymany związek chemiczny ma inne właściwości niż składniki, z których
powstał.
Z czego się składają substancje? Co jest ich najmniejszą częścią? Najmniejszą częścią pierwiastka jest atom. Natomiast najmniejszą częścią
związku chemicznego jest cząsteczka. Atom jest najmniejszą, niepodzielną częścią pierwiastka chemicznego, która ma wszystkie właściwości
i bierze udział w reakcjach chemicznych. Pierwiastek jest to zbiór atomów tego samego pierwiastka.
Łączenie się pierwiastków w związki chemiczne polega na łączeniu się atomów różnych pierwiastków w większe zespoły – cząsteczki.
Wszystkie cząsteczki danego związku chemicznego mają identyczne właściwości chemiczne i fizyczne. Pierwiastki występują jako atomy np.
sód, potas, żelazo, srebro czy złoto. Jednak niektóre z nich występują tylko w formie cząsteczek np. wodór, tlen, brom, azot i inne.
Zestawienie symboli i nazw pierwiastków można znaleźć w układzie okresowym pierwiastków. Symbol określa nie tylko jaki to pierwiastek, ale
także jego ilość, a odpowiednio zestawione symbole chemiczne pierwiastków informują nas o składzie cząsteczek substancji:
2H - oznacza 2 atomy wodoru
H2 - oznacza 1 cząsteczkę wodoru, która jest zbudowana z dwóch atomów wodoru
O2 - oznacza 1 cząsteczkę tlenu zbudowaną z dwóch atomów tlenu
3O2 - oznacza 3 cząsteczki tlenu
H2O - oznacza 1 cząsteczkę wody zawierającą wodór i tlen
CO2 - oznacza 1 cząsteczkę dwutlenku węgla zawierającą węgiel i tlen
Co to takiego cząstki elementarne? Wyróżniamy takie cząstki elementarne jak elektron, proton i neutron. Elektron - jest to cząstka o ładunku
ujemnym -1. Proton - jest to cząstka o ładunku dodatnim +1. Neutron - jest to cząstka elektrycznie obojętna
Jak zbudowany jest atom? Atom składa się z dodatnio naładowanego jądra i krążących wokół niego elektronów. W jądrze jest skupiona
prawie cała masa atomu. W skład jądra wchodzą neutrony i protony- jądro jest dodatnio naładowane. Protony i neutrony mają wspólną nazwę
nukleonów. Elektrony poruszają się w różnych odległościach od jądra po tzw powłokach elektronowych. O właściwościach pierwiastków
decydują tylko elektrony zapełniające ostatnią powłokę. Elektrony te zostały nazwane elektronami walencyjnymi. Atom posiada jednakową
ilość elektronów i protonów, dlatego jest elektrycznie obojętny.
www.edudu.pl - filmy edukacyjne on-line
Strona 1/3
Ściąga eksperta
Skąd wiadomo, ile cząstek elementarnych ma dany pierwiastek? Aby odpowiedzieć na to pytanie, musimy poznać dwie liczby liczbę atomową
i liczbę masową.
liczba masowa
A
liczba atomowa
E
Z
Liczba atomowa (litera Z) jest zwana także liczbą porządkową. Jest to liczba protonów w jądrze. Liczba ta jest także równa liczba
elektronów w atomie obojętnym. Liczba masowa ma symbol A jest to liczba protonów i neutronów.
Z = liczba protonów
A = N + Z liczba protonów i neutronów
Ukłąd okresowy pierwiastków składa się on z 18 pionowych kolumn i 7 poziomych rzędów. Poziome szeregi zwane są okresami zaś pionowe
kolumny grupami. Grupy z nr 1,2 13, 14, 15, 16, 17, i 18 to grupy główne zaś od nr 3-12 poboczne. Nazwę grupy tworzymy od nazwy
www.edudu.pl - filmy edukacyjne on-line
Strona 2/3
Ściąga eksperta
pierwszego pierwiastka jaki się w niej znajduje za wyjątkiem grupy pierwszej której nazwę tworzymy od litu. Nazwy grup głównych to
odpowiednio: litowce, berylowce, borowce, węglowce, azotowce, tlenowce, fluorowce i helowce. Helowce zwane są także grupą gazów
szlachetnych. Podobnie nazywa się pierwiastki grup pobocznych inaczej zwanych przejściowych przykładowo grupa 3 - skandowce, 4 tytanowce itd.
Miejsce pierwiastka w układzie okresowym nie jest przypadkowe. Jak można zauważyć pierwiastki są ułożone wg wzrastającej liczby
atomowej (porządkowej). Każdy okres rozpoczyna się bardzo aktywnym metalem a kończy nieaktywnym gazem szlachetnym. Pierwiastki
należące do tej samej grupy mają podobne właściwości.
O własnościach pierwiastka mówi prawo okresowości które brzmi: własności pierwiastków nie są przypadkowe lecz zależą od budowy atomu
pierwiastka i zmieniają się w sposób ciągły regularnie i równocześnie powtarzalny (okresowo) ze wzrostem liczby porządkowe. Położenie
pierwiastka w układzie określamy poprzez podanie nr okresu, grupy. Można także podać liczbę porządkową (atomową) tego pierwiastka. Dla
pierwiastków w grupie 1 i 2 ilość elektronów walencyjnych w atomie pierwiastka jest równa numerowi grupy. Natomiast dla pierwiastków grup
od 13 do 18 - liczba elektronów w atomie pierwiastka jest równa numerowi grupy pomniejszonemu o 10.
Masa atomowa i masa cząsteczkowa. Masy i rozmiary atomów są bardzo małe -wprowadzono pojęcie tzw. masy atomowej. Jednostką masy
atomowej jest unit (u), który jest definiowany jako dwunasta część masy jądra atomu węgla. 1 u (unit) = 1/12 masy atomu 12C. Masa
cząsteczkowa. Jest równa się sumie mas atomowych pierwiastków wchodzących w skład cząsteczki z uwzględnieniem indeksów przy
symbolach pierwiastków.
www.edudu.pl - filmy edukacyjne on-line
Powered by TCPDF (www.tcpdf.org)
Strona 3/3