Chemia organiczna
Aminokwasy
Zakład Chemii Medycznej
Pomorskiego Uniwersytetu Medycznego
1
Aminokwasy
aminokwasy zawierają przynajmniej jedną grupę aminową i jedną
karboksylową
wzajemne ułożenie grupy aminowej w stosunku do grupy karboksylowej
rozróżniamy a-, b-, g- i kolejne aminokwasy
a-alanina
b-alanina
w zależności od liczby podstawników na atomie azotu aminokwasy dzielą
się na takie, które zawierają grupę aminową 1o, 2o, 3o i czwartorzędową
amoniową - betainy
2
Aminokwasy
występowanie:
wolne związki
wchodzą w skład peptydów, kopolimerów aminokwasów o mniejszej
masie cząsteczkowej niż białka (do 100 jednostek)
składniki białek – substancji stanowiących podstawowy budulec
drobnoustrojów i organizmów zwierzęcych.
substraty wielu innych związków biologicznie czynnych,
w tym neuroprzekaźników i alkaloidów
organizm wykorzystuje 23 aminokwasy do syntezy białek - aminokwasy
kodowane (najczęściej w białku występuje 20)
selenometionina
selenocysteina
piro(lo)lizyna
3
http://nowaalchemia.blogspot.com/2013/01/poison-story-5-cienkagranica.html
Selenocysteina
➢
➢
➢
➢
➢
➢
analog cysteiny, w której siarka zastąpiona jest selenem.
występuje w enzymach produkowanych przez organizm, selenocysteina
nie jest kodowana w DNA
w przypadku genów opisujących enzymy z selenem - pojawiający się tam
kodon UGA jest tłumaczony na Se-Cys za pomocą specjalnego czynnika
biologicznego nazywanego SECIS, który zapobiega kończeniu białka w tym
miejscu
aby czynnik zadziałał selen już musi być obecny w organizmie
jest niezbędnym składnikiem wielu ważnych enzymów, w tym wielu
peroksydaz - enzymów neutralizujących rodniki tlenkowe i nadtlenkowe
selen nie ma właściwości reduktora jego obecność sprzyja zmniejszeniu
ilości szkodliwych wolnych rodników
jest składnikiem enzymów odpowiadających za aktywność hormonów
tarczycy
➢
➢
niedobór selenu połączony z niedoborem jodu, może wywołać niedoczynność
tarczycy
suplementacja poprawia stan chorych w chorobie Hashimoto autoimmunologicznym zapaleniu tarczycy - chociaż mu nie zapobiega
4
Selenometionina i piro(lo)lizyna
Selenometionina – forma zapasowa
L-
D-
Piro(lo)lizyna
odkryta w 2002 roku u bakterii metanowych z rodzaju Archaea
składa się z:
łańcucha lizynowego
połączonego z metylowanym pierścieniem pirolinowym
grupa metolowa może pochodzić od rozmaitych metabolitów komórkowych, takich jak
metionina, ornityna, kwas glutaminowy, prolina lub izoleucyna.
5
Nature. 2015 Feb 5;518(7537):89-93. doi: 10.1038/nature14095. Recoded organisms engineered
to depend on synthetic amino acids.
Rovner AJ, Haimovich AD, Katz SR, Li Z, Grome MW, Gassaway BM, Amiram M, Patel JR, Gallagher RR,
Rinehart J, Isaacs FJ.
Nature. 2015 Feb 5;518(7537):55-60. doi: 10.1038/nature14121. Biocontainment of genetically
modified organisms by synthetic protein design.
Mandell DJ, Lajoie MJ, Mee MT, Takeuchi R, Kuznetsov G, Norville JE, Gregg CJ, Stoddard BL, Church GM.
Harvard
Syntetyczne bakterie, które używają
odmiennego kodu genetycznego
Do życia potrzebują 21 aminokwasów.
Zmodyfikowana bakteria Escherichia
coli, zamiast odczytywać jedną z trójek
jako sygnał "stop", zaczęła przyłączać
do białka aminokwas L-4,4’bifenyloalaninę (bipA) - nie istnieje w
przyrodzie.
Odmiana E. coli nie urośnie i nie
przeżyje, jeśli do jej pożywienia
nie zostanie dodany aminokwas
bipA.
L-4,4’-bifenyloalanina
Yale
4-p-azydo-L-fenyloalanina (pAzF)
6
Aminokwasy – nomenklatura
aminokwasom białkowym zostały nadane nazwy
zwyczajowe i są one w powszechnym użyciu
dla innych aminokwasów zaleca się stosowanie
nazewnictwa wg uprzednio poznanych reguł IUPAC
kwasy z
grupą aminową oraz
innymi podstawnikami
7
Aminokwasy – otrzymywanie
Z hydrolizatów białkowych
krystalizacja z hydrolizatów - praktycznie użyteczny sposób
pozyskiwania przypadkach, kiedy aminokwas jest łatwy do
wydzielenie z mieszaniny innych aminokwasów
cystyna - trudno rozpuszczalna w wodzie, krystalizuje
z hydrolizatu włosów
tyrozyna
aminokwasy kwaśne i zasadowe - izolowanie za pomocą jonitów
aminokwasy aromatyczne wyjątkowo mocno adsorbują się na
węglu aktywnym
metoda usuwania fenyloalaniny z hydrolizatu białkowego w procesie
przygotowywania pożywek dla dzieci cierpiących na fenyloketonurię
8
Aminokwasy – otrzymywanie
Jonit – substancja służąca do przeprowadzania selektywnego procesu
wymiany jonowej,
➢ stosowana w kolumnach jonitowych i filtrach jonitowych.
➢ przepuszczenie przez warstwę jonitu ciekłej lub gazowej mieszaniny
lub roztworu powoduje albo wzbogacenie jej o określony jon lub
pozbycie się z niej określonego jonu.
Jonity
➢ zwykle żele lub substancje porowate,
➢ mają zdolność selektywnego uwalniania
jednych jonów i pochłaniania innych
➢ działanie opiera się o występowanie
na powierzchni określonych chemicznych
grup funkcyjnych, które wiążą jony
➢ zwykle grupy mające własności kwasowe lub zasadowe,
które w kontakcie z rozpuszczalnikiem lub roztworem aktywującym
(zwykle silnym kwasem lub zasadą) ulegają dysocjacji elektrolitycznej
powodującej naładowanie ich powierzchni.
9
Aminokwasy
otrzymywanie – synteza chemiczna
Amonoliza halogenokwasów
halogenokwasy - łatwo dostępne jako produkty reakcji Hella-VolhardaZielinskiego
kwas propanowy
kwas
DL-2-bromopropanowy
DL-alanina(62%)
powstają racemiczne a-aminokwasy
nadmiar amoniaku służy do
wiązania wydzielającego się bromowodoru
wielokrotny nadmiar (powyżej 10x) zmniejsza wydajność niepożądanych 2o i 3o
amin.
zamiast amoniaku można używać
węglanu amonu,
mieszaniny węglanu amonu z amoniakiem
karbaminianu amonu – powstają pochodne karbaminowe uniemożliwiające
dalsze podstawianie
10
Aminokwasy
otrzymywanie – synteza chemiczna
Synteza Gabriela
alkilowaniu ftalimidku potasu - niedopuszczenie do tworzenia się 2o i 3o
amin poprzez podstawianie atomów wodoru w amoniaku
2-bromo-3-fenylopropanian potasu
ftalimidek potasu
DL-fenyloalanina
produktem jest aminokwas, który na grupie aminowej ma osłonę ftalilową
można go w tej postaci używać do dalszych reakcji
usunąć resztę ftalilową (za pomocą hydrazynolizy)
11
Aminokwasy
otrzymywanie – synteza Streckera
synteza aminokwasów z:
aldehydów i
cyjanku sodu lub potasu
w obecności amoniaku
imina
hydroliza
aminonitryl
aminokwas
-
uprotonowanie tlenu
grupy karbonylowej
atak czynnika
nukleofilowego (NH3)
na węgiel C=O
przemieszczenie H+
odszczepienie wody –
utworzenie iminy
przyłączenie HCN
12
Aminokwasy
imina
otrzymywanie – synteza Streckera
hydroliza
aminonitryl
aminokwas
- uprotonowanie azotu
grupy nitrylowej
- atak wody na węgiel
grupy nitrylowej
- przemieszczenie protonu
aminonitryl
1,2-diaminodiol
aminokwas
- przyłączenie drugiej
cząsteczki wody (atak
nukleofilowy na węgiel
nitrylowy)
- utowrzenie 1,2diaminodiolu
- uprotonowanie grupy
aminowej
- odszczepienie amoniaku
- odszczepienie protonu
- powstanie
aminokwasu
Aminokwasy
otrzymywanie – synteza chemiczna
Synteza Streckera
fenyloglicyna - surowiec w otrzymywaniu półsyntetycznych penicylin,
otrzymywana z aldehydu benzoesowego
aldehyd
benzoesowy
cyjanohydryna
aldehydu benzoesowego
DL-fenyloglicyna
tyrozyna – otrzymywana z aldehydu p-metoksyfenylooctowego
aldehyd
p-metoksyfenylooctowy
cyjanohydryna aldehydu
p-metoksyfenylooctowego
DL-tyrozyna
14
Otrzymywanie aminokwasów chiralnie czystych
aminokwasy otrzymywane na drodze chemicznej
z achiralnych substratów, bez udziału chiralnych czynników
są racemiczne
do celów farmakologicznych, medycznych, biochemicznych,
wzbogacania produktów żywnościowych, do badań
chemicznych potrzebne są czyste stereoizomery
otrzymuje się je:
w reakcjach z chiralnych substratów lub
w obecności chiralnych katalizatorów, w tym za pomocą
enzymów i mikroorganizmów
można rozdzielać racematy na enancjomery
15
Boc – grupa
tertbutoksykarbonylowa
chiralny bis-hydroksypolieter
generator chiralnych anionów
a amidosulfon
http://www.nature.com/ncomms/journal/v3/n11/full/ncomms2216.html
Aminokwasy
otrzymywanie – synteza Streckera
Otrzymywanie aminokwasów chiralnie czystych
Rozdzielanie racematów
racematy można rozdzielić na enancjomery
za pomocą soli diastereoizomerycznych,
poprzez diastereoizomeryczne pochodne,
enzymatycznie,
za pomocą mikroorganizmów,
chromatografii chiralnej lub krystalizacji spontanicznej
rozdzielanie racematów na enancjomery wybieramy
zamiast syntezy chiralnej gdy:
potrzebne są oba enancjomery
drugi niepotrzebny enancjomer można łatwo zracemizować i
racemat zawrócić do rozdzielania
17
Otrzymywanie aminokwasów chiralnie czystych
Krystalizacja diastereoizomerycznych soli
aminokwasy lub ich pochodne tworzą z:
chiralnymi aminami lub
chiralnymi kwasami
diastereoizomeryczne sole, różniące się m.in.
chiralne aminy stosowane do rozdzielania racemicznych
aminokwasów:
rozpuszczalnością w odpowiednim rozpuszczalniku, co sprzyja
rozdzielaniu ich poprzez krystalizację
naturalne alkaloidy (brucyna, chinina, efedryna, strychnina)
lub aminy syntetyczne [1-fenyloetyloaminę, 1-(pnitrofenylo)etyloamina, a- i β-1-naftyloetyloamina]
chiralne kwasy:
kwasy winowe, dibenzoilowinowe, glutaminowy, migdałowy,
kamforosulfonowe, jabłkowy i
N-chronione aminokwasy
18
Otrzymywanie aminokwasów chiralnie czystych
Rozdzielanie za pomocą enzymów
stosuje się takie enzymy, jak np. acylazy, proteazy, syntetazy, oksydazy
enzymy katalizują reakcję na określonym centrum sterycznym (najczęściej
L), pozostawiając drugie centrum bez zmian
produkty tych reakcji zwykle różnią się znacznie właściwościami fizycznymi
i chemicznymi, co ułatwia ich separację
proteazy są w stanie stereoselektywnie hydrolizować ugrupowania
estrowe.
N-acetylo-DL-aminokwas
N-acetylo-D-aminokwas
L-aminokwas
19
Aminokwasy białkowe
COOl
+H N – C a – H
3
l
R
20
Aminokwasy hydrofobowe
z alifatycznymi grupami R
glicyna
alanina
prolina
walina
metionina
leucyna
izoleucyna
cysteina
21
Aminokwasy hydrofobowe
z aromatycznymi grupami R
R - indol
fenyloalanina
tyrozyna
tryptofan
22
grupa
guanidynowa
Aminokwasy hydrofilowe
z polarnymi grupami R obdarzonymi ładunkiem
kwas asparaginowy
arginina
lizyna
pierścień
imidazolowy
histydyna
kwas glutaminowy23
Aminokwasy hydrofilowe
z polarnymi grupami R pozbawionymi ładunku
asparagina
glutamina
seryna
treonina
24
Aminokwasy egzogenne
Nie mogą być syntetyzowane w organizmie człowieka:
leucyna
izoleucyna
lizyna
fenyloalanina
metionina
walina
treonina
tryptofan
histydyna
arginina prawidłowy wzrost dzieci wymaga dostarczenia jej z zewnątrz
Największe dzienne zapotrzebowanie dorosłego człowieka
jest na leucynę, a najmniejsze na tryptofan.
25
Aminokwasy endogenne
Są syntetyzowane w organizmie zwierząt wyższych i
człowieka.
glicyna
alanina
prolina
seryna
kwas asparaginowy
kwas glutaminowy
glutamina
arginina
Aminokwasy względnie endogenne:
tyrozyna powstaje z egzogennej fenyloalaniny
cysteina powstaje z:
egzogennej metioniny
endogennej seryny
26
Aminokwasy niebiałkowe
b-alanina
CH2 – CH2 – COOl
NH3+
kwas g-aminomasłowy (GABA)
CH2 – CH2 – CH2 – COOl
NH3+
powstaje podczas przemian
zasad pirymidowych
wchodzi w skład:
kwasu pantotenowego
koenzymu A
karnozyny
neuroprzekaźnik;
powstaje w mózgu
z glutaminianu
stymuluje otwieranie kanałów
chlorkowych w błonie
postsynaptycznej
27
Aminokwasy niebiałkowe
ornityna i cytrulina - uczestniczą w syntezie mocznika
NH3+
l
+H N–CH –CH –CH–COO3
2
2
CH2–CH2–CH2–CH–COOl
l
NH
NH3+
l
H2N–C=O
homocysteina (kwas 2-amino-4merkaptomasłowy)
NH3+
l
HS–CH2–CH2–CH–COO-
28
Aminokwasy niebiałkowe - homocysteina
Niezależny czynnik ryzyka rozwoju m.in.:
miażdzycy
zawału serca
udaru mózgu
zmian zakrzepowych
Do wzrostu poziomu homocysteiny prowadzą:
czynniki genetyczne
palenie tytoniu
przewlekłe nadużywanie alkoholu
nadmierne spożycie kawy
niektóre leki
niedobór witamin (nieprawidłowa dieta)
witaminy B6
witaminy B12
kwasu foliowego
suplementacja nie przynosi efektów
u osób po zawale męśnia sercowego
Metionina
cysteina
Homocysteina
Aminokwasy są związkami amfoterycznymi
+H+
COOH
l
+H N – C – H
3
l
R
kation
COOl
+H N – C – H
3
l
R
jon obojniaczy
-H+
COOl
H2 N – C – H
l
R
anion
30
Punkt izoelektryczny aminokwasów
Punktem izoelektrycznym (pI) aminokwasów
nazywamy takie pH, przy którym cząsteczki
aminokwasu występują w postaci jonu obojnaczego.
wartość pH odpowiadająca wartości pI jest średnią
arytmetyczną pK1 i pK2
w punkcie pI cząsteczki aminokwasu nie są obdarzone
ładunkiem elektrycznym i nie wędrują w polu
elektrycznym
gdy pH < pI - cząsteczki aminokwasów są kationami
gdy pH > pI – cząsteczki aminokwasu są anionami
31
Równanie
Hendersona-Hasselbalcha
anion
jon
obojniaczy
kation
równoważniki OH32
Stereoizomery aminokwasów
aminokwasy występują w postaci pary enancjomerów.
posiadają one centrum chiralności
roztwory wodne aminokwasów:
skręcaja płaszczyznę swiatła spolaryzowanego w lewo lub w
prawo,
występują w dwóch formach stereoizomerycznych L i D.
w białkach w zasadzie występuje tylko forma L-aminokwasu.
formę D można spotkać w ścianie komórkowej bakterii
L- alanina
D- alanina
33
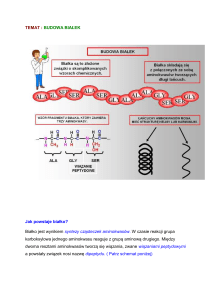
Wiązanie peptydowe
kowalencyjne wiązanie
powstające między grupą
a-aminową jednego aminokwasu,
a grupą a-karboksylową drugiego
aminokwasu.
wolna para elektronowa azotu
wiązania peptydowego jest
zdelokalizowana w wyniku
nakładania się orbitali z grupy
karbonylowej.
grupa peptydowa jest sztywna i
płaska.
atomy tworzące wiązania
peptydowe leżą w jednej
płaszczyźnie.
wodór grupy aminowej prawie
zawsze znajduje się po położeniu
trans w stosunku do tlenu grupy
karbonylowej
34
Wiązanie peptydowe
❖
nie jest możliwa swobodna rotacja
wokół wiązania C – N
❖
możliwa jest rotacja wokół wiązań
Ca-N i Ca-C
❖
kąty torsyjne (kąty rotacji) mają
wpływ na kształtowanie się
konformacji przestrzennej łańcucha
polipeptydowego
❖
znając ich wartości dla każdej reszty
amnokwasowej, można przewidzieć,
jaki kształt przyjmie polipeptyd.
35
Nomenklatura peptydów - aminoacylokwasów
nazwy tworzone są z użyciem
nazw grup acylowych
kończących się na –yl
i z nazwy aminokwasu
z wolną grupą karboksylową
(aminokwas C-końcowy).
nazwa peptydu zawsze
zaczyna się nazwą
aminokwasu z wolną grupą
aminową.
glicyna (Gly)
alanina (Ala)
glicyloalanina
alanina (Ala)
glicyna (Gly)
alanyloglicyna
36
Grupy funkcyjne aminokwasów
tworzących białka zdolne do jonizacji
–COOH aminokwasów dwukarboksylowych
–NH2 aminokwasów dwuaminowych
–OH tyrozyny i treoniny
–SH cysteiny
reszta imidazolowa histydyny
reszta iminowa argininy
mała liczba końcowych grup aminowych i karboksylowych
37
Oligopeptydy
glutation – g-glutamylocysteinyloglicyna
tripeptyd
aminokwas N-terminalny – kwas L-glutaminowy przyłączony jest
do Cys grupą g-karboksylową
bierze udział w reakcjach redoks, przechodząc przy tym w dimer
antyutleniaczem
aktywator enzymów, pełni rolę koenzymu dla peroksydazy
glutationowej
Glu
Cys
Gly
38
Oligopeptydy
wazopresyna i oksytocyna
wazopresyna (hormon antydiuretyczny, ADH)
nonapeptydy wykazującymi aktywność hormonów
produkowane w podwzgórzu, magazynowane w tylnym płacie
przysadki mózgowej.
mają bardzo podobną strukturę, różnią tylko dwoma aminokwasami
zwiększe wchłanianie zwrotne wody w dystalnych kanalikach
nerkowych.
niedobór ADH prowadzi do moczówki prostej.
oksytocyna stymuluje skurcze mięśni gładkich macicy i gruczołu
sutkowego.
39
Oligopeptydy
Insulina
➢
51-peptyd wytwarzany w trzustce
➢
zwykle występuje w postaci dimeru, zawierającego ponad 100 reszt
aminokwasowych
➢
zbudowana jest z dwóch łańcuchów:
➢
➢
➢
➢
A – 21 reszt aminokwasów
B – 30 reszt aminokwasów
łańcuchy połączone są dwoma mostkami disulfidowymi
w łańcuchu A znajduje się trzeci mostek disulfidowy
40
Oligopeptydy o aktywności antybiotyków
Penicylina powstaje z
D – waliny i
L – cysteiny
tworzą czteroczłonowy pierścień betalaktamowy i
pierścień tiazolidynowy
do pierścienia b- laktamowego przyłączona
jest wiązaniem peptydowym zmienna grupa
kwasowa
pierścień tiazolidynowy.
penicylina poprzez reaktywny pierścień
b- laktamowy zawierający wiązanie
peptydowe, nieodwracalnie hamuje
transpeptydazę glikopeptydową – kluczowy
enzym w syntezie ścian komórek bakterii
pierścień b-laktamowy
L-cysteina
D-walina
41
Aktynomycyna D – antybiotyk z grupy cytostatyków
pochodzi ze szczepu Streptomyces,
w swej strukturze zawiera:
grupę barwnikową (kwas fenoksazonodikarboksylowy)
połączoną
wiązaniami peptydowymi z dwoma pentapeptydami.
końcowe grupy karboksylowe obu pentapeptydów tworzą
makrocykliczne pierścienie laktonowe
w pentapeptydach występuje D-walina
jest specyficznym inhibitorem syntezy RNA, czyli
transkrypcji zarówno w komórkach prokariotycznych, jak i
eukariotycznych,
często jest wykorzystywana w badaniach biochemicznych
Sar - sarkozyna
MeVal - N-metylowalina Val
wiąże się specyficznie z dwuniciowym DNA, uniemożliwiając
jego użycie jako matrycy w syntezie RNA
42
Walinomycyna
struktura cykliczna,
utworzona z aminokwasów i hydroksykwasów
połączonych na przemian wiązaniami estrowymi i peptydowymi.
Składa się z trzykrotnie powtórzonego elementu zawierającegp
reszty:
jonoforowy antybiotyk nośnikowy
L-mleczanu (Lac),
L-waliny,
D-hydroksyizowalerianianu
D-waliny
pod jego wpływem błony biologiczne stają się przepuszczalne dla jonów K+
organizmy będące pod wpływem antybiotyków jonoforowych
pozbawione są możliwości kontroli nad wymianą składników z
otoczeniem.
wiąże jon K+ koordynacyjnie z sześcioma atomami tlenu reszt walin
w centralnej przestrzeni cząsteczki i jako nośnik przenosi je na
drugą stronę błony
43
Chemiczne modyfikacje
reszt aminokwasowych
Aminokwasy nie ulegające modyfikacjom potranslacyjnym:
alanina, walina, leucyna, izoleucyna i metionina
Główne rodzaje potranslacyjnych modyfikacji łańcuchów bocznych:
fosforylacja
g-karboksylacja acetylacja
metylacja
hydroksylacja
racemizacja
adenylacja
ubikwitynacja
glikozylacja
sieciowanie białek z udziałem poliamin
acylacja – mirystylacja i palmitylacja
prenylacja – farnelyzacja i geranylogeranylacja
tworzenie poprzecznych wiązań między łańcuchami polipeptydowymi
tworzenie pochodnych glikozylofosfatydyloinozytylowych (GIP)
Glikacja nieenzymatyczna
Główne białka ulegające glikacji: hemoglobina, albumina i inne białka
surowicy, białak błon plazmatycznych, krystalina, białka osłonek
mielinowych osrodkowego i obwodowego układu nerwowego, białka
macierzy łącznotkankowej, np. kolagen
44
Glikacja nieenzymatyczna
białko
glukoza
zasada Schiffa
produkt Amadori
bezpośrednia reakcja chemiczna między redukującym
cukrem, najczęściej glukozą, a pierwszorzędową grupą
aminową białka, w której nie powstaje glikozyd
początkowy produkt jest labilną zasadą Schiffa
która ulega powolnemu przegrupowaniu Amadori do
stabilnej ketoaminowej pochodnej białka
45
Glikacja nieenzymatyczna
w organizmach żywych nieenzymatyczne przyłączenie cukrowca strukturalna i funkcjonalną modyfikacje białka, mającą znaczenie
w mechanizmie starzenia, która ma szczególnie duży wpływ na
białka o długim okresie półtrwania
prędkość i wydajność procesu nieenzymatycznej glikacji jest
proporcjonalny do stężenia cukru oraz czasu trwania reakcji
glikowane białka błon plazmatycznych i podstawnych oraz
glikowany kolagen ścian naczyń krwionośnych mogą prowadzić
zwiększonej przepuszczalności mikronaczyniowej, np. w nerkach
glikowanie białek soczewki oka (krystaliny) prowadzi do zaćmy
glikowana hemoglobina wskaźnikiem glikemii w organizmie
46