Wydział Chemiczny Politechniki Gdańskiej
Katedra Technologii Leków i Biochemii
Biologia komórki
Określanie liczby chromosomów w komórkach
WSTĘP
Obserwacje chromosomów prowadzone są w celu: a) określenia ich ilości w komórce
tzw. ploidalności; b) po odpowiednim wybarwieniu można stwierdzić zmiany w
morfologii chromosomów (np. uszkodzenia typu utraty części chromosomu, wymiany
między chromatydami siostrzanymi itp.). Chromosomy mogą być też barwione po
częściowym nadtrawieniu enzymami proteolitycznymi np. trypsyną co pozwala na
wyróżnienie tzw. pasm G-ciemnych i G-jasnych (ang. G-dark and G-light bands).
Badania wskazują na występowanie subtelnych różnic strukturalnych i funkcjonalnych
między tymi obszarami chromosomów np. w pasmach ciemnych G lokalizowane są
sekwencje bogate w pary AT a także sekwencje minisatelitarne. Pasma jasne G
zawierają u człowieka sekwencje Alu bogate w pary GC, mogące przyjmować
konformację Z-DNA. Jak wykazano pasma jasnych G zawierają wcześnie replikowane
geny takie jak geny np. typu housekeeping, pasma ciemnych G - geny późno
replikowane.
Obserwacje morfologiczne chromosomów prowadzi się również w komórkach
traktowanych
substancjami
biologcznie
czynnymi.
Na
przykład
wiele
leków
przeciwnowotworowych wywołuje blokowanie progresji cyklu komórkowego w późnych
fazach, głównie między końcem fazy S i wejściem do mitozy, ze względu na
uszkodzenia DNA. Za pomocą innych związków, takich jak np. inhibitory kinaz
białkowych - staurosporyna i kofeina, inhibitor fosfataz - kwas okadaikowy, czy
nadekspresję białek regulujących przebieg cyklu komórkowego takich jak fosfataza
cdc25, komórki zablokowane w np. fazie G2, można zmusić do wejścia w fazę podziału
przez wywołanie tzw. przedwczesnej kondensacji chromatyny. Badania efektu
przedwczesnej kondensacji chromatyny służą celom poznawczym (poznanie regulacji
przejścia między G2 a M) ale mają też znaczenie farmakologiczne, ponieważ
przedwczesna kondensacja chromatyny i zmuszenie komórek do wejścia w mitozę przy
uszkodzonym genomie powoduje zwiększenie efektu działania leków.
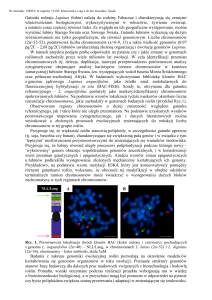
Chromosomy są widoczne jako twory morfologiczne tylko w czasie mitozy i mejozy
(patrz Rys. 1). Częstość występowania mitoz w populacji komórek rosnących
niesynchronicznie jest niewielka (ok. 1-2% populacji), głównie ze względu na krótki czas
trwania mitozy i podczas obserwacji chromosomów w komórkach często stosuje się
częściową blokadę komórek w metafazie za pomocą związków blokujących tworzenie
się wrzeciona mitotycznego np.
Rys. 1. Chromosom ludzki wyizolowany w stadium metafazy
alkaloidów Vinca. W
ten sposób frakcja komórek z wyraźnie wyróżnionymi
chromosomami jest większa.
Na
typową
procedurę
przygotowania
tzw.
wymazów chromosomalnych
(ang.
chromosome spreads) składają się: spęcznienie komórek w roztworze hypotonicznym
(zwykle 0.075M roztwór chlorku potasu lub rozcieńczenie zawiesiny komórek wodą
destylowaną), utrwalenie chromatyny np. roztworem Carnoy'a i przygotowanie rozmazu
na szkiełku mikroskopowym. Wizualizacja chromosomów polega na ich wybarwieniu
barwnikami fluorescencyjnymi (DAPI, Hoechst 33258) lub za pomocą barwnika
Giemsa.
LITERATURA
Tam S.W. and Schlegel, R. Quantification of premature and normal mitosis. W: Cell
Cycle - Materials and Methods (M. Pagano, ed.), Springer, Berlin-Heidelberg-New York,
1995, pp. 93-99.
Tabela 1. Przykłady anomalii chromosomalnych u człowieka
anomalia
Zespół Turnera
(dysgeneza gonadalna)
Zespół Klinefeltera
Trisomia X
charakterystyka
genetyczna
XO
XXY
XXX
Zespół Downa
trisomia chr. 21
Trisomia chr. 18
trisomia chr. 18
Trisomia D
trisomia chr. 15
zespół translokacje
15/21,
21/22 lub 21/21
Translokacja fragmentu
jednego ramienia chr. 9
do chr. 22
Zespół orofaciodigitalny
translokacja części chr.
6 do 1
Translokacyjny
Downa
Zespół Filadelfia
Zespół Cri du Chat
("koci krzyk")
delecja
krótkiego
ramienia chr. 5
objawy kliniczne
niski wzrost, szczątkowe jajniki
i słabo rozwinięte sutki,
dziecięcy narząd rodny
gynekomastia, małe jądra
dwa ciałka Barra, prawie
normalny fenotyp żeński ze
słabo wykształconymi
drugorzędowymi cechami
płciowymi
fałd mongolski (epicantus),
wysunięty język, hypotonia,
upośledzenie umysłowe
liczne wady wrodzone,
upośledzenie umysłowe
niedorozwój umysłowy, liczne
anomalie (np. nadliczbowe
palce), rozszczep
podniebienia, wady
ośrodkowego układu
nerwowego i oczu
objawy kliniczne podobne do
trisomii 21
przewlekła białaczka
limfoblastyczna i ostra
białaczka szpikowa
wada górnej wargi,
podniebienia i jamy ustnej,
grube palce o krótkich
paznokciach
niedorozwój umysłowy,
nieprawidłowości budowy
twarzy
Tabela 2. Liczba chromosomów u wybranych gatunków organizmów.
liczba chromosomów(2N)
gatunek
ogórek
groch
jęczmień
arbuz
fasola
kapusta
rzodkiewka
tytoń
śliwa
14
14
14
22
22
18
18
48
48
liczba chromosomów(2N)
gatunek
obleniec
muszka owocowa
ropucha
chomik
żaba
mysz
szczur
jeż
koń
kaczka krzyżówka
krab
2
8
22
22
26
40
42
48
66
80
200
liczba chromosomów(2N)
gatunek
rezus
człowiek
szympans
orangutan
42
46
48
48
CZĘŚĆ PRAKTYCZNA
Roztwory:
0.075M roztwór chlorku potasu
utrwalacz Carnoy'a: świeżo sporządzona mieszanina 1:3 obj. (v/v) lodowatego kwasu
octowego i metanolu
barwnik Giemsa, rozcieńczony 1:20 w wodzie destylowanej
roztwór soli fizjologicznej PBS
Sprzęt:
probówki wirówkowe
pipety automatyczne 200 l i 1000 l
pipety automatyczne 5 ml
szkiełka mikroskopowe
mikroskop świetlny
Przygotować zawiesinę komórek (ok. 1 mln. komórek na próbkę), do osadu komórek
dodać 5 ml PBS, odwirować przez 5 min. przy ok. 1000 obr./min. i rozpipetować osad
komórek w pozostałości nadsączu do uzyskania jednolitej zawiesiny. Dodać 4 ml
0.075M chlorku potasu i pozostawić na 10 min. w temperaturze pokojowej. Odwirować
jak wyżej, nadsącz odrzucić. Zawiesić komórki w pozostałości nadsączu.
Dodawać po kropli 4 ml utrwalacza Carnoy'a powoli mieszając zawiesinę na
wytrząsarce, odstawić na 15 min. w temperaturze pokojowej. Zwirować komórki,
przepłukać osad dwukrotnie 4 ml utrwalacza, za każdym razem mieszając zawiesinę
komórek z nowymi porcjami utrwalacza i pozostawiając komórki w utrwalaczu na ok. 15
min. Po ostatnim wirowaniu zawiesić komórki w pozostałości utrwalacza (ok. 100-200
l). Nakropić zawiesinę komórek (1-2 krople na szkiełko) na szkiełko mikroskopowe z
wysokości ok. 30-50 cm za pomocą pipety automatycznej. Pozostawić do wyschnięcia
na powietrzu, zalać preparat roztworem barwnika Giemsa (rozcieńczonego 1:20 wodą
destylowaną) na 5-7 min., przepłukać wodą destylowaną, zanurzyć do 90% etanolu na
kilka sekund. Wysuszyć na powietrzu i obserwować pod powiększeniem 400-1000x.
Przygotować dodatkowo jeden preparat chromosomalny na każdą grupę i nie barwić.
Opisać preparat (z numerem grupy i datą ćwiczenia) i oddać prowadzącemu ćwiczenie.
Określić liczbę chromosomów w badanych komórkach. Zaobserwować różnicę w
kształcie i wielkości chromosomów.
SPRAWOZDANIE
Podać wyznaczoną średnią ilość chromosomów w otrzymanych do badania komórkach
(zliczonych z minimum trzech różnych metafaz). Na podstawie załączonego zdjęcia
preparatu wykonanego przy pomocy prowadzącego, opisać wygląd wyizolowanych
chromosomów i określić z jakich komórek (mysich czy ludzkich) pochodzą te
chromosomy? Odpowiedź uzasadnić.