Zakaz Pauliego
Dwa elektrony mogą zajmować ten sam
orbital tylko wówczas, gdy ich spiny są
przeciwne tj. zorientowane w przeciwnych
kierunkach.
Reguła Hunda
Elektrony obsadzają orbitale w taki sposób, aby liczba
niesparowanych elektronów w danej podpowłoce była
możliwie największa.
Okresowość cech chemicznych i fizycznych
pierwiastków
Jeżeli będziemy umieszczać obok siebie pierwiastki
chemiczne szeregując je według rosnących liczb
atomowych, to dostrzeżemy, że co 8-my, co 18-ty lub co
32-gi pierwiastek wykazuje podobne cechy chemiczne.
Okresowość zmian charakteru chemicznego
pierwiastków była myślą przewodnią w skonstruowaniu
przez D.J Mendelejewa tablicy zwanym układem
okresowym pierwiastków.
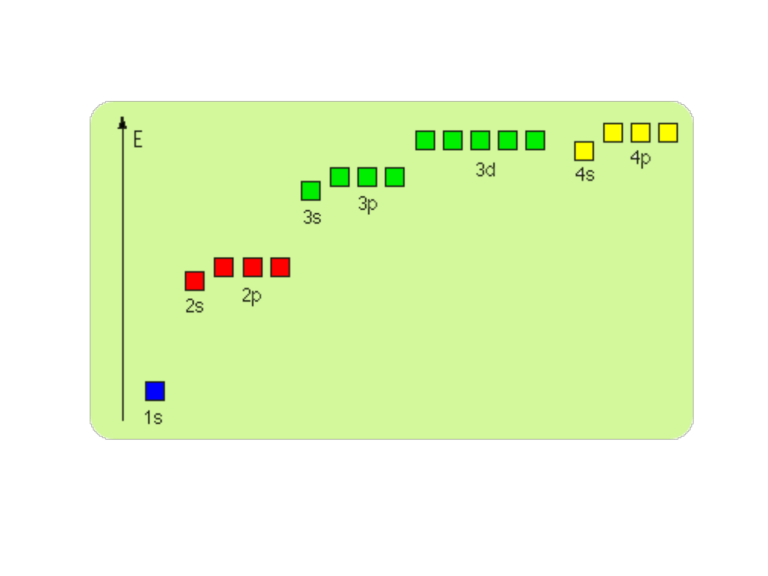
Periodyczność cech fizykochemicznych pierwiastków
wynika z powtarzającego się podobieństwa rozkładu
elektronów na zewnętrznych powłokach.
- grupa I - litowce
- grupa II - berylowce
- grupa III - borowce
- grupa IV - węglowce
- grupa V - azotanowce
- grupa VI - tlenowce
- grupa VII - fluorowce
- grupa VIII - helowce
- grupa I - miedziowce
- grupa II - cynkowce
- grupa III - skandowce
- grupa IV - tytanowce
- grupa V - wanadowce
- grupa VI - chromowce
- grupa VII - manganowce
- grupa VII - żelazowce: ta rodzina składa się z trzech
triad tj.
- pierwsza triada: żelazowce Fe, Co, Ni
- druga triada: platynowce lekkie Ru, Rh, Pd
- trzecia triada: platynowce ciężkie Os, Ir, Pt
Pierwiastki zapełniające podpowłoki 4f i 5f tworzą
odpowiednio dwie rodziny poddodatkowe
- lantanowce
- aktynowce
Rozmiary atomów i jonów
W obrębie okresu promienie atomów zmniejszają się malejąc w
danym okresie od strony lewej do prawej. Wiąże się to ze
wzrostem liczby protonów w jądrze, tzn. z silniejszym
przyciąganiem elektronów przez jądro. Tak więc w poszczególnych
okresach litowce mają największe promienie atomów, a fluorowce
najmniejsze.
W obrębie grup promienie atomów wzrastają wraz ze wzrostem
liczb atomowych. Wiąże się to ze wzrostem liczby powłok
elektronowych, których wpływ na wielkość średnicy atomu
przewyższa wpływ wzrostu ładunku jądra, decydującego o
zmniejszeniu średnicy atomu.
Objętość jonów ujemnych jest większa od objętości atomów, natomiast
objętość dodatnich jonów izoelektronowych jest znacznie mniejsza od
objętości macierzystego atomu.
Jeżeli ilość doprowadzonej energii jest dostateczna do oderwania elektronu od
atomu, tzn. ze sfery przyciągania oddziaływania jądra, to atom
przekształca się w jon dodatni.
pierwszym potencjałem jonizacyjnym nazywamy energię potrzebną do przemiany
M → M+
drugim - do przemiany
M+ → M2+
trzecim - do przemiany
M2+ → M3+.
Elektroujemność i elektrododatność
Pierwiastki, których atomy w reakcjach chemicznych przyłączają
elektrony, przyjmując w związkach ujemne stopnie utlenienia lub
tworzą jony ujemne nazywamy elektroujemnymi.
Pierwiastki, których atomy w reakcjach chemicznych "tracą" elektrony
lub tworzą jony dodatnie, nazywamy elektrododatnimi.
Skala elektroujemności Paulinga
Procentowy udział wiązania jonowego w zależności od różnicy elektroujemności
Różnica
elektrouje
mności
% udział
wiązania
jonowego
Różnica
elektrouje
mności
% udział
wiązania
jonowego
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
1
4
9
15
22
30
39
47
1,8
2,0
2,2
2,4
2,6
2,8
3,0
3,2
55
63
70
76
82
86
89
92
Wiązanie chemiczne
A.Teoria elektronowa
Aby utworzona cząstka była trwała, musi być uboższa energetycznie niż wchodzące w
jej skład oddzielne atomy.
Trwałość energetyczną osiągają cząsteczki przez utworzenie odpowiednich wiązań
między łączącymi się atomami. Wiązania w cząsteczce powstają w wyniku
"uwspólnienia" elektronów walencyjnych reagujących z sobą atomów.
1.energia dysocjacji (energia wiązania)
2.odległość pomiędzy atomami (długość wiązania)
3.kąt pomiędzy kierunkami wiązań (kąt walencyjny).
Wiązanie jonowe (elektronowalencyjne)
Wiązania jonowe występują w układach złożonych z atomów
skrajnie różniących się elektroujemnością.
W czasie powstawania wiązania jonowego atom pierwiastka
elektrododatniego oddaje, a atom pierwiastka elektroujemnego
przyłącza elektrony. Tworzą się dwa jony o różnoimiennych
ładunkach, przyciągające się dzięki działaniu sił elektrostatycznych.
Związki zawierające wiązania jonowe składają się z dodatnich i
ujemnych jonów rozmieszczonych na przemian w przestrzeni.
Siły oddziaływania elektrostatycznego pomiędzy jonami są
równomiernie rozłożone we wszystkich kierunkach
uprzywilejowanych, np. wyróżnienie kierunków wartościowości.
Wiązanie atomowe (kowalencyjne)
Wiążące się atomy dążą do osiągnięcia struktury oktetowej najbliższego gazu
szlachetnego, poprzez wytworzenie wspólnej pary elektronowej.
Wiązania atomowe (kowalencyjne) powstają również, gdy łączą się z sobą
atomy pierwiastków elektroujemnych o takich samych wartościach
elektroujemności.
Jeżeli utworzenie jednej wiążącej pary elektronowej
nie wystarcza do utworzenia oktetu,
atom może wykorzystać dwa lub trzy elektrony tworząc
wiązania podwójne lub potrójne.
Wiązanie atomowe (kowalencyjne) spolaryzowane
Wiązanie atomowe spolaryzowane jest wiązaniem pośrednim
między jonowym a atomowym; powstaje wówczas, gdy łączą
się ze sobą atomy pierwiastków różniących się
elektroujemnością, lecz nie tak znacznie jak w przypadku
tworzenia wiązania jonowego.
Cechą charakterystyczną tego wiązania jest przesunięcie pary
elektronowej wiążącej atomy w kierunku atomu pierwiastka
bardziej elektroujemnego.
Cząsteczki z wiązaniami kowalencyjnymi spolaryzowanymi z
powodu nierównomiernego, niesymetrycznego w stosunku do
środka cząsteczki, rozmieszczenie ładunków wykazują
biegunowość.
Cząsteczki o budowie polarnej nazywamy dipolami, tzn.
cząsteczkami dwubiegunowymi.
Cząsteczki dwubiegunowe mają tzw. moment dipolowy μ
μ=q*l
Substancja
C6H6
CCl4
CH4(ciekły)
NH3
CH3OH
C2H5OH
H2 O
H2O (lód)
CH3Cl
μ
Przenikalność
dielektryczna
0
0
0
1,44
1,62
1,66
1,84
0
1,56
2,27
2,24
2
22
33
25,7
80,1
3,2
5,8
Moment dipolowy
Wiązanie donorowo-akceptorowe (koordynacyjne)
Wiązanie donorowo-akceptorowe tym różni się od wiązania atomowego lub
atomowego spolaryzowanego, że para elektronowa tworzących wiązanie
oddawana jest przez jeden z dwóch łączących się atomów.
Wiązania van der Waalsa (międzycząsteczkowe)
Siły van der Waalsa są wynikiem wzajemnego oddziaływania elektronów i
jąder w cząsteczkach.
W wyniku ruchu elektronów walencyjnych gęstość ładunku ujemnego na
zewnętrznej powłoce atomów ulega szybkim fluktuacjom wzbudzając podobną
fluktuację w powłoce walencyjnej sąsiednich atomów. Powstają
szybkozmienne dipole, które wzajemnie przyciągają się zwiększając, w miarę
zbliżania się, wzajemną polaryzację elektronową.
Siły van der Waalsa są stosunkowo słabe w przypadku małych
cząsteczek (kilkanaście razy słabsze od sił wiązania atomów w
cząsteczce), ale w przypadku dużych cząsteczek mogą nawet
przewyższać siły wiązania chemicznego np. w smarach albo w
tworzywach sztucznych.
Wiązanie wodorowe.
Wiązanie wodorowe tworzy się pomiędzy atomem wodoru związanym z
atomem o dużej elektroujemności, a atomem z wolnymi parami
elektronowymi.
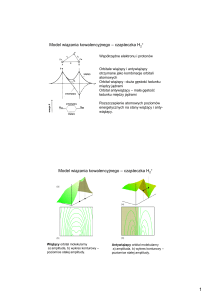
Teoria orbitali molekularnych (metoda MO)
Teoria ta zakłada, że podczas powstawania wiązania
chemicznego chmury elektronowe orbitali (zawierających
niesparowany elektron) każdego z wiążących się atomów
przenikają się lub nakładają nawzajem i powstają w ten sposób
tzw. orbitale molekularne. Przy kombinacji dwu orbitali
atomowych tworzą się dwa energetycznie różne orbitale
cząsteczkowe, jeden (nisko energetyczny) wiążący i jeden
(wysoko energetyczny) antywiążący.
Im bardziej dwa orbitale atomowe różnią się początkową energią, tym
słabiej oddziaływują ze sobą i tym mniejsze są potencjalne energie wiązań.
W przypadku gdy różnica energii orbitali atomowych wolnych atomów jest
bardzo duża, stopień nakładania sie orbitali jest niewielki. Wskutek tego
powstające orbitale molekularne tylko nieznacznie różnią się energią i
kształtem od pierwotnych orbitali atomowych