Ściąga chemia materiałów.doc
(98 KB) Pobierz
1.BUDOWA ATOMU, PIERWIASTKI MATERIA gazy, ciecze, ciała stałe(bezpostaciowe- szkliste, osady, krystaliczne- molekularne, jonowe),DEMOKRYT(filozof grecki)”materia musi być zbudowana z niepodzielnych cząstek” "atomas„ (gr.) = niepodzielny. W roku 1986
naukowcy odkryli nowe (mniejsze) cząstki we wnętrzu protonu i nazwali je kwarkami, protony (p) - są to cząstki elementarne posiadające jednostkowy ładunek dodatni +1 oraz jednostkową masę około 1,0073 u Protony i Neutrony tworzą razem Nukleony stanowiąc centralną część
atomu neutrony(n)-cząstki elementarne posiadające jednostkową masę około 1,0087 u i są pozbawione ładunku elektrycznego. elektrony (e) - cząstki elementarne obdarzone jednostkowym ładunkiem ujemnym -1 i bardzo małą masą równą 1/1846 u (dokładnie 0,00055 u ) Są więc
praktycznie pozbawione masy
WIĄZANIA CHEMICZNE
Aby powstało wiązanie, spełnione muszą być poniższe warunki: reagujące atomy powinny się zderzyć ze sobą, zderzenie to musi być efektywne. Gdy dwa atomy zbliżają się do siebie, zewnętrzne, luźno związane elektrony zostają mocno zaburzone, oddziałując na wszystkie cząstki układu
(jony, elektrony). Oddziaływanie to może prowadzić do powstania wiązania, gdy jądra/jony są blisko siebie. Proces powstawania cząsteczki jest korzystny energetycznie - prowadzi do zmniejszenia energii układu. Utworzona cząsteczka jest trwalsza niż poszczególne atomy. Wiązania
tworzą elektrony zewnętrznej powłoki elektronowej atomu (walencyjne), przy czym cząsteczki powstają jedynie wówczas, gdy w wyniku reakcji każdy atom osiąga trwałą konfigurację elektronową. Najtrwalsze konfiguracje elektronowe mają atomy gazów szlachetnych (8 elektronów na
powłoce walencyjnej) – pierwiastki bierne chemicznie. Cząsteczki dążą do wypełnienia powłoki walencyjnej, czyli obsadzenia jej 8 elektronami(reguła oktetu)Atomy mogą osiągać trwałą konfigurację elektronową przez oddawanie, przyłączanie lub uwspólnianie elektronów. Wiązanie
jonowe.
Wiązanie jonowe Powstaje gdy różnica elektroujemności pomiędzy łączącymi się pierwiastkami wynosi więcej niż 1,7. Następuje wówczas przesunięcie elektronów w stronę atomu bardziej elektroujemnego, który staje się anionem, natomiast atom oddający elektrony staje się kationem.
Siłą, która utrzymuje dwa atomy ze sobą jest siłą przyciągania elektrostatycznego (brak kierunkowości). Na przykład w związkach pierwiastków z pierwszej kolumny tablicy okresowej z pierwiastkami przedostatniej kolumny (halogenki metali alkalicznych: KCl, LiBr) / pierwiastek
elektrododatni - pierwiastek elektroujemny/Cechy związków z przewagą wiązania jonowego: ciała w stanie stałym, zbudowane z kationów i anionów, przyciągających się ze stosunkowo dużą siłą, twarde kryształy o wysokiej temperaturze topnienia i wrzenia, rozpuszczają się dobrze w
rozpuszczalnikach polarnych (woda),w stanie stopionym lub w roztworze dobrze przewodzą prąd elektryczny (nośnikiem ładunków są ruchliwe jony),ich reakcje zachodzą stosunkowo szybko.
Wiązania kowalencyjne(atomowe)Jest wynikiem uwspólniena pary elektronowej, przy czym każdy atom dostarcza jeden elektron. Wiązanie koordynacyjne – szczególny przypadek w. kowalencyjnego, gdy uwspólniona para elektronów wiązania pochodzi od jednego atomu (NH4Cl).
Mogą powstawać także tzw. wiązania podwójne lub potrójne przez uwspólnienie 4 lub 6 elektronów (np. atomy azotu o konfiguracji 1s22s2p3 - 5 elektronów walencyjnych - tworząc trzy wspólne pary elektronowe uzyskują oktet). Wiązanie ukierunkowane. Na przykładH2,O2/pierwiastek
elektroujemny - pierwiastek elektroujemny/Cechy związków z przewagą wiązania jonowego: ich cząsteczki słabo na siebie oddziałują, ich kryształy wykazują niewielką odporność na działanie czynników mechanicznych, mają niskie temperatury przejść fazowych, rozpuszczają się w
rozpuszczalnikach niepolarnych (benzen, tetrachlorek węgla),w stanie stopionym lub w roztworze nie przewodzą prądu elektrycznego,reagują stosunkowo wolno.Pośrednie między wiązaniem atomowy i onowym.Tworzy się jeśli różnica elektroujemności łączących się pierwiastków
zawiera się w granicach 0,4-1,7.Uwspólniona, wiążąca para elektronów przesunięta jest w stronę atomu pierwiastka bardziej ujemnego. Np. HCl – charakter wiązania jest w ok. 80% atomowy i w 20% jonowy.Cząsteczki w związku z takim nierównomiernym rozmieszcze-niem ładunków
tworzą dipole (cząsteczki dwubiegunowe).
Wiązania metaliczne W sieci metalicznej każdy elektron z zewnętrznych powłok znajduje się pod wpływem kilku jąder sąsiednich atomów, co powoduje rozmycie się ściśle określonych poziomów energetycznych w jedno ciągłe pasmo przewodnictwa. Elektrony walencyjne mogą się
swobodnie przemieszczać. Materiały o dobrym przewodnictwie elektrycznym. Wiązania wodorowe dwie cząsteczki/jony połączone są jonem wodorowym, szczególne znaczenie ma wiązane –0-H----0-, pełni istotną rolę w utrzymaniu struktury białek i kwasów nukleinowych
WĘGLOWODORY- Najprostsze związki organiczne, zawierające tylko atomy węgla i wodoru. mimo tego, że węglowodory składają się tylko z dwóch pierwiastków, jest ich bardzo dużo ze względu na mnogość sposobów łączenia się atomów węgla między sobą.
Podział węglowodorów-Węglowodory alifatyczne (łańcuchowe)– nie zawierają pierścieni benzenowych, Węglowodory aromatyczne – zawierają pierścień benzenowy
Nasycone – węglowodory alifatyczne bez wiązań wielokrotnych
Nienasycone – zawiera jedno lub więcej wiązań podwójnych lub potrójnych Alkany-Węglowodory Nasycone (propan, butan, oktan)
Cykloalkany - alkany o strukturze pierścieniowej (cyklopropan, cyklopentan)
AlkenyWęglowodory z jednym wiązaniem podwójnym węgiel – węgiel (propen, eten)
Alkiny Węglowodory zawierające potrójne wiązanie węgiel – węgiel
PIROLIZA (inaczej destylacja rozkładowa) to proces rozkładu termicznego substancji prowadzony poprzez poddawanie ich działaniu wysokiej temperatury, ale bez kontaktu z tlenem i innymi czynnikami utleniającymi. Zwykle w trakcie pirolizy bardziej złożone związki chemiczne
wchodzące w skład pirolizowanej substancji ulegają rozkładowi do prostszych związków o mniejszej masie cząsteczkowej.
Piroliza węgla Przy odgazowaniu 1000 kg (1 tona) węgla otrzymuje się: Gaz koksowniczy 330m3 (20%) o przeciętnym składzie: 50% H2, 34% CH4, 8% CO, 4% olefin, 4% N2, 1% CO2 Koks 650 kg (65%) Smoła węglowa 42 kg (5%) Woda pogazowa (ok. 10%) – zawiera amoniak;
Wykorzystywana jest do produkcji soli amonowych stosowanych jako nawozy sztuczne. NH3 + H2SO4 --> (NH4)2SO4
ROPA NAFTOWA - Jest mieszaniną węglowodorów różniących się wielkością i strukturą = parafiny (alkany), cykloparafiny (cykloalkany), olefiny (alkeny), węglowodory aromatyczne. Pozostałość (do ok. 20%) stanowią związki organiczne zawierające tlen, azot, siarkę a także sole
nieorganiczne i woda. Parafiny – do 5 atomów węgla (gazy), od 6 do 16 (ciecze), powyżej 17 (ciała stałe). Przerób ropy naftowej-Rafinacja procesy przekształcające ropę naftową w bardziej użyteczne produkty – destylacja frakcyjna, kraking, reforming.
Destylacja frakcyjna oddzielenie ropy na frakcje wg ich temperatur wrzenia (kondensacja wrzącej ropy na odpowiednich półkach – skroplenie).
Frakcja –mieszanina cieczy o podobnych temperaturach wrzenia. Lekkie frakcje mają niskie temp. wrzenia i krótkie łańcuchy węglowodorowe. Frakcje ropy naftowej – Benzyna Ciekła frakcja ropy naftowej powstała po destylacji frakcyjnej. Składa się z alkanów zawierających od 5 do
12 atomów węgla i wrze w przedziale temperatur 40 – 150 stopni. Liczba oktanowa określa odporność benzyny na detonacje (O – 100) i jest podnoszona przez dodatek substancji przeciwstukowych (czteroetyloołów).
Nafta-ciekła frakcja ropy naftowej powstała po destylacji frakcyjnej. Składa się z alkanów zawierających od 9 do 15 atomów węgla i wrze w przedziale temperatur 150 – 250 stopni.
ON-ciekła frakcja ropy naftowej powstała po destylacji frakcyjnej. Składa się z alkanów zawierających od 12 do 25 atomów węgla i ma temperaturę wrzenia wyższą niż 250 stopni. Mazut-olej pozostały po destylacji frakcyjnej. Składa się z węglowodorów zawierających do 40 atomów
węgla, wrze powyżej 350 stopni (olej smarowy, parafina, bitumin (asfalt).
Kraking-reakcja rozpadu dłuższych łańcuchów alkanów na krótsze alkany i alkeny. Kraking następuje na skutek działania wysokiej temperatury lub katalizatora.C9H20 --> C7H16 + C2H4nonan (alkan) = heptan (alkan) + eten (alken).
Reforming-proces otrzymywania benzyny z lżejszych frakcji przez rozbicie prostych łańcuchów alkanów i przebudowanie ich w łańcuchy rozgałęzione.
Liczba oktanowa- określa odporność benzyny na detonacje (O – 100) i jest podnoszona przez dodatek substancji przeciwstukowych (czteroetyloołów).
AKUMLUATOR OŁOWIOWY- ogniowo odwracalne akumulujące energię elektryczną Anoda – płyty ołowiowe Katoda – płyty ołowiowe pokryte tlenkiem ołowiu (IV). Elektrolit – wodny roztwór kwasu siarkowego. Pobór prądu-rozładowanie (ogniwo). Podczas rozładowywania
wyczerpuje się Pb i PbO2 a stężenie H2SO4 maleje. Ponieważ gęstość zależy od stężenia kwasu, mierząc gęstość można określić stopień rozładowania akumulatora. Anoda(-): Pb = Pb2+ + 2eKatoda(+): PbO2 + 4H+ + 2e = Pb2+ + 2H2O Ładowanie (elektroliza)- W czasie ładowania
zwiększa się stężenie H2SO4, tak więc całkowita ilość kwasu w elektrolicie nie ulega zmianie. Naładowany akumulator utrzymuje stałe napięcie ok. 2 V. Anoda(+): Pb2+ + 2e = PbKatoda(-): Pb2+ + 2H2O = PbO2 + 4H+ + 2e
Akumulator ołowiowy-reakcja sumaryczna-
Wady: duży ciężar, wrażliwość na wstrząsy, konieczność starannej konserwacji (nieużywany akumulator ulega samorozładowaniu). SEM naładowanego akumulatora wynosi 2V, wyładowanego 1.85V.
METALE
Budowa- Sieć regularna przestrzennie centrowana A2, Sieć regularna płaskocentrowana A1,Sieć heksagonalna zwarta A3
Właściwości -Ruchliwość elektronów walencyjnych w metalach warunkuje ich właściwości: połysk, kowalność, ciągliwość, przewodnictwo elektryczne
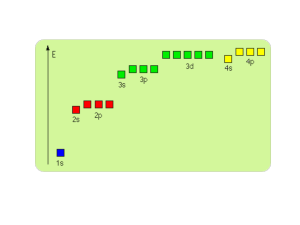
TEORIA PASKOWA CIAŁ STAŁYCH-Teoria pasmowa dotyczy zasadniczo 2 poziomów energetycznych atomów w ciele stałym: najbardziej zewnętrznego poziomu obsadzonego elektronem i najbliższego mu poziomu wzbudzonego. Poziomy te pod wpływem oddziaływania pól
elektrostatycznych pozostałych atomów ulegają rozszczepieniu na dużą liczbę blisko położonych poziomów tworzących pasma energetyczne: walencyjne i przewodnictwa W ramach pasma elektrony poruszają się swobodnie dzięki małym różnicom energii pomiędzy tworzącymi je
poziomami. Na każdym poziomie tworzącym pasmo mogą być 2 elektrony.
PÓŁPRZEWODNIKI
Półprzewodnik samoistny – monokryształ półprzewodnika pozbawionego defektów sieci krystalicznej i domieszek, czyli nie zawierający obcych atomów w sieci krystalicznej.
Półprzewodnik typu n – półprzewodnik, w którym elektryczność jest przenoszona przez nadmiar elektronów.
Półprzewodnik typu p – półprzewodnik, w którym elektryczność jest przenoszona przez dziury elektronowe
ALOTROPIA-Polimorfizmem lub alotropią nazywamy występowanie tego samego pierwiastka lub związku w postaci dwóch lub kilku odmian krystalicznych, a odmiany te nazywamy alotropowymi. Przemiany alotropowe zachodzą przy stałych temperatura...
Plik z chomika:
robertwierbi
Inne pliki z tego folderu:
Wyklad 8.ppt (2406 KB)
Wyklad 5.ppt (1669 KB)
PLTRnW_piroliza.pdf (1426 KB)
Wyklad 2.ppt (1492 KB)
Wyklad 11.ppt (1249 KB)
Inne foldery tego chomika:
Algebra
Zgłoś jeśli naruszono regulamin
Strona główna
Aktualności
Kontakt
Dla Mediów
Dział Pomocy
Opinie
Program partnerski
Regulamin serwisu
Polityka prywatności
Ochrona praw autorskich
Platforma wydawców
Copyright © 2012 Chomikuj.pl
Analiza
Fizyka
Kreski
Technologia materiałów inż