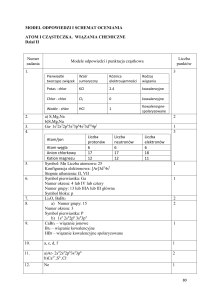
TEMAT : Wiązania chemiczne – kowalencyjne spolaryzowane.
Przypomnijmy :
Atomy pierwiastków, dążąc do uzyskania na ostatniej powłoce trwałego
dubletu lub oktetu elektronowego łączą się z innymi atomami.
Wzajemne oddziaływanie atomów (łączenie się ) powoduje powstawanie wiązań
chemicznych.
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE - polega na uwspólnieniu
pary elektronów, ale wspólna para nie należy w jednakowym stopniu do obu
atomów, lecz jest przesunięta w kierunku atomu bardziej elektroujemnego.
Zjawisko przesunięcia uwspólnionej pary elektronów w kierunku jednego z
atomów, nosi nazwę polaryzacji wiązania. Ma to miejsce w przypadku, kiedy
atomy pierwiastków różnią się elektroujemnością, ale różnica nie przekracza 1,7 w
skali Paulinga. Polarność wiązania rośnie w miarę jak zwiększa się różnica miedzy
elektroujemnościami pierwiastków. Jeśli przekroczy wartość 1,7 wiązanie
przyjmuje charakter jonowy. Wiązanie spolaryzowane jest najbardziej pospolite
dla związków nieorganicznych i organicznych w skład których wchodzą atomy
niemetali różniących się dość znacznie wartością elektroujemności. Przykład
wiązania kowalencyjnego spolaryzowanego : połączenie chloru i wodoru w
cząsteczce chlorowodoru.
Zjawisko elektroujemności poznacie szerzej w szkole średniej. Dzisiaj proponuję
zapamiętać, że wiązanie kowalencyjne spolaryzowane powstaje pomiędzy
niemetalami.
Zasadą
powstawania
tego
wiązania
jest
uwspólnianie
par
elektronowych. Wspólne pary elektronowe nie są ,,równomiernie rozłożone” ,
symetrycznie, pomiędzy atomami pierwiastków, ale są przesunięte w kierunku
atomów posiadających większą liczbę elektronów walencyjnych.
Warto zapamiętać, że wiązania atomowe- kowalencyjne niespolaryzowane, o których
pisałam w ostatnim temacie, występują pomiędzy niemetalami atomów najczęściej
tych samych pierwiastków.
Przykładami
cząsteczek
,
w
których
występują
wiązania
kowalencyjne
spolaryzowane są : CO2 , H2O, HCl, NH3.
ZADANIA
1. Który z pierwiastków tworzących chlorowodór ( wodór czy chlor ) ma większą
zdolność przyciągania elektronów ?
2. W którą stronę w cząsteczce wody pary elektronowe będą przesunięte, w
kierunku wodoru czy tlenu?
3. Jaki rodzaj wiązania występuje w cząsteczkach SiO2, Cl2O, P4.