Uploaded by
common.user6592
prezentacja-wiazania-chemiczne

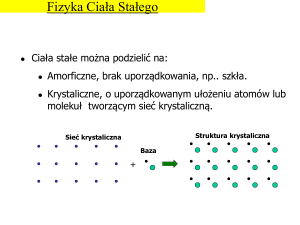
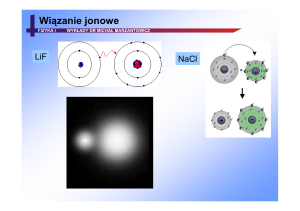
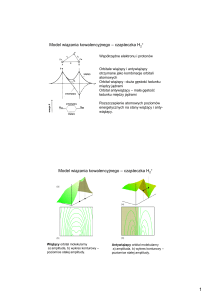
WIĄZANIA CHEMICZNE ZAKRES PODSTAWOWY Wiązania chemiczne Rodzaje wiązań chemicznych Wiązania chemiczne to oddziaływania, które występują między łączącymi się atomami. Tworząc wiązanie chemiczne, atomy oddają lub przyjmują elektrony, tak aby uzyskać konfigurację elektronową najbliższego im w układzie okresowym helowca. Wiązania chemiczne Wiązanie metaliczne Wiązanie między kationami metali a chmurą elektronową w sieci krystalicznej metali i ich stopów; występuje np. w: Na, K, Fe, W. • Wokół kationów sodu swobodnie przemieszczają się elektrony. • Uwspólnione elektrony mogą się swobodnie poruszać w metalu po przyłożeniu napięcia elektrycznego. Wiązania chemiczne Elektroujemność a rodzaj wiązania chemicznego Różnica elektroujemności łączących się ze sobą pierwiastków chemicznych ma zasadniczy wpływ na rodzaj powstającego wiązania chemicznego. • Jeżeli różnica elektroujemności jest równa 1,7 lub większa, to powstaje wiązanie jonowe. • Jeżeli różnica elektroujemności jest mniejsza od 1,7, to powstaje wiązanie kowalencyjne. Wiązania chemiczne Wiązanie jonowe Wiązanie między kationami metali a anionami niemetali. Różnica elektroujemności pierwiastków chemicznych w skali Paulinga wynosi co najmniej 1,7; np.: NaCl, CaCl2, LiCl, LiF, K2S, MgO. • Kation sodu powstaje w wyniku oderwania elektronu. • Anion chlorkowy powstaje w wyniku przyjęcia elektronu. • Jony przyciągają się elektrostatycznie i mają konfiguracje elektronowe najbliższych im w układzie okresowym helowców. Wiązania chemiczne Wiązania kowalencyjne pojedyncze i wielokrotne Ze względu na liczbę elektronów biorących udział w łączeniu się atomów wyróżnia się trzy rodzaje wiązań kowalencyjnych: • wiązanie pojedyncze – utworzone przez 2 elektrony (1 parę elektronową), • wiązanie podwójne – utworzone przez 4 elektrony (2 pary elektronowe), • wiązanie potrójne – utworzone przez 6 elektronów (3 pary elektronowe). Wiązania chemiczne Wiązanie kowalencyjne niespolaryzowane Wiązanie między atomami niemetali, których różnica elektroujemności w skali Paulinga jest mniejsza od 0,4; występuje np. w: Cl2, N2, H2, Br2, CH4, O2, P4, S8. • Wspólna para elektronowa, utworzona przez dwa elektrony, jest przyciągana z jednakową siłą przez rdzeń atomowy każdego z atomów tworzących to wiązanie chemiczne. • Między atomami chloru zostaje utworzone pojedyncze wiązanie chemiczne. • Każdy atom chloru ma konfigurację elektronową najbliższego mu w układzie okresowym helowca. • Elektrony walencyjne, które nie biorą udziału w tworzeniu wiązania, tworzą wolne (niewiążące) pary elektronowe. Wiązania chemiczne Wiązanie kowalencyjne spolaryzowane Wiązanie między atomami niemetali, których różnica elektroujemności w skali Paulinga jest mniejsza od 1,7, ale większa od 0,4; występuje np. w: HCl, H2O, HBr, CO2. • Wspólna para elektronowa, utworzona przez dwa elektrony, jest przesunięta w stronę atomu pierwiastka chemicznego o większej elektroujemności. • Atom chloru ma większą elektroujemność od atomu wodoru, zatem atom chloru silniej przyciąga wspólną parę elektronową. • Między atomem chloru a atomem wodoru zostaje utworzone pojedyncze wiązanie chemiczne. • Każdy atom ma konfigurację elektronową najbliższego mu w układzie okresowym helowca. Wiązania chemiczne Wiązanie koordynacyjne Wiązanie między atomami różnych pierwiastków chemicznych. Tworząca je para elektronowa pochodzi od jednego z atomów; np.: CO, H3O+, SO2, H2SO4, NO3–, NH4+. • Atom będący dawcą pary elektronowej to donor. • Donor pary elektronowej wiąże się z akceptorem, czyli innym atomem w cząsteczce lub jonie o niezapełnionej powłoce elektronowej, który przyjmuje parę elektronową donora. • Każdy atom ma konfigurację elektronową najbliższego mu w układzie okresowym helowca. Wiązania chemiczne Siły van der Waalsa Oddziaływania międzycząsteczkowe o bardzo krótkim zasięgu, które występują między cząsteczkami niepolarnymi. • Są częściowo odpowiedzialne za stan skupienia materii i odgrywają istotną rolę w polimerach. Siły van der Waalsa występują m.in. między włoskami na łapach gekona a gładkim podłożem. Wiązania chemiczne Wiązanie wodorowe Oddziaływanie międzycząsteczkowe powstające między atomem wodoru połączonym z atomem silnie elektroujemnego pierwiastka chemicznego a parą elektronową atomu pierwiastka chemicznego o dużej elektroujemności. • Tworzy się w wyniku przyciągania ładunków elektrycznych przeciwnego znaku. • We wzorach oznacza się je linią kropkowaną. Wiązanie wodorowe występuje m.in. między cząsteczkami wody. DZIĘKUJĘ ZA UWAGĘ