WIĄZANIE
JONOWE
1. WIĄZANIE JONOWE
JEST TO WIĄZANIE CHEMICZNE
UTWORZONE W TEN SPOSÓB ŻE
ELEKTRON Z POWŁOKI ZEWNĘTRZNEJ
JEDNEGO ATOMU PRZECHODZI NA
POWŁOKĘ DRUGIEGO PRZEZ CO ATOMY
STAJĄ SIĘ JONAMI O PRZECIWNYCH
ZNAKACH.
DZIAŁAJĄ TUTAJ SIŁY
ELEKTROSTATYCZNE. SUBSTANCJE
TAKIE NAZYWAJĄ SIĘ KRYSZTAŁAMI
JONOWYMI
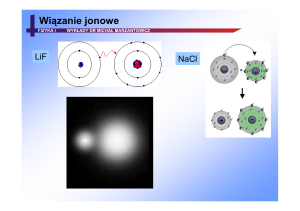
2. TWORZENIE NaCl
ATOM SODU MA 11 ELEKTRONÓW
ROZMIESZCZONYCH NA TRZECH POZIOMACH
ENERGETYCZNYCH, TJ. Na(2,8,1). W CELU
UZYSKANIA TRWAŁEJ KONFIGURACJI
ELEKTRONOWEJ , ATOM TEN DĄŻY DO
ODDANIA 1 ELEKTRONU, DZIĘKI CZEMU NA
POWŁOCE 2 BĘDZIE MIAŁ 8 ELEKTRONÓW.
ATOM CHLORU NATOMIAST Cl (2,8,7)
PRZYŁĄCZA NA 3 POZIOM 1 ELEKTRON
NaO ClO
e → Na+
+ e
→ Cl -
NaCl
(CHLOREK SODU)
3. ZWIĄZKI JONOWE
W WARUNKACH NORMALNYCH SĄ TO
SUBSTANCJE STAŁE O WYSOKIEJ
TEMPERATURZE TOPNIENIA I WRZENIA.
NP. NaCl POSIADA TEMP. TOPN. = 800 OC, A
WRZENIA = 1454 OC, TŁUMACZY SIĘ TĄ
WŁASNOŚĆ TYM IŻ ODDZIAŁYWANIE
WZAJEMNE NaCl JEST BARDZO SILNE.
CIEKAWOSTKA
W chemii kwantowej przyjmuje się, że wiązanie jonowe ma
miejsce wtedy, gdy teoretycznie obliczona energia orbitali
molekularnych, przy założeniu, że wiązanie ma jednak
charakter kowalencyjny, jest większa od potencjału
jonizacyjnego atomu, który jest donorem (dostarczycielem)
elektronu dla drugiego atomu. Obliczenia teoretyczne
energii takich hipotetycznych orbitali są jednak wysoce
dyskusyjne.
Praktycznie, aby ustalić czy wiązanie jest jonowe czy
kowalencyjne, wykonuje się pomiar gęstości elektronowej
wokół atomów tworzących wiązanie za pomocą
rentgenografii strukturalnej. Jeśli w przestrzeni między
atomami występuje obszar gdzie gęstość elektronowa jest
tak mała, że nie da się jej zmierzyć, a zatem chmury
elektronowe wokół obu atomów są wyraźnie rozdzielone,
to przyjmuje się, że wiązanie ma istotnie charakter jonowy.
ZAD. DOM.
ĆW. 38, 39, 41, 43, 44,
STR. 21-24