Przemiana - emisja jądra helu
emisja jądra helu
A
A-4Y
X
Z
np.
4He
+
Z-2
238U
2
234Th
92
+ 4He
90
238Pu
2
234U
94
+ 4He
92
2
Przemiana
emisja elektronu z rozpadu
A
AY
X
Z
np.
p + e-
n
0
+
Z+1
e
-1
239 U
239Th
92
+
93
14C
14U
6
7
0e
-1
+
0
e
-1
Liczby kwantowe
n – główna liczba kwantowa (n = 1,2,3,4, ...)
wyodrębnia powłokę elektronową i określa rozmiary orbitali
Numer powloki
Oznaczenie
Maksymalna liczba elektronów (2n 2)
1
K
2
2
L
8
3
M
18
4
N
32
l – poboczna (orbitalna) liczba kwantowa (0 < l < n-1) określa kształt orbitalu
Wartość liczby l
0
1
2
3
Symbol podpowłoki
s
p
d
f
Liczba orbitali
1
3
5
7
2
6
10
14
Maksymalna liczba
elektronów na podpowłoce
(4l + 2)
m – magnetyczna liczba kwantowa (- l < m < + l)określa liczbę form przestrzennych
ms – magnetyczna spinowa liczba kwantowa , ms = + 1/2
Formy przestrzenne orbitali typu p
Kształty przestrzenne orbitali d
Diagram poziomów energetycznych orbitali w atomach wieloelektronowych
Zasady obsadzania orbitali
1. Zasada rozbudowy
Kolejne orbitale są zajmowane w porządku wzrastającej energii
2. Zakaz Pauliego
Nie mogą istnieć dwa elektrony w identycznym stanie kwantowym
3. Reguła Hunda
Elektrony obsadzają orbitale w taki sposób, aby liczba niesparowanych
elektronów w podpowłoce była największa
Energia jonizacji – energia potrzebna do oderwania elektronu i utworzenia jonu
dodatniego
Elektroujemność – miara zdolności atomu do przyciągania elektronów w cząsteczce
-
w danej grupie maleje, gdyż zwiększenie liczby powłok osłabia
przyciąganie elektronów walencyjnych
-
w danym okresie wzrasta, gdyż jądro o większym ładunku silniej przyciąga
elektrony
Elektronowa teoria wiązania
Duża trwałość konfiguracji oktetowej elektronów walencyjnych
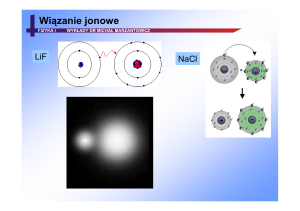
Wiązanie jonowe (elektrowalencyjne)
Powstaje wskutek elektrostatycznego przyciągania się różnoimiennych jonów.
Elektrony są przekazywane od atomu o mniejszej elektroujemności (donora) do
atomu o większej elektroujemności (akceptora)
Wiązanie kowalencyjne (atomowe)
Osiągnięcie korzystnej konfiguracji elektronowej następuje przez uwspólnienie
par elektronów walencyjnych pochodzących od różnych atomów
Wiązanie kowalencyjne spolaryzowane
Utworzenie wspólnej pary elektronowej przez atomy o różnej elektroujemności
Wiązanie koordynacyjne
Uwspólnienie pary elektronów pochodzącej od jednego atomu
Wiązanie atomowe w cząsteczkach homoatomowych
H + H
np. wodór (1s1)
H
H
2s
tlen
(2s22p4
2p
)
I O:
+ :OI
O = O
azot (2s22p3)
2s
IN:
2p
+ :NI
IN = NI
Wiązanie atomowe w cząsteczkach heteroatomowych
CS2
C
2s22p2
stan wzbudzony
2s
S
3s23p4
C
+ I SI
IS = C=SI
2p
NCl3
2s
2p
N 2s22p3
Cl 3s23p5
I Cl
N
I
I Cl I
Cl I
Wiązanie koordynacyjne
Wspólna para elektronowa może pochodzić w całości od jednego z atomów
np. SO2
S
O
3s23p4
utworzenie wiązania
atomowego
S=O
2s22p4
O
S=O
SO3
O
S=O
O
Diagram poziomów energetycznych orbitali molekularnych
*2pz
*2px,y
2p
2p
2px,y
2pyz
*2s
2s
2s
2s
2s
1s
1s
*1
s
1s
1s
Termochemia
Zawartość ciepła, stan energetyczny substancji, (H)
H = H (produkty) – H (substraty)
np.
H2 (g)= + ½ O2 (g)= H2O ©
H° = -285,7 kJ/mol
Stanem standardowym dowolnej substancji jest faza, w której substancja ta
występuje w temperaturze 25°C (298,15 K) i pod ciśnieniem 101 325 N/m 2 (1 atm).
Dla substancji w roztworze stan standardowy odnosi się do stężenia jednostkowego.
Entalpie wszystkich pierwiastków w ich stanach standardowych są równe zeru.
H < 0 proces egzotermiczny
H > 0 proces endotermiczny
Hox
C(s) + O2(g)
Ho1
H
1
H
H
x
CO(g) + ½ O2(g)
CO2(g)
H
Ho2
2
C(s), O2(g)
CO, ½ O2(g)
H1 = -110.5 kJ/mol
CO2
(g)
Hx = -393 kJ/mol
H2= -282.9.5 kJ/mol
Efekt energetyczny danego procesu nie zależy od drogi, jaką on przebiega, ale
tylko od stanu początkowego i końcowego
Entropia (S) – miara statystycznego prawdopodobieństwa danego układu.
Im większa wartość S tym bardziej prawdopodobny (nieuporządkowany) jest stan
Sgaz > Sciecz > Sc.stałe
Prawdopodobieństwo przebiegu procesu wzrasta, gdy:
H staje się bardziej ujemne
S staje się bardziej dodatnie
So
Reakcje spontaniczne przy
wszystkich temperaturach
Ho < 0
So > 0
Reakcje spontaniczne przy
wysokich temperaturach
Ho > 0
So > 0
Ho
Ho < 0
So < 0
Reakcje spontaniczne przy
niskich temperaturach
Ho > 0
So < 0
Reakcje niespontaniczne przy
wszystkich temperaturach
G = H - T S
Gdy: G < 0 proces samorzutny czyli przebiega reakcja
A+B C
G > 0 proces samorzutny przebiega w kierunku przeciwnym
A+B C
G = 0 stan równowagi, procesy zachodzą w obu kierunkach
A+B =C
G = - RT ln K
K = stała równowagi reakcji
Reguła przekory (Le Chateliera-Brauna)
Pod wpływem zmiany czynnika zewnętrznego układ znajdujący się w stanie
równowagi ulega przemianie w takim kierunku, aby zmniejszyło się działanie tego
czynnika.
Wpływ temperatury
lnK=
Ho - TSo
RT
=
So
R
-
Ho
R
.
1
T
Stała równowagi zależy wykładniczo od odwrotności temperatury
*
W reakcjach endotermicznych (Ho > 0) podwyższenie temperatury powoduje
przesunięcie równowagi układu na korzyść produktów, a obniżenie temperatury –
na korzyść substratów
*
W reakcjach egzotermicznych (H0 < 0) przy podwyższenie temperatury
równowagowy stan układu przesunie się na korzyść substratów
Wpływ ciśnienia
Zmiana ciśnienia powoduje przesuniecie położenia równowagi w reakcjach, w
których zmienia się liczba cząsteczek reagentów gazowych
Dla reakcji typu
A2 (g) + B2 (g) 2AB(g)
zmiana ciśnienia nie spowoduje przesunięcia położenia równowagi
Dla reakcji typu
2AB(g) A2 (g) + 3B2 (g)
zwiększenie ciśnienia powoduje przesunięcie położenia równowagi w lewo
zmniejszenie ciśnienia powoduje przesunięcie położenia równowagi w prawo
Dla reakcji typu
2A2 (g) + 3B2 (g) 2A2B3 (g)
zwiększenie ciśnienia powoduje przesunięcie położenia równowagi w prawo
zmniejszenie ciśnienia powoduje przesunięcie położenia równowagi w lewo