1. Jednostka masy atomowej, mol, liczba Avogadro
Międzynarodowa jednostka masy atomowej równa 1/12 masy atomu izotopu węgla 12/6
C to unit
1 unit = 1,66057 * 10-27kg = 1,661*10-24g
Mol to jednostka liczności materii, która zawiera tyle samo atomów, jonów albo innych
cząstek (np. elektronów) ile atomów węgla zawartych jest w 0,012kg izotopu węgla 12C
Liczba atomów węgla w 0.012kg izotopu 12C a tym samym liczba cząstek w 1 molu
materii wynosi 0,022*1023 1/mol – jest to tak zwana liczba Avogadra oznaczana
symbolem NA
1 mol = 6.022 * 1023
2. Typy reakcji chemicznych:
Reakcje chemiczne dzielimy na trzy typy:
1. reakcje syntezy (łączenia)
np. 4Fe + 3O2 2Fe2O3
2. reakcje analizy (rozkładu)
np. 2KMnO4 K2MnO4 + MnO2 + O2
3. reakcje wymiany
np. CuSO4 + Zn ZnSO4 + Cu (wymiana pojedyncza)
Na2S + FeCl2 FeS + 2NaCl (wymiana podwójna)
Wyróżniamy także reakcje:
egzotermiczne (z wydzieleniem energii)
endotermiczne (z pobraniem energii)
odwracalne
nieodwracalne
utleniania
reakcje redoks
redukcji
zobojętniania (kwasy + zasady)
roztwarzania (substancja stała przechodzi do roztworu jako nowa substancja
)
dysocjacji
hydrolizy
reakcje jonowe
wytrącania osadów
3. Obliczanie stopni utlenienia w cząsteczkach i jonach złożonych:
GRUPA
1
2
13
14
15
16
17
18
2
2 1
2
2
2
3
2
4
2
5
Konfiguracje
ns1
ns
ns np
ns np
ns np
ns np
ns np
ns2np6
walencyjne
Stopnie
utlenienia pierw.
W tlenku
Wzór tlenku
Stopnie
utlenienia w
połączeniu z
wodorem
Wzór związku z
I
II
I, III
II, IV
III , V
IV, VI
V, VII
VI, VIII
E2O
EO
EO, EO2
I
II
E2O,
E2O3
III
E2O3,
E2O5
-III
EO2,
EO3
-II
E2O5,
E2O7
-I
EO3,
EO4
0
EH
EH2
EH3
EH4
EH3
H2E
HE
---
IV dla C
–IV
wodorem
Przykłady:
MgO – tlenek magnezu
SO3 – tlenek siarki
HNO3 – kwas azotowy
FeCl3 – chlorek żelaza
Al2S3 – siarczek glinu
NH3 – amoniak
CO2 – dwutlenek węgla
BaO – tlenek baru
PbS2 – siarczek ołowiu
4. Wzory i nazwy związków chemicznych i jonów
Wzory zawiązków chemicznych wyrażamy za pomocą symboli pierwiastków opatrzonych
indeksami stechiometrycznymi. We wzorach sumarycznych na ogół przestrzegamy zasad
iż na początku wumieniamy metale a na końcu niemetale. Jeżeli w cząsteczce występują
więcej niż dwa pierwiastki to kolejność ich wymieniania powinna być zgodna ze
wzrastającą elektorujemnością.
Zapisując wzory chemiczne na pierwszym miejscu umieszcza się zawsze składnik mniej
elektroujemy a na drugim bardziej elektroujemny. Podając nazwę związku wymienia się
składniki w odwrotnej kolejności.
Jony:
Katony :
Li+
jon litu
2+
Cu
jon miedzu (II)
H+
jon wodoru
2+
Hg
jon rtęci (II)
Aniony:
Hjon wodorrkowy
OHjon hydroksylowy
F
jon fluorkowy
S2jon siarkowy
O2jon ditlenkowy
Tlenki i wodorki
Tlenki EnOm
Cl2O4
tlenek chloru (VII)
NO2
tlenek azotu (IV)
Al2O3
tlenek glinu
FeO
tlenek żelaza (II)
Cs2O
tlenek cezu
Tlenku mieszane np. Pb2PbO4 tlenek diołowiu (II) ołowiu (IV)
Nadtlenki np.
H2O2
nadtlenek wodoru (woda utleniona)
BaO2
nadtlenek baru
KO2
nadtlenek potasu
Wodorki EnHm lub HmEn
NaH
wodorotlenek sodu
HI
jodek wodoru
HF
fluorek wodoru lub fluorowodór
Kwasy
Kwasy beztlenowe
HF
kwas flouorowodorowy
HCl
kwas chlorowodorowy (solny)
HBr
kwas bromowodorowy
Kwasy tlenowe
HNO3
kwas aotowy
HClO2
kwas chlorowy
H3PO4
kwas fosforowy
Sole
Sole obojętne – MnRm
M – kation metalu
Wodorosole – Mn(HR)m
R – reszta kwasowa
Hydroksysole – [M(OH)nRm
M(OH)k – kation metalu połączony z jonem
Wodorotlenkowym
Au 2S
siarczek słota
CuNaO3
azotan miedzi
CaCo3
węglan wapnia
Związki kompleksowe
Kn[Fe(CN)6]
Na2[Zn(OH)6]
[Cr(H2O) 6]Cl3
Na3[Ag(S2O3)2]
[Fe(CO)5]
heksacyjanożelazian (II) potasu
tatrahydroksocynkan sodu
chlorek heksaakwachromu (III)
bis tiosiarczan (VII) srebra(I) sodu
pentakarbonylżelaza
5. Konfiguracja elektronowa atomu:
Konfiguracją elektronową nazywa się zapis przedstawiający poszczególne powłoki,
podpowłoki i orbitale atomu wraz z obsadzającymi je elektronami.
1
2
3
4
5
6
Powłoka Maksymalna liczba elektronów (2n2)
K
2
L
8
M
18
N
32
O
50
P
72
Podpowłoki
S
liczba elektronów
2
P
D
6
10
poziomy orbitalne
F
14
Kolejość zapełniania orbitali przez elektrony
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s
np.
Cl
K2L8M6N1
lub 17Cl: 1s22s22p63s23p5
Zapis skrócony : [Ne] 3s2sp5
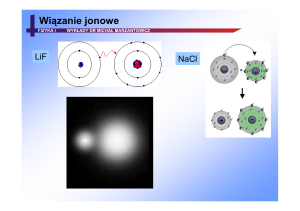
6. Wiązania w cząsteczkach i w sieci krystalicznej
Wiązanie jonowe – powstają między jonami. Jony tworzą się w wyniku przeniesienia
elektronu lub elektronów z atomu jednego pierwiastka do atomów drugiego. Wiązanie jonowe
występuje przy pierwsiastkach różniących się znaczenie elektroujemnością x>1,7. jeden z
pierwiastków musi wykazywać tendencją do oddawania drugi do przyjmowania elektronów.
Wiązanie atomowe – powstaje między identycznymi atomami jednego pierwiastka. Proces
jego tworzenia polega na uwspólnianiu elektronów pochodzących od obu atomów x=0
Wiązanie kowalencyjne spolaryzowane – zachodzą przez uwzspólnienie elektronów
walencykjnych. Różnica w elektroujemności nieznaczna x<1,7 przyczynia się do polaryzacji
wiązania czyli rpzesunięcia wspólnej pary elektronów w stronę pierwiastka bardziej
elektroujemnego.
Wiązanie koordynacyjne – następuje w wyniku uwspólnienia pary elektronowej pochodzącej
od jednego z atomów. Pierwiastek dający parę eletronów to donor, biorca tej pary to
akceptor.
Wiązanie metaliczne – polega na oddziaływaniu elektrostatycznym kationów metali i
elektronów. Jest przykładem zaawansowanego uwspólnienia elektronów polegającego na
powstaniu chmury elektronowej.
7. Wzory strukturalne (elektronowe)
Wzory strukturalne przekstawiając sposób i kolejność połączenia atomó w cząsteczce z
uwzględznieniem wartościowości poszczególnych pierwiastków, każde wiązanie
przedstawia się umownie za pomocą kreski
Np.
Fe2O3
O=Fe-O-Fe=O
F2
lub
8. Hybrydyzacja orbitali atomowych (typy hybrydyzacji, kształt cząsteczek)
Hybrydyzacja nie jest procesem realnym. To jedynie operacja matematyczna na funkcjach
falowych opisujących elektrony różnych podpowłok. W wyniku tej operacjoi otrzymujemy
funkcje falowe opisujące równocenne energetycznie elektrony znajdujące się na
równoważnych geometrycznie orbitalach. Hybrydyzacja polega na umieszczaniu