DZIAŁ I. BUDOWA ATOMÓW
( zakres rozszerzony)
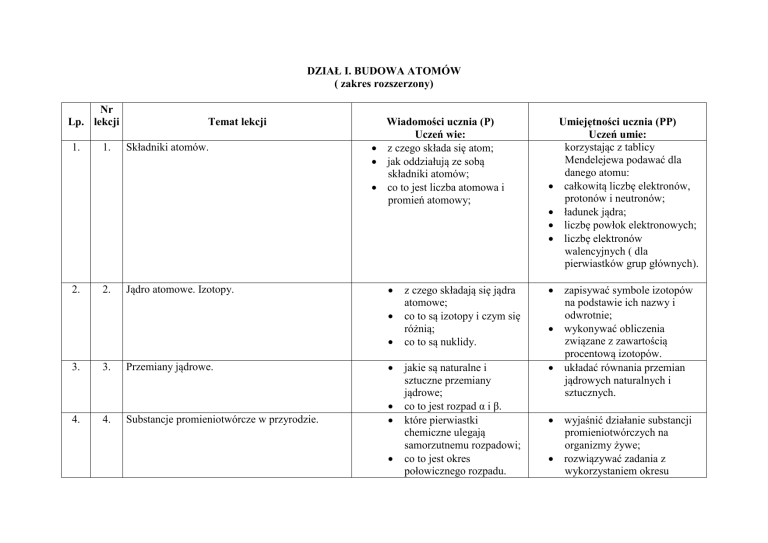
Nr
Lp. lekcji
1.
2.
1.
2.
Temat lekcji
Składniki atomów.
Jądro atomowe. Izotopy.
Wiadomości ucznia (P)
Uczeń wie:
z czego składa się atom;
jak oddziałują ze sobą
składniki atomów;
co to jest liczba atomowa i
promień atomowy;
3.
3.
Przemiany jądrowe.
4.
4.
Substancje promieniotwórcze w przyrodzie.
z czego składają się jądra
atomowe;
co to są izotopy i czym się
różnią;
co to są nuklidy.
jakie są naturalne i
sztuczne przemiany
jądrowe;
co to jest rozpad α i β.
które pierwiastki
chemiczne ulegają
samorzutnemu rozpadowi;
co to jest okres
połowicznego rozpadu.
Umiejętności ucznia (PP)
Uczeń umie:
korzystając z tablicy
Mendelejewa podawać dla
danego atomu:
całkowitą liczbę elektronów,
protonów i neutronów;
ładunek jądra;
liczbę powłok elektronowych;
liczbę elektronów
walencyjnych ( dla
pierwiastków grup głównych).
zapisywać symbole izotopów
na podstawie ich nazwy i
odwrotnie;
wykonywać obliczenia
związane z zawartością
procentową izotopów.
układać równania przemian
jądrowych naturalnych i
sztucznych.
wyjaśnić działanie substancji
promieniotwórczych na
organizmy żywe;
rozwiązywać zadania z
wykorzystaniem okresu
5.
5.
Elektron w ujęciu mechaniki kwantowej
6.
6.
Atom wodoru. Powłoki i podpowłoki
elektronowe.
7.
7.
Obszar orbitalny.
8.
8.
Budowa atomów wieloelektronowych.
jaka jest historia badań nad
budową atomu;
co to jest dualizm
korpuskularno – falowy;
co to jest zasada
nieoznaczoności
Heisenberga;
co to są tory elektronów i
powłoki elektronowe;
co to są stany stacjonarne
elektronów i w jaki sposób
może nastąpić ich zmiana;
jakie są symbole i
pojemność powłok.
co to są liczby kwantowe i
jakie mogą przyjmować
wartości;
co to są powłoki i
podpowłoki elektronowe
oraz poziomy orbitalne;
jaka jest pojemność
powłok i podpowłok
elektronowych.
co to są obszary orbitalne;
jakie liczby kwantowe i w
jaki sposób mają wpływ na
obszary orbitalne.
dlaczego do układów
wieloelektronowych
stosuje się przybliżone
połowicznego rozpadu.
na czym polega kwantowanie
energii elektronów;
obliczać maksymalne ilości
elektronów w danej powłoce;
zapisać konfigurację
powłokową i podać liczbę
elektronów walencyjnych dla
pierwiastków grup głównych.
za pomocą liczb kwantowych
opisywać stany kwantowe;
ustalać liczbę stanów
kwantowych w powłokach,
podpowłokach i poziomach
orbitalnych;
ustalać liczbę poziomów
orbitalnych w powłokach i
podpowłokach.
- wykonywać szkic konturu
orbitalu s i orbitalu p.
zapisywać konfigurację
powłokową dla wszystkich
pierwiastków;
metody obliczeń i jakie
dają one wyniki;
na jakich zasadach ze
wzrostem liczby atomowej
wzrasta liczba elektronów
w powłokach.
czego dotyczy i jak brzmi
zakaz Pauliego i reguł Hunda.
9.
9.
Reguła Hunda i zakaz Pauliego.
10.
10.
Zależność budowy atomu od położenia w układzie
okresowym.
jak z budowy atomu wynika
prawo okresowości (ujęcie
makro- i mikroskopowe);
co to są bloki konfiguracyjne
w układzie okresowym.
Co to jest okres, grupa
poboczna i główna;
11.
12.
13.
11.
12.
13.
Powtórzenie wiadomości.
Sprawdzian pisemny.
Omówienie i poprawa sprawdzianu.
-
wyodrębniać w zapisach
konfiguracji elektronowej
rdzeń i elektrony walencyjne;
stosować formę graficzną
zapisu elektronów na
podpowłokach zgodnie z
regułą Hunda i zakazem
Pauliego;
dysponując tablicą
Mendelejewa zapisywać
konfigurację powłokową,
podpowłokową, zapis
graficzny zgodny z regułą
Hunda i skróconą konfigurację
podpowłokową ( za pomocą
gazu szlachetnego)
zaliczać poszczególne
pierwiastki do odpowiednich
bloków konfiguracyjnych s, p,
d i f.
definiować prawo okresowości
w ujęciu mikroskopowym;












