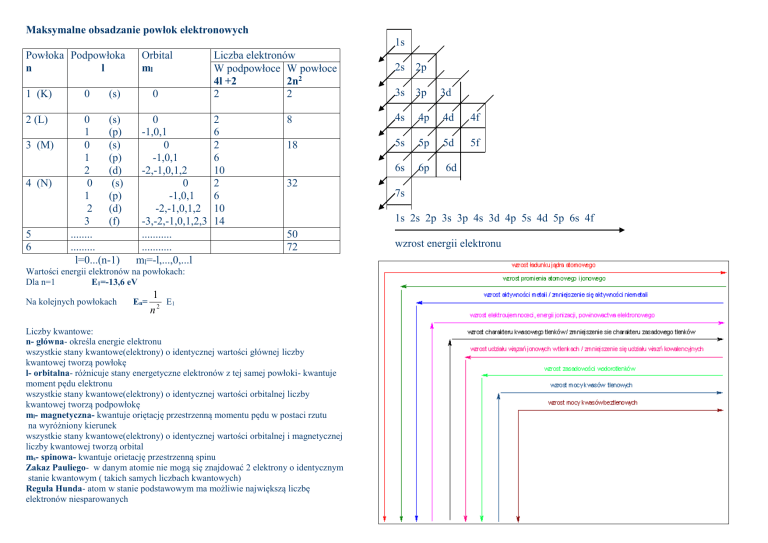
Maksymalne obsadzanie powłok elektronowych
1s
Powłoka Podpowłoka
n
l
1 (K)
2 (L)
3 (M)
4 (N)
5
6
0
Orbital
ml
(s)
0
(s)
1
(p)
0
(s)
1
(p)
2
(d)
0
(s)
1
(p)
2
(d)
3
(f)
........
.........
l=0...(n-1)
0
0
-1,0,1
0
-1,0,1
-2,-1,0,1,2
0
-1,0,1
-2,-1,0,1,2
-3,-2,-1,0,1,2,3
...........
...........
ml=-l,...,0,...l
Liczba elektronów
W podpowłoce W powłoce
4l +2
2n2
2
2
2
6
2
6
10
2
6
10
14
2s
2p
3s
3p
3d
8
4s
4p
4d
4f
18
5s
5p
5d
5f
6s
6p
6d
32
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f
50
72
Wartości energii elektronów na powłokach:
Dla n=1
E1=-13,6 eV
Na kolejnych powłokach
En=
7s
1
E1
n2
Liczby kwantowe:
n- główna- określa energie elektronu
wszystkie stany kwantowe(elektrony) o identycznej wartości głównej liczby
kwantowej tworzą powłokę
l- orbitalna- różnicuje stany energetyczne elektronów z tej samej powłoki- kwantuje
moment pędu elektronu
wszystkie stany kwantowe(elektrony) o identycznej wartości orbitalnej liczby
kwantowej tworzą podpowłokę
ml- magnetyczna- kwantuje oriętację przestrzenną momentu pędu w postaci rzutu
na wyróżniony kierunek
wszystkie stany kwantowe(elektrony) o identycznej wartości orbitalnej i magnetycznej
liczby kwantowej tworzą orbital
ms- spinowa- kwantuje orietację przestrzenną spinu
Zakaz Pauliego- w danym atomie nie mogą się znajdować 2 elektrony o identycznym
stanie kwantowym ( takich samych liczbach kwantowych)
Reguła Hunda- atom w stanie podstawowym ma możliwie największą liczbę
elektronów niesparowanych
wzrost energii elektronu












