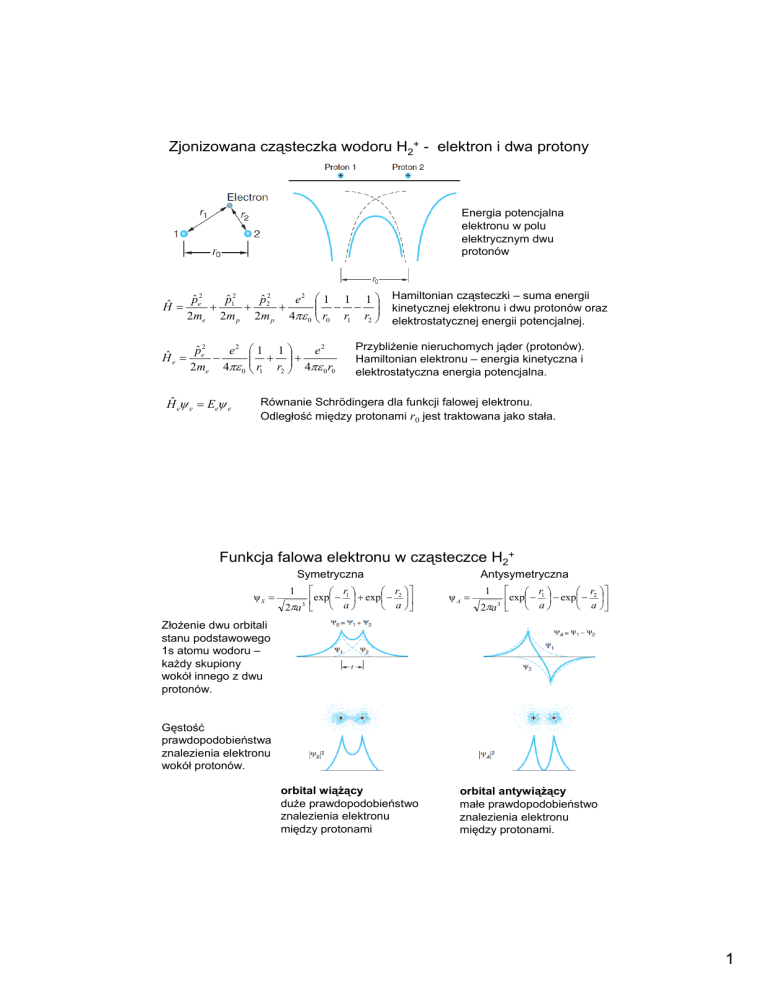
Zjonizowana cząsteczka wodoru H2+ - elektron i dwa protony
Energia potencjalna
elektronu w polu
elektrycznym dwu
protonów
pˆ 2
pˆ 2
pˆ 2
e 2 ⎛ 1 1 1 ⎞ Hamiltonian cząsteczki – suma energii
⎜ − − ⎟ kinetycznej elektronu i dwu protonów oraz
Hˆ = e + 1 + 2 +
2me 2m p 2m p 4πε 0 ⎜⎝ r0 r1 r2 ⎟⎠ elektrostatycznej energii potencjalnej.
pˆ 2
e2 ⎛ 1 1 ⎞
e2
⎜⎜ + ⎟⎟ +
Hˆ e = e −
2me 4πε 0 ⎝ r1 r2 ⎠ 4πε 0 r0
Hˆ eψ e = Eeψ e
Przybliżenie nieruchomych jąder (protonów).
Hamiltonian elektronu – energia kinetyczna i
elektrostatyczna energia potencjalna.
Równanie Schrödingera dla funkcji falowej elektronu.
Odległość między protonami r0 jest traktowana jako stała.
Funkcja falowa elektronu w cząsteczce H2+
Symetryczna
⎡ ⎛ r1 ⎞
⎛ r ⎞⎤
ψS =
exp⎜ − ⎟ + exp⎜ − 2 ⎟⎥
3 ⎢
a
⎝ a ⎠⎦
⎠
2πa ⎣ ⎝
1
Antysymetryczna
ψA =
⎡ ⎛ r1 ⎞
⎛ r2 ⎞⎤
⎢exp⎜ − a ⎟ − exp⎜ − a ⎟⎥
⎝
⎠⎦
⎠
2πa ⎣ ⎝
1
3
Złożenie dwu orbitali
stanu podstawowego
1s atomu wodoru –
każdy skupiony
wokół innego z dwu
protonów.
Gęstość
prawdopodobieństwa
znalezienia elektronu
wokół protonów.
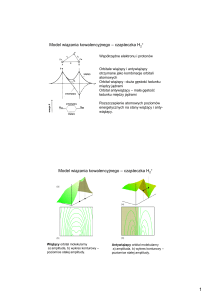
orbital wiążący
duże prawdopodobieństwo
znalezienia elektronu
między protonami
orbital antywiążący
małe prawdopodobieństwo
znalezienia elektronu
między protonami.
1
Orbitale molekularne - cząsteczka H2+
Wiążący orbital molekularny
a) amplituda, b) wykres konturowy –
poziomice stałej amplitudy.
Antywiążący orbital molekularny
a) amplituda, b) wykres konturowy –
poziomice stałej amplitudy.
Cząsteczka H2+ - zależność energii od odległości między protonami
Rozszczepienie poziomu energii atomu wodoru
na dwa poziomy energii cząsteczki H2+
niższy wiążący i wyższy antywiążący.
Up energia potencjalna odpychania protonów
EA energia elektronu na orbitalu antywiążącym
ES energia elektronu na orbitalu wiążącym
Up+EA energia układu z elektronem na orbitalu
antywiążącym – jest wyższa niż elektronu w
stanie podstawowym atomu wodoru, nie ma
minimum.
Up+ES energia układu z elektronem na orbitalu
wiążącym – tworzy się cząsteczka H2+
Energia cząsteczki jest minimalna, gdy odległość
między protonami jest r0=0,106 nm
Energia wiązania 2,7 eV.
2
Wiązanie kowalencyjne – cząsteczka H2
W atomie wodoru elektron 1s ma energię -13,6 eV.
W cząsteczce wodoru dwa elektrony na orbitalu
wiążącym mają energię niższą niż -27,2 eV.
Energia ma minimum, gdy odległość między
protonami jest 0,074 nm, energia wiązania 4,5 eV.
Tworzenie się wiązania
między dwoma atomami
wodoru - cząsteczka H2
Cząsteczki dwuatomowe – wiązanie tworzone przez elektrony z orbitali p
Atom azotu ma 3 elektrony 2p. Wiązanie w
cząsteczce azotu N2 składa się z trzech
orbitali wiążących jednego σ i dwu π. Energia
wiązania 9,8 eV.
Nałożenie dwu orbitali atomowych p o
kierunku osi cząsteczki tworzy orbital
molekularny σ o symetrii osiowej.
Nałożenie dwu orbitali atomowych p o
kierunku prostopadłym do osi cząsteczki
tworzy orbital molekularny π.
Wiązanie π jest słabsze od wiązania σ.
Atom tlenu ma 4 elektrony 2p. Cząsteczka
O2 ma dodatkowo zapełniony jeden orbital
antywiążący p – energia wiązania 5,1 eV.
Atom fluoru ma 5 elektronów 2p. Cząsteczka
F2 ma zapełnione dwa orbitale antywiążące –
energia wiązania 1,6 eV.
3
Cząsteczka wody H2O
Wiązania σ z nałożenia orbitali atomowych H 1s i O 2p.
Dwie wolne pary elektronów walencyjnych pozostają przy
atomie tlenu. Wiązanie jest kierunkowe. Cząsteczka wody
jest dipolem elektrycznym.
Kierunkowość wiązań kowalencyjnych
Przekrywanie się orbitali „wodorowych” s i
p sąsiednich atomów: a) oddziaływanie
znosi się, b) efektywne przekrywanie s i py
Fulleren C60
4
Hybrydyzacja
Obniżenie energii przy przekrywaniu się większej ilości orbitali – hybrydyzacja.
Kształty orbitali po hybrydyzacji muszą być jednakowe !
Hybrydyzacja sp3
Elektron jest przenoszony
ze orbitalu s na p.
Orbital s i 3 orbitale p
mieszają się i tworzą 4
jednakowe orbitale sp3.
Hybrydyzacja sp3
Cząsteczka metanu NH4
5
Hybrydyzacja sp2
Grafit
kąt 120°
Hybrydyzacja sp
Cząsteczki o budowie liniowej
Acetylen C2H2
kąt 180°
6
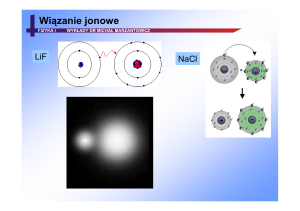
Wiązanie jonowe
KCl
LiF
7
Wiązanie jonowe
energia dysocjacji
Ed = E + + E − −
e2
4πε 0 r
+
A
r
n −1
energia odpychania
przy przekrywaniu
powłok elektronowych
energia jonizacji
powinowactwo elektronowe
elektrostatyczna energia przyciągania
NaCl
Siły i energia potencjalna w zależności od odległości między jonami o
przeciwnych ładunkach
Siła przyciągania elektrostatycznego
Fattr ~ -1/r2
Siła odpychania przy przekrywaniu
powłok elektronowych Frep~ 1/rn
Wartość wykładnika n zależy od
rdzenia jonu: [He] n=5, [Ne] n=7,
[Ar] n=9, [Kr] n=10, [Xe] n=12
Minimum energii sieciowej:
E min = −
N A AZ + Z − e 2
4πε 0 a 0
⎛ 1⎞
⎜1 − ⎟
⎝ n⎠
8
Kryształy jonowe
Sól kuchenna – chlorek sodu
NaCl
CsCl
Struktura ciasnego upakowania
Kryształy jonowe są kruche – pękają pod wpływem naprężeń
Wiązanie molekularne Van der Waalsa
-Występuje zawsze
-Wiąże atomy o zamkniętych powłokach,
nasycone cząsteczki (kryształy molekularne)
-Duży promień atomowy
-Źródło: fluktuacje ładunku w atomach,
indukowany dipolowy moment elektryczny
atomów i cząsteczek
Zależność energii potencjalnej od
odległości w wiązaniu Van der
Waalsa może być przybliżona
potencjałem Lennarda-Jonesa
9
Wiązanie wodorowe
-Atom wodoru wiąże się z dwoma innymi atomami
-Elektron z wodoru prawie całkowicie przeniesiony
na silnie elektroujemny atom
-Proton może przyciągnąć kolejny ujemnie
naładowany atom
Symetryczne: A-H-A
Antysymetryczne: A-H...B
Wiązanie wodorowe:
¾ oddziaływanie między spolaryzowany wiązaniem A__H a
centrum protono-akceptorowym B: δ− δ+
A___H.....B
¾ donorem protonu A__H może być OH, NH, SH, CH ....
¾silne wiązanie, gdy B jest elektroujemnym atomem (O, N, F, S) i
ma wolną parę elektronową (energia wiązania około 0,3 eV)
¾ atom wodoru pozbawiony elektronu jest gołym protonem
¾ następuje nakrywanie chmur elektronowych A i B ściąganych
przez proton mostkowy pozbawiony elektronu
¾ odległość między jądrami atomów A i B jest mniejsza od sumy
promieni van der Waalsa tych atomów nawet o 0,06 nm
¾ potencjał odpychania narasta mniej stromo niż w innych
wiązaniach
¾ może pojawić się drugie minimum potencjału dla protonu
¾ możliwe przeniesienie protonu w wiązaniu od A do B
10
Wiązanie wodorowe
Wiązanie metaliczne
-Funkcje falowe zewnętrznych elektronów
ulegają przekrywaniu.
-Konsekwencją przekrywania się jest
rozszczepienie poziomów energii
utworzenie pasma energii.
-Chmura elektronowa rozkłada się na cały
kryształ poprzez przyciąganie elektronów
do kolejnych jąder atomowych.
-Nie ma wyróżnionego kierunku wiązania,
struktura krystaliczna związana z gęstym
upakowaniem w przestrzeni.
„Morze” swobodnych elektronów pomiędzy „rdzeniami” atomowymi o ładunku
dodatnim.
11
Wiązanie metaliczne
Metale grupy 1 wnoszą do wiązania
tylko po jednym elektronie – niska
temperatura topnienia (np. sód Na
98°C).
Im więcej elektronów bierze udział w
wiązaniu, tym silniejsze wiązanie (np.
magnez Mg – 2 elektrony - 650°C).
Własności metali:
-dobre przewodnictwo
elektryczne,
-dobre przewodnictwo cieplne,
-własności mechaniczne
(plastyczność, sprężystość).
Klasyfikacja ciał stałych na podstawie typu wiązania
Rozkład przestrzenny elektronów walencyjnych
12
Korelacja między
energią spójności
(kohezji) a temperaturą
topnienia ciał stałych
Temperatury topnienia
ciał stałych o różnych
rodzajach wiązań
13