Beata Sławińska
Scenariusz lekcji chemii
Temat: Podsumowanie wiadomości o układzie okresowym.
I GŁÓWNE ZAGADNIENIA LEKCJI
Budowa układu okresowego pierwiastków
Zależność między budową atomu a położeniem pierwiastka w układzie okresowym
Elektroujemność pierwiastków
Typy wiązań chemicznych:
wiązanie atomowe
wiązanie atomowe spolaryzowane
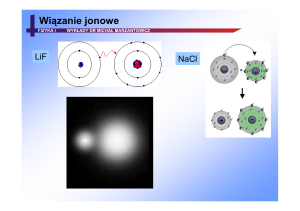
wiązanie jonowe
wiązanie koordynacyjne
wiązanie metaliczne
wiązanie wodorowe
5. Zależność właściwości substancji od rodzaju wiązania chemicznego
1.
2.
3.
4.
II CELE OPERACYJNE
Po zakończeniu lekcji uczeń potrafi:
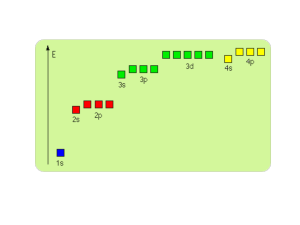
podzielić układ okresowy na bloki: s, p, d, f
wskazać odpowiedni typ wiązania w danej cząsteczce na podstawie
różnicy elektroujemności
rysować wzory elektronowe, kreskowe dla cząsteczek o wiązaniach kowalencyjnych oraz ustalać z jakich jonów jest zbudowana cząsteczeka o wiązaniu
jonowym
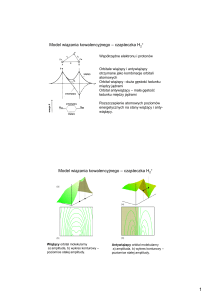
rysować orbitale atomowe typu s, px, py, pz oraz orbitale cząsteczkowe σ i π
wskazać cząsteczki, w których występuje wiązanie koordynacyjne
zapisać sposób tworzenia się wiązania koordynacyjnego w cząsteczkach NH4+,
H3O+
analizować tworzenie się wiązania wodorowego w wodzie i wiązania metalicznego na przykładzie litu
porównać właściwości związków chemicznych o budowie kowalencyjnej i
jonowej
przewidzieć zależność między rodzajem wiązania a właściwościami tlenków
III METODY LEKCJI
naprowadzająca z elementami metody problemowej
metoda „burzy mózgów”
IV ŚRODKI DYDAKTYCZNE
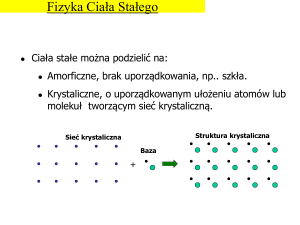
modele sieci krystalicznej diamentu i grafitu
model sieci krystalicznej chlorku sodu
V PRZEBIEG LEKCJI
1. Wprowadzenie
podanie tematu lekcji
przypomnienie najważniejszych zagadnień z działu o budowie układu
okresowego
2. Rozwinięcie
Nazwa
i symbol
pierwiastka
Numer
grupy
określanie typu wiązań w niżej podanych cząsteczkach: H2O, O2, NH3,
N2, HCl, CaCl2, CsF, NaCl
rysowanie wzorów elektronowych i kreskowych bądź ustalanie z jakich
jonów są zbudowane
pokaz modelu sześciennej sieci krystalicznej chlorku sodu
rysowanie orbitali molekularnych dla cząsteczki O2
uzupełnienie tabeli
Numer
okresu
Liczba
atomowa
Z
Liczba
protonów
Liczba
elektronów
Liczba powłok
elektronowych
Konfiguracja
elektronowa
Liczba
elektronów
walencyjnych
12
2
2
6
2
1s 2s 2p 3s 3p
1
3
2
wskazanie wiązania koordynacyjnego w: H3O+, NH4+
analiza schematu - wiązanie metaliczne na przykładzie litu
3. Podsumowanie
4.Ewaluacja
podział klasy na trzy grupy - wypisanie najważniejszych właściwości
związków kowalencyjnych (gr. I ), jonowych ( gr.II ), metalicznych (gr. III)
połączone z pokazem modelu diamentu i grafitu oraz sporządzenie wspólnej tabeli