Wykład II
Fizyka Ciała Stałego
Ciała stałe można podzielić na:
•Amorficzne, brak uporządkowania, np.
szkła;
•Krystaliczne, o uporządkowanym
ułożeniu atomów lub molekuł tworzącym
sieć krystaliczną.
Struktura krystaliczna
Struktura amorficzna
Sieć krystaliczna
Dwuwymiarowa sieć. Pokazano komórkę elementarną i jej translację o wektor sieci
r = 3a + 2b.
Płaszczyzny i kierunki sieciowe
• Wskaźniki Millera h,k,l płaszczyzn sieciowych
1. Znajdujemy przecięcia płaszczyzny z osiami i wyrażamy je jako iloczyny liczb
całkowitych przez wektory bazowe.
2. Liczymy odwrotności tych liczb całkowitych. Wskaźniki h, k, l stanowią trzy
najmniejsze liczby całkowite mające ten sam stosunek.
3. Wskaźnik: (hkl)
Przykład:
przecięcia: 2, 4, 1
odwrotności: ½, ¼, 1
Najmniejsza wspólna
wielokrotność: 4
Mnożymy każdy ułamek przez tę
wielokrotność: 2, 1, 4
płaszczyzna: (214)
• Biorąc odwrotności przecięć unika się nieskończoności w notacji
(Np.) Przecięcie z osią płaszczyzny równoległej do osi jest równe
nieskończoności; odwrotność – jest równa zeru.
• Jeśli płaszczyzna przechodzi przez początek układu, można ją przesunąć
równolegle aby znaleźć wskaźniki Millera.
• Ujemne przecięcie : znak minus przed wskaźnikiem Millera
_
h k l
Równoważność płaszczyzn sieci regularnej (płaszczyzn {100}) uzyskanych
przez rotację komórki elementarnej.
Kierunki sieciowe
[hkl] : kwadratowe nawiasy – kierunek
płaszczyzny (hkl)
Kierunki dla sieci regularnej
prostopadły do
Kryształy
• Występuje tu uporządkowane ułożenie atomów
tworzących sieć krystaliczną.
• Mamy 14 typów sieci krystalicznych różniących się
komórkami elementarnymi.
Powierzchniowo
centrowana.
Kubiczna
Objętościowo centrowana.
Typy trójwymiarowych sieci krystalicznych Bravais
regularna
a=b=c
==
tetragonalna
a=bc
= = = 90o
jednoskośna
abc
= = 90o
90o
ortorombowa
abc
= = = 90o
trygonalna
a=b=c
= = 90o
heksagonalna
trójskośna
a=bc
abc
= = 90o; = 120o 90o
Fizyka Ciała Stałego
Struktura krystaliczna
Sieć krystaliczna
Baza
+
O właściwościach ciała stałego decyduje:
•Struktura krystaliczna (rodzaj sieci)
•Wiązania chemiczne (rodzaj atomów w sieci)
Wiązania chemiczne
Typy:
Wiązania jonowe
Si
e-
Wiązania kowalencyjne
e-
h+
h+
e- : elektrony
h+: dziury
Wiązania metaliczne
Wiązania Van der Wallsa
+
-
+
-
Wiązania jonowe
• Powstają
gdy następuje transfer ładunku od jednego atomu do
drugiego
* Dwa atomy tworzą w ten sposób układ dwu jonów o
przeciwnych znakach
* Typowym przykładem jest tu kryształ NaCl powstający w
wyniku transferu elektronu z sodu do chloru
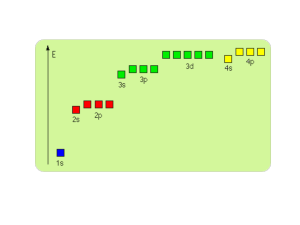
Struktura elektronowa atomu Na 1s2 2s2 2p6 3s1
Struktura elektronowa atomu Cl
Na
Cl
+
–
1s2 2s2 2p6 3s2 3p5
+
–
Wiązania jonowe
Potencjał odpychający
1/rm
Energia całkowita
1 e2 B
U
m
40 r r
- stała Madelunga, dla
NaCl wynosi 1.75;
m jest małą liczbą
naturalną.
Przyciągający potencjał
kulombowski -1/r
U0 jest energią kohezji, czyli
energią na jeden jon potrzebną do
„usunięcia” go z kryształu
e2 1
U0
1
40 r0 m
Chlorek sodu
• Sieć powierzchniowo centrowana
• Ilość atomów w komórce elementarnej :
1 Na w środku i 12 x 1/4 Na na
krawędziach = 4 Na
8 x 1/8 Cl w narożnikach i 6 x 1/2 Cl na
powierzchniach = 4 Cl
Na4Cl4 czyli NaCl
•Każdy jon Na+ jest otoczony
przez 6 jonów Cl-.
•Każdy jon Cl- jest otoczony
przez 6 jonów Na+.
Własności kryształów jonowych
• Duża energia kohezji (2-4 eV/ atom).
– Powoduje wysoką temperaturę topnienia i wrzenia.
• Niskie przewodnictwo elektryczne.
– Brak swobodnych elektronów.
• Przeźroczyste dla światła widzialnego.
– Energia pomiędzy najbliższymi poziomami większa niż 3 eV.
• Rozpuszczalne w wodzie.
– Dipole elektryczne wody przyciągają jony.
WIĄZANIE KOWALENCYJNE
Molekuła H2
• Tworzenie wiązania kowalencyjnego w molekule H2
• Elektron w jednym atomie przyciągany jest przez jądro
drugiego. Wiązanie tworzy się poprzez uwspólnienie
elektronów
Molekuła H2 - wiązanie kowalencyjne
• Dwie możliwości dla wartości całkowitego
spinu S elektronów.
a) Ułożenie równoległe
S = 1/2 + 1/2 = 1
b) Ułożenie antyrównoległe
S = +1/2 + (-1/2) = 0
Molekuła H2 - wiązanie kowalencyjne
• Jeżeli spiny są takie same (S =1), dwa
elektrony nie mogą być w tym samym
miejscu ( zakaz Pauliego) w tym
samym stanie energetycznym.
• Rozkład prawdopodobieństwa
znalezienia elektronu w środku między
atomami równa się zeru
• W rezultacie atomy będą się odpychać
i nie wystąpi wiązanie.
chmura elektronowa
gęstość prawdopodobieństwa
Molekuła H2 - wiązanie kowalencyjne
• Dla spinów przeciwnych (S = 0), oba
elektrony mogą być w tym samym
miejscu ( ich funkcje falowe mogą się
chmura elektronowa
przekrywać) .
gęstość prawdopodobieństwa
• Oba elektrony mogą przebywać
pomiędzy atomami, następuje
uwspólnienie elektronów.
Molekuła H2 - wiązanie kowalencyjne
Antywiążące
molekuła H2
2s
wiążące
Antywiążące
2 elektrony wiążące
0 antywiążących
1s
wiążące
Atom krzemu
Si : Z = 14, konfiguracja elektronowa 1s22s22p63s23p2
zamknięte powłoki K i L : Ne (Z = 10) (1s22s22p6) + 4 elektrony
na podpowłoce M (3s23p2) = [Ne]3s23p2
4 valencyjne elektrony w Si : 2 valencyjne elektrony w stanie
s + 2 w stanie p
Struktura elektronowa i poziomy
energetyczne w atomie Si:
(a)
model orbitalny atomu Si z
10 elektronami rdzenia (n
= 1 i 2), oraz 4 walencyjne
elektrony (n = 3);
(b) poziomy energetyczne w
coulombowskiej studni
potencjału.
Zhybrydyzowane orbitale SP3 w Si
[Linear Combinations of Atomic Orbitals (LCAO)]
Z rozw. równania Schrodingera dla atomu Si otrzymuje się radialną i kątową
zależność funkcji falowej dla elektronu (tzw. orbitale).
Dla podpowłoki walencyjnej (n=3) z dwoma elektronami w stanie 3s i dwoma w
stanie 3p:
- orbital 3s jest sferycznie symetryczny i jest dodatni. Orbital ten może zgodnie z
zasadą Pauliego pomieścić 2 elektrony o przeciwnych spinach
- są 3 orbitale 3 p (px, py, pz) wzajemnie prostopadłe o kształcie maczugi z
dodatnią i ujemną cześcią. Podpowłoka 3p może pomieścić 6 elektronów, ale w Si
są tylko 2 elektrony.
Kiedy atomy Si zbliżają się do siebie, orbitale s i p przekrywają się –tracą
swój izolowany charakter prowadząc do 4 mieszanych orbitali sp3 tworzy
się tetragonalna komórka prymitywna typu struktury diamentu i blendy
cynkowej, typowe dla większości półprzewodników.
Wiązanie kowalencyjne
atom węgla, krzemu
2s
2p
C
Energia
Hybrydyzacja
2p
sp3
Tetraedr
109.5°
2s
1-s orbital + 3-p orbitale = sp3
Np. CH4
SP3 hybrydyzacja orbitalu w sieci Si
Orbitale w izolowanym atomie Si i hybrydyzacja w sieci krystalicznej Si
Sieć diamentu, germanu, krzemu
diament –wszystkie atomy jednego rodzaju: Ge, Si, -Sn
Krzem
Konfiguracja w izolowanym atomie Si:
1s22s22p63s23p2
-Każdy atom ma dwa stany1s
dwa 2s, 6sześć stanów 2p,
dwa 3s, sześć 3p i wyższe
-Dla N atomów, dostępnych jest
2N stanów 1s, 2N stanów
2s, 6N stanów 2p, 2N
stanów 3s i 6N stanów 3p
-Po zbliżeniu atomów
największemu rozszczepieniu
ulegają stany 3s i 3p. Stany te
mieszają się dając 8N stanów.
-Przy odległości
równowagowej, pasmo to
rozszczepia się na dwa
pasma oddzielone przerwą
Eg. Górne pasmo –
przewodnictwa zawiera 4N
stanów i dolne –
walencyjne, też 4N stanów.
Podpasma mogą łączyć się, jak np. w Si, gdzie 4 podpasma łączą się
w pasmo walencyjne
Sieć blendy cynkowej (ZnS, GaAs)
– co najmniej dwa rodzaje atomów: ZnS, półprzewodniki
grupy III-V (GaAs) i II-VI (CdTe, HgTe)
- dwie sieci płasko centrowane, przesunięte względem
siebie o ¼ głównej przekątnej.
Położenia atomów: (0,0,0) (¼, ¼, ¼)
Wiązanie kowalencyjne spolaryzowane
Właściwości ciał o wiązaniach kowalencyjnych
• Tworzone za pomocą silnych, zlokalizowanych wiązań.
• Duża energia kohezji większa niż dla kryształów jonowych
(4-7 eV/atom).
– Wysoka temperatura topnienia i wrzenia.
• Niskie przewodnictwo elektryczne.