DEFINICJE
Grupa funkcyjna jest to ugrupowanie atomów powtarzające się w
cząsteczkach całej klasy związków chemicznych, nadające substancji
określone specyficzne właściwości chemiczne.
Rzędowość atomu węgla – liczba atomów węgla, z którymi jest połączony
dany rozpatrywany atom.
Izomeria – zjawisko występowania dwóch lub większej liczby związków
o takim samym wzorze sumarycznym, różniących się sposobem połączenia
atomów (konstytucyjna, szkieletowa, łańcuchowa) lub ich rozmieszczeniem
w przestrzeni (stereoizomeria, izomeria przestrzenna).
Szereg homologiczny – szereg związków zawierających takie same grupy
funkcyjne, których szkielet węglowy różni się dla kolejnych przedstawicieli
o grupę CH2.
Elektroujemność atomów — zdolność atomów danego pierwiastka do
przyciągania elektronów. Według R.S. Mullikena, wartość elektroujemności
jest średnią arytmetyczną z powinowactwa elektronowego i pierwszej energii
jonizacji.
Według Paulinga różnica elektroujemności między pierwiastkami A i B wyraża się wzorem łączącym
w sobie energie dysocjacji połączeń chemicznych A-B, A-A, B-B. Obie miary elektroujemności są do
siebie w przybliżeniu proporcjonalne. Elektroujemność wzrasta w okresach układu okresowego od
litowców do fluorowców i maleje w poszczególnych grupach ze wzrostem liczby atomowej.
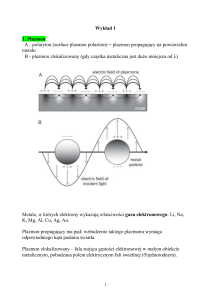
Rodzaje wiązań chemicznych: — oddziaływanie elektrostatyczne łączące
atomy w cząsteczkach związków chemicznych.
Rozróżnia się trzy rodzaje wiązań chemicznych:
1) kowalencyjne (atomowe, homeopolarne), powstają na skutek mieszania się
orbitali atomowych (orbital) jednakowych atomów lub, w cząsteczkach
heterojądrowych, atomów niewiele różniących się elektroujemnością — w
tym przypadku wiążąca para elektronowa jest przesunięta w kierunku atomu
bardziej elektroujemnego (tzw. wiązanie kowalencyjne spolaryzowane). Do
opisu tego typu wiązań chemicznych stosowana jest najczęściej metoda
orbitali molekularnych. Wiązania kowalencyjne posiadają np.: H2, CO2, SiC.
2) jonowe (heteropolarne, elektrowalencyjne, biegunowe, polarne), istniejące
pomiędzy atomami tak znacznie różniącymi się elektroujemnością, że można
założyć, iż cząsteczka jest utrzymywana w całości dzięki oddziaływaniom
elektrostatycznym pomiędzy ładunkami o przeciwnym znaku. Model
wiązania jonowego stosuje się głównie do ciał stałych (kryształów). Ten typ
wiązań chemicznych występuje np. w halogenkach litowców.
3) metaliczne będące oddziaływaniem pomiędzy zbiorowiskiem rdzeni
atomowych w sieci przestrzennej kryształu oraz swobodnymi elektronami,
które są wspólne dla całego kryształu.
Wiązanie kowalencyjne jest zorientowane w przestrzeni, wiązania jonowe i metaliczne są
bezkierunkowe (energia sieciowa kryształu).