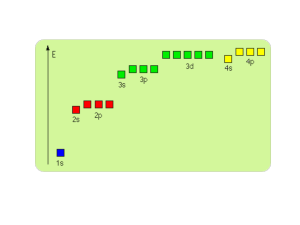
Budowa cząsteczki
o właściwości
związku – wiązania
międzycząsteczkowe
Cząsteczka, drobina, molekuła
- najmniejsza ilość związku chemicznego lub
pierwiastka zbudowana z określonej liczby atomów
tego samego lub różnych pierwiastków, istniejąca
trwale w określonych warunkach
- najmniejsza porcja związku lub pierwiastka biorąca
udział w reakcji chemicznej
- liczba atomów w cząsteczce zmienia się od 1 do
10^5
- istnienie cząsteczek złożonych z kilku atomów jest
możliwe dzięki siłom wiązań chemicznych
Atomy mogą łączyć się ze sobą, tworząc
inny rodzaj drobin, zwany cząsteczkami;
Substancja zbudowana z takich
cząsteczek nosi nazwę związku chemicznego.
Właściwości atomów i cząsteczek
Cząsteczka związku chemicznego składa się z połączonych
ze sobą wiązaniami atomów różnych pierwiastków.
Jednak jej właściwości są całkiem inne niż właściwości wchodzących w jej skład
atomów.
Na przykład rdza, której cząsteczka zbudowana jest z atomów żelaza i atomów
pierwiastka wchodzącego w skład powietrza, ma inne
właściwości niż żelazo i ten gazowy pierwiastek.
Dwutlenek węgla i woda są to zupełnie dwa różne związki chemiczne,
zbudowane z charakterystycznych dla siebie cząsteczek Można to porównać do sytuacji,
gdy na szklany filtr o barwie żółtej
nakładamy drugi filtr, o barwie niebieskiej. Otrzymamy wówczas
nowy filtr o barwie zielonej. Dlatego tez właściwości związku chemicznego różnią się
wyraźnie od właściwości pierwiastków, z których on powstał.
Atomy pierwiastków a cząsteczki związków chemicznych
Różne i wspólne właściwości atomów pierwiastków
i cząsteczek związków chemicznych pokazuje tabela:
Rodzaj właściwości
Najmniejsza
pierwiastka
Cząsteczki
Atomy
część
Najmniejsza
część
związku chemicznego
Obecne są w nich
wiązania chemiczne
Nie mają właściwości
takich
jak:
gęstość,
połysk,
barwa
i
temperatura topnienia
Są jednakowe dla danej
substancji
Wiązania chemiczne
Cząsteczki mogą mieć bardzo różną budowę. Jedne z nich zbudowane będą
tylko z dwóch atomów,
natomiast inne z kilku,
kilkunastu, kilkudziesięciu, a nawet kilkuset i więcej atomów.
Np.:
Cząsteczka jodowodoru
Cząsteczka amoniaku
Cząsteczki w zwykłych warunkach nie
rozpadają się na atomy.
Dlaczego?
Przyczyn należy szukać w budowie wchodzących w ich skład atomów.
Wiemy już, że wokół jądra atomowego istnieje przestrzeń,
w której znajdują się elektrony.
W odpowiednich warunkach zewnętrzne
elektrony jednych atomów z zewnętrznymi
elektronami innych atomów tworzą wiązania chemiczne.
Atomy poszczególnych pierwiastków mogą tworzyć różną,
charakterystyczną dla siebie,
liczbę wiązań.
Wiązania
międzycząsteczkowe
•
•
•
•
Wiązanie jonowe
Wiązanie kowalencyjne
Wiązanie kowalencyjne spolaryzowane
Wiązanie koordynacyjne
Wiązanie jonowe
• Elektrostatyczne oddziaływanie pomiędzy
jonami przeciwnych znaków
• Najczęściej występuje w sieciach krystalicznych
substancji stałych
• Powstaje między dwoma metalami w wyniku
przeniesienia elektronu lub elektronów od atomu
pierwiastka o mniejszej elektroujemności do
atomu pierwiastka o elektroujemności większej
Wiązanie kowalencyjne
• Atomy uzyskują trwałą konfigurację elektronową poprzez
uwspólnienie jednego lub kilku swoich elektronów z
elektronami innego atomu
• Powstaje wtedy, gdy 2 atomy mające niesparowane
elektrony stworzą z tych elektronów wspólną parę
elektronową
Wiązanie kowalencyjne
spolaryzowane
• Powstaje w wyniku utworzenia wspólnej pary
elektronowej przez atomy o różnej
elektroujemności
• Polaryzacja – przesunięcie pary i par wiążących
w kierunku atomów o większej elektroujemności
Wiązanie koordynacyjne
• Powstaje, gdy wspólna wiążąca para
elektronowa pochodzi w całości od jednego z
atomów
• Atom ten (dawca pary elektronowej – donor)
przekazuje swoją parę na wytworzenie wiązania,
ppodczas gdy drugi atom jest biorcą
(akceptorem) dawcy
Siły międzycząsteczkowesiły wiążące atomy i cząsteczki, oddziaływania
międzycząsteczkowe:
•
oddziaływania jon-jon - zachodzą między dwoma różnoimiennie naładowanymi
cząsteczkami - od wiązań jonowych różni je to, że ładunek w oddziałujących ze sobą
cząsteczkach nie jest skoncentrowany na jednym atomie, lecz jest zdelokalizowany
na kilku-kilkunastu atomach.
•
wiązanie wodorowe - tworzy się gdy atom wodoru z cząstkowym ładunkiem
dodatnim jest współdzielony przez dwie cząsteczki, które posiadają atomy z
cząstkowym ładunkiem ujemnym.
•
oddziaływania trwały dipol - trwały dipol - tworzą się między cząsteczkami
posiadającymi trwałe momenty dipolowe. Cząsteczki takie posiadają w jednych
miejscach nadmiar ładunku ujemnego, a w innych jego niedomiar. Oddziałują one ze
sobą tak jak jony - tyle, że oddziaływanie to jest słabsze.
•
oddziaływania van der Waalsa - są to oddziaływania między trwałym dipolem i
wzbudzonym dipolem lub między dwoma wzbudzonymi dipolami. W cząsteczkach,
które nie posiadają trwałego momentu dipolowego może on być wzbudzany przez
cząsteczki z trwałym momentem; następnie taki wzbudzony i trwały dipol oddziałują
na siebie podobnie jak dwa trwałe dipole, tyle że znacznie słabiej.
Oddziaływania międzycząsteczkowe
Oddziaływania między atomami w cząsteczkach należą do oddziaływań
silnych, których energie są większe niż 100 kJ/mol. Istnieją też znacznie
słabsze oddziaływania o energiach znacznie niższych od przytoczonej
wartości. Przyciąganie międzycząsteczkowe jest odpowiedzialne za łączenie
się atomów lub cząsteczek, ale jest ono ograniczone przez zjawisko
odpychania między jądrami oraz rdzeniami elektronowymi sąsiadujących
atomów.
Oddziaływania międzycząsteczkowe dzieli się na:
siły van der Waalsa
przeniesienie ładunku
wiązania wodorowe
Kompleksy z przeniesieniem ładunku.
Znane są związki, w których dwie cząsteczki wykazują słabe
wzajemne przyciąganie, ale jest ono silniejsze niż siły van der
Waalsa i słabsze niż wiązanie wodorowe. Układy takie nazywa
się kompleksami z przeniesieniem ładunku, gdyż następuje w
nich przeniesienie ładunku z jednego układu do drugiego. Stan
taki odpowiada utworzeniu bardzo słabo wiążącego orbitalu
cząsteczkowego, w którym niewielki udział orbitalu akceptora
jest domieszany do funkcji falowej orbitalu donora.
Oddziaływania tego typu są zazwyczaj tak słabe, że nie daje się
wyizolować czystego związku kompleksowego. Jako przykład
może posłużyć tu cząsteczkowy jod rozpuszczony w benzenie.
Bibliografia
Encyklopedia PWN
http://www.mlyniec.gda.pl/~chemia/ogolna/ogolna_cz_0.htm
(to trzeba jeszcze oblukać [budowa cząsteczki])
http://www.ewamalecka.republika.pl/compl/odmcz.htm
http://www.chemia.dami.pl/liceum/liceum7/wiazania2.htm
Chemia 1. Zakres podstawowy. Podręcznik dla liceum
ogólnokształcącego i technikum.
Dziękujemy za uwagę