strona 1/6
Budowa atomu.
Wiązania chemiczne
Dorota Lewandowska, Anna Warchoł, Lidia Wasyłyszyn
Treść podstawy programowej:
Budowa atomu; jądro i elektrony, składniki jądra, izotopy. Promieniotwórczość i jej różnorodne
konsekwencje. Atomy, jony i cząsteczki, pierwiastki i związki chemiczne, symbole chemiczne, wartościowość pierwiastków. Wiązania chemiczne – jonowe i atomowe.
Zagadnienia do powtórki
1.
2.
3.
4.
5.
6.
7.
Budowa atomu, jądro i jego składniki, elektrony
Izotopy
Promieniotwórczość i jej różnorodne konsekwencje
Atomy, jony i cząsteczki
Pierwiastki i związki chemiczne; symbole chemiczne
Wartościowość pierwiastka
Wiązania chemiczne; jonowe i atomowe
Kompendium wiedzy
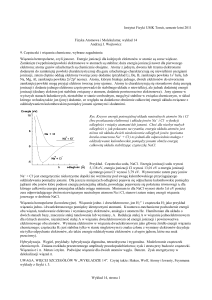
1. Budowa atomu
• Protony i neutrony (nukleony) wchodzą w skład jądra atomowego
• Chmura elektronowa jest to obszar w zasięgu oddziaływania
jądra atomowego, w którym istnieje prawdopodobieństwo
znalezienia elektronów
• Powłoka elektronowa jest to część chmury elektronowej, w której prawdopodobieństwo znalezienia elektronu jest największe
• Protony mają ładunek elektryczny +1 i masę ≈1 u
• Neutrony nie mają ładunku a ich masa ≈ 1 u
• Elektrony mają ładunek elektryczny –1 i masę prawie
2000 razy mniejszą od masy protonu
• Jądro atomowe jest bardzo małe w porównaniu z atomem, znajduje się w jego centrum i w nim skupiona jest prawie cała masa atomu
chmura elektronowa
elektron
neutron
jądro
atomowe
proton
powłoki elektronowe
Data utworzenia: 2008-11-30
strona 2/6
• Liczba protonów w jądrze atomu jest równa liczbie elektronów w chmurze elektronowej i nazywa
się liczbą atomową Z
• Liczba nukleonów to liczba masowa A
Każdy atom można opisać za pomocą liczby atomowej i masowej:
A
Z
E
Na tej podstawie można stwierdzić, ile poszczególnych cząstek buduje dany atom, np.:
Nazwa
Liczba
Liczba
pierwiastka atomowa Z masowa A
Zapis
A
E
Z
Liczba
Liczba
Liczba
Liczba
protonów elektronów neutronów nukleonów
tlen
8
16
16
8
O
8
8
8
16
fosfor
15
31
31
15
P
15
15
16
31
cynk
30
65
65
30
Zn
30
30
35
65
2. Izotopy. Promieniotwórczość.
Izotopy – odmiany pierwiastka, których atomy mają taką samą liczbę protonów a różną liczbę
neutronów.
Wodór posiada trzy rodzaje atomów z różną liczba neutronów:
Symbol
Nazwa
Liczba
atomowa
Liczba
masowa
Liczba
protonów
Liczba
elektronów
Liczba
neutronów
1
1
H
prot
1
1
1
1
0
2
1
H
deuter
1
2
1
1
1
3
1
H
tryt
1
3
1
1
2
Większość pierwiastków występujących w przyrodzie to mieszanina trwałych izotopów, których skład
procentowy jest stały. Przykładem może być pierwiastek tlen – mieszanina trzech izotopów:
O – 99,758%
O – 0,0374%
18
O – 0,2039%
16
17
Izotopy promieniotwórcze (nietrwałe) zbudowane są z atomów, które ulegają samoistnym przemianom, tworząc tym samym atomy innych pierwiastków. Samorzutnym przemianom izotopów promieniotwórczych towarzyszy emisja promieni α, β i γ, zjawisko takie nazywa się promieniotwórczością
naturalną.
Data utworzenia: 2008-11-30
strona 3/6
Przemianę promieniotwórczą nietrwałych jąder atomowych w wyniku celowych reakcji jądrowych
nazywamy promieniotwórczością sztuczną.
Skutki promieniotwórczości mogą być pojmowane w sensie:
NEGATYWNYM
POZYTYWNYM
skażenie środowiska
lecznictwo
archeologia
defektoskopia
źródło energii
poważne uszkodzenia genetyczne w organizmach ludzi,
zwierząt i roślin
niszczenie
komórek
rakowych
określanie wieku
materiałów
organicznych
badanie jakości
wyrobów
elektrownie
jądrowe
3. Atomy, cząsteczki, jony
Atom – najmniejsza część pierwiastka, która reprezentuje jego właściwości i bierze udział w reakcjach chemicznych.
• atomy tego samego pierwiastka mają taką samą liczbę atomową,
• atomy różnych pierwiastków różnią się rozmiarami, masą i właściwościami
• tylko nieliczne atomy występują w przyrodzie samodzielnie (niezwiązane), należą do nich między
innymi atomy gazów szlachetnych (helowców)
• symbol chemiczny oznacza jeden atom:
Fe
jeden atom
żelaza
• współczynnik liczbowy umieszczony przed symbolem atomu informuje nas o liczbie atomów
swobodnych:
4Fe
cztery atomy
żelaza
współczynnik stechiometryczny
Cząsteczka – tworzą ją co najmniej dwa atomy takie same lub różne, połączone ze sobą. Chemiczny zapis cząsteczki to jej wzór chemiczny, zwany wzorem sumarycznym.
Cząsteczka pierwiastka:
• zbudowana jest z takich samych atomów
• liczbę atomów, wchodzących w skład cząsteczki określa indeks liczbowy umieszczony w prawym
dolnym rogu symbolu:
Data utworzenia: 2008-11-30
strona 4/6
X2
symbol
chemiczny
indeks stechiometryczny
• mogą być dwuatomowe, np. H2, N2, O2, Cl2 , Br2 lub wieloatomowe, np. O3, P4, S8:
H2 – jedna dwuatomowa cząsteczka wodoru
S8 – jedna ośmioatomowa cząsteczka siarki
• współczynnik liczbowy umieszczony przed wzorem cząsteczki informuje nas o liczbie cząsteczek:
7H2 – siedem dwuatomowych cząsteczek wodoru
3S8 – trzy ośmioatomowe cząsteczki siarki
• Łączną liczbę atomów określa iloczyn:
współczynnik
stechiometryczny
x
indeks
stechiometryczny
7H2 – siedem dwuatomowych cząsteczek wodoru (łączna liczba atomów wodoru: 7 × 2 = 14)
3S8 – trzy ośmioatomowe cząsteczki siarki (łączna liczba atomów siarki: 3 × 8 = 24)
Cząsteczka związku chemicznego zbudowana jest z atomów różnych pierwiastków
• liczbę poszczególnych atomów wchodzących w skład cząsteczki określa indeks stechiometryczny, np.
H2 • S • O4
2 atomy
wodoru
1 atom
siarki
4 atomy
tlenu
• współczynnik liczbowy (stechiometryczny) umieszczony przed wzorem chemicznym informuje
nas o liczbie cząsteczek, np.:
5CO2 – pięć cząsteczek dwutlenku węgla (tlenku węgla(IV), ditlenku węgla)
• liczbę atomów poszczególnych pierwiastków uzyskujemy mnożąc współczynnik przez indeks stechiometryczny, np.:
3 C3H5(OH)3 – 3 cząsteczki glicerolu zawierają:
3 × 3 = 9 atomów węgla
3 × 5 + 3 × 3=24 atomy wodoru
3 × 3 = 9 atomów tlenu
Data utworzenia: 2008-11-30
strona 5/6
Jon – atom lub grupa atomów obdarzona ładunkiem elektrycznym.
• jon obdarzony dodatnim ładunkiem to kation
• jon obdarzony ujemnym ładunkiem to anion
• ładunek jonu umieszcza się w prawym górnym rogu (tzw. indeks górny), zapisując go cyfrą arabską z odpowiednim znakiem (najpierw cyfra po niej znak) np.
Ca2+ – (dwudodatni) kation wapnia
SO42 – – (dwuujemny) anion siarczanowy(VI)
CH3COO– – (jednoujemny) anion octanowy
4. Wartościowość
Wartościowość – liczba wiązań chemicznych utworzonych przez atom danego pierwiastka
• o wartościowości decydują elektrony walencyjne
• atomy danego pierwiastka mogą mieć różne wartościowości
• wartościowości zapisujemy liczbami rzymskimi
• ze wzoru strukturalnego cząsteczki można odczytać wartościowości tworzących ją atomów, np.
atom wodoru jest
jednowartościowy
atom tlenu jest
dwuwartościowy
H O
C O
H O
atom węgla jest
czterowartościowy
• znając wartościowości atomów tworzących cząsteczkę możemy napisać jej wzór sumaryczny.
Liczba wiązań, jaką wytwarzają atomy pierwiastka oznaczonego literą A musi być równa liczbie
wiązań wytworzonych przez atomy pierwiastka B.
III
II
A 2 B3
stąd III ⋅ 2 = II ⋅ 3
5. Wiązania chemiczne
Atomy tych samych i różnych pierwiastków łączą się ze sobą za pomocą wiązań chemicznych ponieważ dążą do konfiguracji walencyjnej gazów szlachetnych - helowców (2 lub 8 elektronów na powłoce
walencyjnej, 2 tylko dla atomów wodoru, litu, berylu) Taką konfigurację uzyskują poprzez:
• przekazanie elektronów walencyjnych (np. w NaCl, KCl, MgCl2, CaO) i utworzenie jonów (wiązanie
jonowe) pomiędzy metalami i niemetalami
Data utworzenia: 2008-11-30
strona 6/6
Na: K2L8M1 – 1 e → Na+
Cl : K2L8M7 + 1 e → Cl–
17
11
Na
Na+ + Cl-
Cl
• uwspólnienie pary elektronowej (np. w H2, N2, Cl2, O2) najczęściej tworzy się między atomami
tego samego rodzaju (wiązanie atomowe, kowalencyjne)
Cl
Cl
Cl
wzór elektronowy Cl
wzór kreskowy
kreska we wzorze oznacza parę elektronową
• uwspólnienie pary elektronowej z równoczesnym jej przesunięciem w kierunku atomu pierwiastka o większej liczbie elektronów (np. H2O, CO2, HCl), najczęściej tworzy się między atomami
różnych niemetali (wiązanie atomowe spolaryzowane, kowalencyjne spolaryzowane)
H
H
H
O
H
O
Data utworzenia: 2008-11-30