Dziedziczenie jednogenowe. Rodowody
Dr n.biol. Anna Wawrocka
Rodowód jest podstawą ustalenia trybu dziedziczenia. Umożliwia określenie ryzyka
genetycznego powtórzenia się choroby.
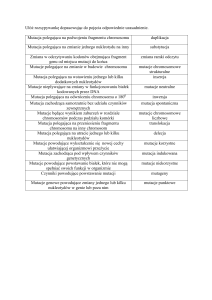
Symbole rodowodu
Linie łączące ze sobą poszczególnych członków rodziny powinny być proste i do
siebie prostopadłe (poza bliźniętami)
Wszystkie symbole oznaczające osoby tworzące jedno pokolenie powinny znajdować
się na jednym poziomie.
Choroby jednogenowe
- Mendlowskie sposoby dziedziczenia.
DZIEDZICZENIE AUTOSOMALNE DOMINUJĄCE
-
Chorują głównie heterozygoty
-
Chorobę przekazują na potomstwo osoby chore, nie ma nosicielstwa
-
Pionowy wzór dziedziczenia
-
Heterozygota ma 50% ryzyka posiadania chorego potomstwa
-
Dwoje chorych rodziców (heterozygot) ma 75% ryzyka posiadania chorego
potomstwa
-
Chora homozygota ma 100% ryzyka posiadania chorego potomstwa (heterozygot)
-
częstość: 20/1000
-
Przykłady chorób: rak sutka, otoskleroza dominująca, hipercholesterolemia rodzinna,
torbielowatość nerek u dorosłych, mnogie wyrośla kostne, choroba Huntingtona,
zespół Marfana, achondroplazja
Wyjątki, powodujące odstępstwa od zasad dziedziczenia autosomalnego dominującego
Świeże mutacje (de novo)
- np. achondroplazja (80-90% to świeże mutacje)
Świeże mutacje c.d.
1. Współczynnik mutacji (m)
-
Wielkość i położenie genu
-
Efekt wieku ojca
-
Czynniki mutagenne w środowisku
2. Biologiczna sprawność chorego
Świeże mutacje c.d.
1. Współczynnik mutacji (m)
-
Wielkość i położenie genu
-
Efekt wieku ojca
-
Czynniki mutagenne w środowisku
2. Biologiczna sprawność chorego
Mozaicyzm gonadalny
Różnorodność ekspresji (zwłaszcza przy efekcie plejotropowym genu)
Opóźniona manifestacja
Niepełna penetracja (brak penetracji odnosi się do osoby zdrowej posiadającej
mutację)
Niepełna penetracja
Przykłady:
1. Penetracja choroby 90%
1/2 x 1/10 x 1/2 x 9/10 = 9/400= 2,25%
Ryzyko urodzenia chorego dziecka wynosi 2,25%
DZIEDZICZENIE AUTOSOMALNE RECESYWNE
-
Chorują tylko homozygoty (lub hetreozygoty złożone)
-
Choroba dziedziczona jest zazwyczaj od zdrowych rodziców nosicieli
-
Czynnik ryzyka – małżeństwa krewniacze
-
Poziomy wzór dziedziczenia
-
Dla dwojga zdrowych rodziców nosicieli, ryzyko posiadania chorego potomstwa
wynosi 25%
-
Osoba chora posiadająca potomstwo z nosicielem, ryzyko 50%
-
Dwoje chorych rodziców na ta samą chorobę autosomalną recesywną 100% ryzyka
-
Częstość: 2/1000
-
Przykłady chorób: mukowiscydoza, fenyloketonuria, galaktozemia, głuchota
wrodzona, rdzeniowy zanik mięśni…
-
Częstość nosicielstwa: 2x pierwiastek kwadratowy z częstości choroby
Przykłady: częstość choroby 1 na 2500 urodzeń
2x√1/2500=2x1/50= 4%
częstość choroby 1 na 10000 urodzeń
2x√1/10000=2x1/100= 2%
Dziedziczenie autosomalne recesywne
Współczynnik pokrewieństwa (r)
r=(½)n
n- liczba linii łączących osobnika X i Y przez wspólnego osobnika danej ścieżki
Przykład: kuzynostwo r= (½)³=1/8 genów jest wspólna u kuzynostwa
DZIEDZICZENIE RECESYWNE SPRZĘŻONE Z CHROMOSOMEM X
-
Chorują niemal wyłącznie hemizygotyczni mężczyźni
-
Choroba zazwyczaj jest dziedziczona przez chorych synów od swoich matek
nosicielek
-
Choroba dziedziczy się „zgodnie z ruchem konika szachowego”
-
Kobieta nosicielka ma 50% ryzyka posiadania chorych synów lub zdrowych córek
nosicielek
-
Chory mężczyzna ma wszystkie dzieci zdrowe, lecz wszystkie jego córki są
nosicielkami
Choroby recesywne sprzężone z chromosomem X
Daltonizm
Dystrofia mięśniowa Duchenne`a
Dystrofia mięśniowa Beckera
Hemofilia A i B
Rybia łuska
Niepełnosprawność intelektualna związana z chromosomem X
DZIEDZICZENIE DOMINUJĄCE SPRZĘŻONE Z CHROMOSOMEM X
-
Chorują hemizygotyczni mężczyźni i heterozygotyczne kobiety
-
Chorych kobiet jest dwukrotnie więcej niż chorych mężczyzn
-
Tylko u kobiet obserwuje się różnorodność ekspresji
-
Chory mężczyzna posiada wszystkich synów zdrowych i wszystkie córki chore
-
Chora kobieta ma 50% ryzyka posiadania chorego potomstwa niezależnie od płci
Choroby dominujące sprzężone z chromosomem X:
Wrodzone nietrzymanie barwnika (incontinentia pigmenti)
Zespół łamliwego chromosomu X
Krzywicaoporna na witaminę D
Zespół Retta
NIEMENDLOWSKIE SPOSOBY DZIEDZICZENIA
Dziedziczenie mitochondrialne
Choroby mitochondrialne są przekazywane wyłącznie w linii żeńskiej – przez chorą
matkę
Chorują obie płci –kobiety i mężczyźni
Jeśli matka jest chora, wszystkim dzieciom przekaże nieprawidłowe geny (100%
ryzyka)
Jeśli tylko ojciec jest chory wszystkie jego dzieci będą zdrowe
Objawy i stopień ciężkości choroby mogą się różnić między rodzeństwem
(heteroplazmia – homoplazmia)
Niektóre choroby miotchondrialne wynikają z mutacji w genach jądrowych, które
kodują białka strukturalne mitochondriów
Mutacje w mt DNA
W komórce występują setki kopii mtDNA (poliplazmia), które w prawidłowych
komórkach są identyczne (homoplazmia)
Większość mutacji dotyczy tylko części populacji mtDNA, co powoduje
koegzystencję dzikiego i zmutowanego typu mtDNA (heteroplazmia)
Choroby mitochondrialne najbardziej dotykają te tkanki i narządy, które mają duże
zapotrzebowanie na energię (układ nerwowy i mięśniowy), stąd wśród objawów często
występują miopatie, neuropatie, encefalopatie
Choroba Lebera
MERF
MELAS
Zespół Kaerns-Sayre
LHON- zanik nerwów wzrokowych Lebera
(Leber’s Hereditary Optic Neuropathy
Zanik nerwów wzrokowych w wyniku zwyrodnienia komórek zwojowych siatkówki i ich
aksonów
Obniżenie ostrości wzroku 15-17 lat
Ubytek w polu widzenia
Zaburzenia w układzie bodźcoprzewodzącym serca
Ataksja
Neuropatia obwodowa
Encefalopatia
Znaczna przewaga chorych mężczyzn, u 50% mężczyzn z mutacją mtDNA i tylko u
20% kobiet z mutacją, występują objawy chorobowe
Podatność na rozwój zaniku nerwów wzrokowych uwarunkowana interakcją
mitochondrialno-jądrową
U 50-74% rodzin z LHON stwierdzono mutacje punktową mtDNA dotyczącą
nukleotydu 11778, zmiana G-A w efekcie zmiana argininy na histydynę w
podjednostce ND4 dehydrogenazy NADH.
Rodzicielskie piętnowanie genomowe i jednorodzicielska disomia
-
Niektóre geny lub części chromosomów zawierające wiele genów, mogą być aktywne
tylko gdy są dziedziczone po jednym rodzicu
-
Przykłady: zespół Pradera Willi’ego (PWS), zespół Angelmana (AS)
Zespół Pradera - Williego (PWS)
zespół PWS wystepuje u obojga płci z częstością 1:15 000 do 1:25 000
u 50% przypadków stwierdza się mikrodelecję w chromosomie 15q11-13
chromosom z delecją jest zawsze pochodzenia ojcowskiego
Obraz kliniczny:
cechy dysmorfii twarzy
obniżenie napięcia mięśniowego
otyłość
niski wzrost
małe dłonie i / lub stopy
upośledzenie rozwoju psychoruchowego
zaburzenia zachowania
Zespół Angelmana
częstość występowania wynosi 1:20 000
u 50% pacjentów wykazuje widoczną w badaniu cytogenetycznym mikrodelecję
15q12
chromosom z delecją jest zawsze pochodzenia matczynego
Objawy kliniczne:
opóźnienie rozwoju
słaby rozwój mowy
napady śmiechu
dysmorfia twarzy
MUTACJE DYNAMICZNE
Wzrost liczby trójnukleotydowych sekwencji powtarzalnych w genie lub obszarze nie
ulegającym translacji (koniec 3` lub 5` genu)
Mutacje dynamiczne stwierdzono tylko u człowieka
Mutacje dynamiczne wykazują dużą zmienność populacyjną
Przykłady: Choroba Huntingtona, dystrofia miotoniczna, zespół łamliwego
chromosomu x…
Zespół łamliwego chromosomu X (FraX)
Mutacje dynamiczna w genie FMR1 w długim ramieniu chromosomu X
Wzrost ilości powtórzeń sekwencji CGG powyżej 200
Osoby zdrowe - do 54 powtórzeń, nosiciele bezobjawowi - do 200 powtórzeń (tzw.
premutacja)
Algorytm postępowania diagnostycznego – analiza rodowodu
Czy mamy do czynienia z dziedziczeniem matczynym czy dziedziczeniem
mendlowskim? (po wykluczeniu dziedziczenia matczynego stawiamy kolejne pytania)
Osoby jakiej płci chorują?
Po kim chorzy dziedziczą chorobę?
Jakie potomstwo mają chorzy mężczyźni?