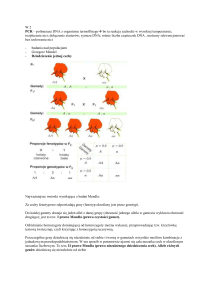
Zasady obliczania ryzyka genetycznego. Podstawy genetyki populacyjnej.
Maciej Krawczyński
Katedra i Zakład Genetyki Medycznej UM w Poznaniu
I.
Choroby jednogenowe
1. Mendlowskie sposoby dziedziczenia:
1.1. Definicje:
• Homozygota – osoba mająca dwa identyczne allele danego genu (chora - jeśli są
zmutowane, zdrowa - jeśli są prawidłowe, niezależnie od typu dziedziczenia choroby);
• Heterozygota – osoba mająca dwa różne allele danego genu: (a) zwykle tzw. heterozygota
prosta – mająca jeden allel prawidłowy i jeden zmutowany – choruje na choroby
dominujące i jest zdrowym nosicielem chorób recesywnych; (b) rzadziej tzw.
heterozygota złożona – mająca dwa zmutowane allele, ale z różnymi mutacjami – choruje
jak homozygota zmutowanego genu;
• Hemizygota – osoba mająca tylko jeden allel danego genu przy nieobecności drugiego
(zwykle mężczyźni w odniesieniu do większości genów sprzężonych z chromosomami
płciowymi, ale również np. kobiety z zespołem Turnera) – choruje wtedy, gdy jedyny allel
genu jest zmutowany.
• Dominacja – polega na ujawnianiu się cechy już u heterozygoty (wystarczy posiadać
jeden zmutowany allel, aby zachorować na chorobę dominującą);
• Recesywność – polega na ujawnianiu się cechy tylko u homozygot (ew. heterozygot
złożonych) lub hemizygot (aby zachorować na chorobę recesywną nie można posiadać
allela prawidłowego).
1.2. Dziedziczenie autosomalne dominujące:
• Chorują głównie heterozygoty, rzadziej homozygoty;
• Nie ma żadnych różnic zależnych od płci;
• Chorobę przekazują na potomstwo osoby chore (brak nosicielstwa);
• Pionowy wzór dziedziczenia (wysokie ryzyko dla potomstwa osób chorych);
• Osoba chora (heterozygota) ma 50% ryzyka posiadania chorego potomstwa (niezależnie
od płci);
• Dwoje chorych rodziców (heterozygot) ma 75% ryzyka posiadania chorego potomstwa
(25% potencjalnych homozygot);
• Chora homozygota ma 100% ryzyka posiadania chorego potomstwa (heterozygot);
• W przypadku zdrowych rodziców (świeża mutacja) ryzyko dla rodzeństwa nie jest
podwyższone;
• Częstość: 20/1000. Przykłady chorób: rak sutka, otoskleroza dominująca,
hipercholesterolemia rodzinna, torbielowatość nerek u dorosłych, mnogie wyrośla kostne,
choroba Huntingtona, nerwiakowłókniakowatość, dystrofia miotoniczna, zespół Marfana,
achondroplazja.
1.3. Dziedziczenie autosomalne recesywne:
•
•
•
•
•
•
•
•
•
•
•
Chorują tylko homozygoty (lub heterozygoty złożone) posiadające oba allele genu
zmutowane;
Nie ma żadnych różnic zależnych od płci;
Choroba dziedziczona zazwyczaj od zdrowych rodziców nosicieli;
Szczególnym czynnikiem ryzyka jest spokrewnienie rodziców;
Poziomy wzór dziedziczenia (wysokie ryzyko dla rodzeństwa osób chorych);
Dla dwojga zdrowych rodziców nosicieli (heterozygot) ryzyko posiadania chorego
potomstwa wynosi 25% w każdej ciąży;
Ryzyko posiadania chorego potomstwa przez osobę chorą jest na ogół mniejsze niż 1% i
zależy od częstości nosicielstwa choroby w populacji ogólnej;
Częstość nosicielstwa: 2 x pierwiastek kwadratowy z częstości choroby;
Osoba chora z nosicielem – 50% ryzyka posiadania chorego potomstwa;
Dwoje chorych rodziców na tę samą chorobę autosomalna recesywną – 100% ryzyka
(chyba, że choroba jest heterogenna genetycznie).
Częstość: 2/1000. Przykłady: mukowiscydoza, fenyloketonuria, galaktozemia, głuchota
wrodzona, rdzeniowy zanik mięśni, choroba Wilsona, wrodzony przerost nadnerczy,
niedokrwistość sierpowatokrwinkowa.
1.4. Dziedziczenie recesywne sprzężone z chromosomem X:
• Chorują niemal wyłącznie hemizygotyczni mężczyźni (bardzo rzadko homozygotyczne
kobiety);
• Choroba dziedziczona zazwyczaj przez chorych synów od zdrowych matek –
heterozygotycznych nosicielek;
• Niemożliwe jest dziedziczenie choroby z ojca na syna (syn otrzymuje od ojca zawsze
chromosom Y);
• Choroba dziedziczy się „zgodnie z ruchem konika szachowego”;
• Kobieta – nosicielka (heterozygota) ma 50% ryzyka posiadania chorych synów lub
zdrowych córek nosicielek. Pozostała połowa potomstwa jest wolna od mutacji.
• Chory mężczyzna (hemizygota) ma wszystkie dzieci zdrowe, lecz wszystkie jego córki są
zdrowymi nosicielkami choroby.
• Małżeństwa chorego mężczyzny z kobietą nosicielką (występujące zwykle tylko w
przypadku chorób częstych i lekkich dla chorych mężczyzn – np. daltonizm) – mają 50%
ryzyka posiadania chorych synów i 50% ryzyka posiadania chorych córek (homozygot).
Pozostali synowie są wolni od mutacji, pozostałe córki są zdrowymi nosicielkami
choroby.
• Przykłady: daltonizm (protanopia i deuteranopia), hemofilia A i B, dystrofie mięśniowe
Duchenne’a i Beckera, niespecyficzne upośledzenie umysłowe, agammaglobulinemia.
1.5. Dziedziczenie dominujące sprzężone z chromosomem X:
• Chorują hemizygotyczni mężczyźni i heterozygotyczne kobiety;
• Chorych kobiet jest dwukrotnie więcej, niż chorych mężczyzn;
• Tylko u kobiet obserwuje się różnorodność ekspresji (choroba często przebiega łagodniej
niż u mężczyzn), z związku z losową inaktywacją jednego chromosomu X;
• Niemożliwe jest dziedziczenie choroby z ojca na syna (syn otrzymuje od ojca zawsze
chromosom Y);
• Chory mężczyzna (hemizygota) posiada wszystkich synów zdrowych i wszystkie córki
chore (najważniejsza cecha różnicująca w analizie rodowodu!);
• Chora kobieta (heterozygota) ma 50% ryzyka posiadania chorego potomstwa, niezależnie
od płci.
•
Przykłady: krzywica hipofosfatemiczna, incontinentia pigmenti, z. Retta, z. Alporta
1.6. Wyjątki, powodujące odstępstwa od zasad dziedziczenia mendlowskiego:
• Świeże mutacje germinalne (de novo);
• Niepełna penetracja (przypadki braku penetracji – osoby zdrowe posiadające mutację);
• Różnorodność ekspresji (zwł. przy efekcie plejotropowym genu);
• Opóźniona manifestacja;
• Cechy ograniczone do jednej płci (np. rak jądra czy macica dwurożna);
• Heterogenność genetyczna;
• Rodzicielskie piętnowanie genomowe;
• Fenokopie.
2. Niemendlowskie sposoby dziedziczenia:
2.1 Dziedziczenie mitochondrialne (matczyne):
• Gen występuje w mitochondrialnym DNA (mtDNA), obecnym w mitochondriach, które
znajdują się w cytoplazmie;
• Choroba występuje u obu płci, ale przekazywana jest na potomstwo wyłącznie przez
chore kobiety. Chorzy mężczyźni mają zawsze zdrowe potomstwo;
• Ryzyko genetyczne posiadania chorego potomstwa przez chorą kobietę wynosi 100%;
• Zjawiska powodujące zmniejszenie ryzyka empirycznego dla potomstwa chorych kobiet:
heterogenność mutacji, zależność od wieku, heteroplazmia mtDNA, współudział genów
jądrowych, narażenie na trucizny metabolizmu tlenowego (cyjanki, palenie tytoniu itp.).
2.2 Rodzicie piętnowanie genomowe i jednorodzicielska disomia:
• Niektóre geny lub części chromosomów zawierające wiele genów, mogą być aktywne tylko
gdy są odziedziczone po jednym z rodziców;
• Piętnowanie genomowe odnosi się do allelowo specyficznego znakowania, które może
zmieniać ekspresję jednego lub większej liczby genów, w zależności od ich pochodzenia
rodzicielskiego.
• Jest to proces dziedziczny, prowadzący do tego, że zawsze matczyna lub ojcowska kopia
danego genu jest aktywna, zaś druga kopia jest inaktywowana. Mechanizm tej inaktywacji
polega na metylacji DNA.
• Przykłady: zespół Pradera-Willi’ego (PWS) jest chorobą spowodowaną przez
mikrodelecję regionu 15q11-q13 na ojcowskiej kopii chromosomu 15. Tym niemniej, u
osób zdrowych, region ten ulega piętnowaniu (imprintingowi) tak, że region PWS jest
aktywny tylko na chromosomie pochodzenia ojcowskiego. Matczyny region PWS 15q11q13 jest wyłączony. Tak więc, delecja regionu 15q11-q13 chromosomu pochodzenia
ojcowskiego pozostawia dziecko bez aktywnego regionu PWS, powodując w ten sposób
chorobę. W tym samym regionie znajduje się locus zespołu Angelmana – złożonej
choroby, zupełnie niepodobnej do PWS, która dotyka mózg i układ nerwowy. To locus
pozostaje aktywne tylko na matczynej kopii chromosomu 15 (kopia ojcowska jest
wyłączona). Jeśli więc delecja obejmuje ten sam region 15q11-q13, co u dzieci z PWS, ale
na chromosomie 15 pochodzenia matczynego, wówczas dziecko manifestuje dla odmiany
fenotyp zespołu Angelmana.
• Identyczny efekt powstaje, gdy oba chromosomy danej pary obecne u dziecka zostały
odziedziczone po jednym rodzicu. Jest to zjawisko tzw. jednorodzicielskiej disomii.
Mechanizm prowadzący do jej powstawania nie jest jasny, ale sugerowane są różnorodne
mechanizmy, takie jak: duplikacja chromosomu w pierwotnie monosomicznej zygocie,
utrata chromosomu w pierwotnie trisomicznej zygocie lub tzw. komplementacja gamet
(prawidłowe zapłodnienie z utratą, a następnie odtworzeniem jednego chromosomu).
Jednorodzicielska disomia, poza prowadzeniem do efektu piętnowania rodzicielskiego
(brak genów pochodzących od jednego z rodziców), może również odpowiadać za takie
odstępstwa od dziedziczenia mendlowskiego, jak możliwość wystąpienia choroby
autosomalnej recesywnej u dziecka rodziców, z których tylko jedno jest nosicielem
choroby lub możliwość dziedziczenia choroby X-recesywnej z ojca na syna.
2.3 Mutacje dynamiczne:
• W genetyce mendlowskiej przekazywanie genów z rodzica na potomstwo jest postrzegane
jako proces stabilny, zaś same geny jako stosunkowo niezmienne (pomijając rzadkie
zjawiska zmienności mutacyjnej lub rekombinacyjnej).
• Od pewnego czasu znane są specyficzne typy mutacji – tzw. mutacje dynamiczne
(niestabilne), które polegają na nadmiernym wydłużeniu genu w wyniku ekspansji
trójnukleotydowych sekwencji powtarzalnych.
• Nadmiernie wydłużony gen powoduje chorobę, a do tego wykazuje tendencję do dalszego
wydłużania (lub znacznie rzadziej skracania) wraz z przekazywaniem go potomstwu
(niekiedy tylko przez rodzica o określonej płci).
• Zjawisko to odpowiedzialne jest m.in. za takie choroby jak pląsawica Huntingtona,
dystrofia miotoniczna czy zespół łamliwego chromosomu X i powoduje niekiedy
dziedziczenie choroby po zdrowym rodzicu, różnorodny (często opóźniony) wiek
manifestacji choroby i nieprzewidywalną zmienność (zwykle nasilenie) ciężkości choroby
u potomstwa (tzw. antycypacja).
II.
Aberracje chromosomowe
1. Poliploidie:
• Powstają przypadkowo: triploidia - w wyniku podwójnego zapłodnienia (dwa plemniki)
lub błędu oogenezy (diploidalny oocyt), tetraploidia – w wyniku błędu pierwszego
podziału zygoty.
• Nie powodują podwyższenia ryzyka genetycznego w kolejnych ciążach;
• Nie są zależne od wieku matki.
2. Aneuploidie (trisomie i monosomie):
• Powstają zwykle w wyniku nondysjunkcji w trakcie mejozy (gametogenezy), znacznie
rzadziej na skutek tzw. opóźnienia anafazowego.
• Dla młodych matek: ryzyko powtórzenia u kolejnych dzieci wynosi 1%.
• Dla matek powyżej 35r.ż. – tzw. efekt wieku matki – ryzyko wzrasta wraz z wiekiem;
• Przykład: ryzyko wystąpienia zespołu Downa lub dowolnej aberracji chromosomowej u
dziecka wynosi odpowiednio, w wieku 35 lat – ok. 0,3% i 0,5%, 40 lat – ok. 1,0% i 1,5%,
45 lat – ok. 3,3% i 4,8%, 47 lat – ok. 5% i 7,7% oraz 49 lat – ok. 10% i 12,5%.
3. Aberracje strukturalne:
• Delecje (mikrodelecje), duplikacje – jeśli pozwalają na posiadanie potomstwa, dziedziczą
się zgodnie z prawami Mendla (50% ryzyka powtórzenia się choroby u potomstwa);
• Translokacje robertsonowskie – zrównoważone są bezobjawowe. Zwykle powodują:
ograniczenie płodności (zwł. mężczyzn), wysokie ryzyko poronień (zwykle ok. 30-40%) a
gdy dotyczą chromosomów 13 lub 21 – ryzyko urodzenia się dziecka z translokacyjną
postacią zespołu Patau lub Downa. Dla ich nosicieli ryzyko genetyczne zależy od
chromosomów uczestniczących w translokacji oraz od płci nosiciela (ryzyko większe dla
kobiet).
• Translokacje chromosomowe wzajemne – zrównoważone są bezobjawowe. Zwykle
powodują: ograniczenie płodności (zwł. mężczyzn), wysokie ryzyko poronień (zwykle ok.
30-40%), a niekiedy ryzyko urodzenia się dziecka z zespołem wad wrodzonych i
niezrównoważoną translokacja (zwł. gdy punkty pęknięć chromosomów są dystalne). Dla
ich nosicieli, ryzyko genetyczne zależy od: płci, chromosomów uczestniczących w
translokacji oraz lokalizacji punktów pęknięć chromosomów.
• Inwersje – są bezobjawowe. Powodują zwykle wysokie ryzyko poronień (ok. 30%), lecz
na ogół nie grożą urodzeniem się żywo chorego dziecka.
III.
Choroby wieloczynnikowe
Obejmują izolowane wady wrodzone oraz wiele popularnych chorób wieku dorosłego (np.
nadciśnienie, choroba wieńcowa, alergia, cukrzyca, schizofrenia i wiele innych);
• Ryzyko genetyczne jest istotne przede wszystkim dla krewnych Io, gwałtownie maleje dla
krewnych IIo, i niemal zrównuje się z populacyjnym dla krewnych IIIo;
• W przypadkach sporadycznych, ryzyko dla krewnych Io jest niskie i wynosi około 5%;
• Znane są czynniki ryzyka, które znacząco podnoszą ryzyko genetyczne w danej rodzinie.
Są to: (1) wiele osób chorych w rodzinie, (2) szczególnie ciężka postać choroby; (3) różne
choroby wieloczynnikowe w jednej rodzinie; (4) pokrewieństwo rodziców; (5)
występowanie choroby u osoby o płci rzadziej na nia chorującej; (6) występowanie
szczególnie rzadkiej, niezwykłej choroby wieloczynnikowej.
•
IV.
Podstawy genetyki populacyjnej
Prawo Hardy’ego-Weinberga: częstość poszczególnych alleli genu (zmutowanych i
prawidłowych), a tym samym również częstość chorób jednogenowych, nie zmienia się w
populacji z pokolenia na pokolenie, jeżeli populacja znajduje się w równowadze
genetycznej.
• Większość dużych populacji spełnia prawo Hardy’ego-Weinberga i wykazuje stabilność
genetyczną, dzięki czemu raz obliczone częstości chorób jednogenowych czy częstości ich
nosicielstwa są niezmienne.
• Znane są czynniki, które w znaczący sposób zmieniają częstość alleli i częstość chorób
jednogenowych w wybranych populacjach: (1) małe, zamknięte populacje – tzw. izolaty
genetyczne; (2) celowy dobór małżeństw pod kątem cech genetycznych – np. częste
małżeństwa krewniacze; (3) nasilona selekcja negatywna lub pozytywna (osób chorych
lub nosicieli); (4) migracja i mieszanie populacji migrującej z tubylcami – zmienia
częstość alleli w obu populacjach; (5) zwiększona częstość świeżych mutacji np. po
wybuchach jądrowych.
•