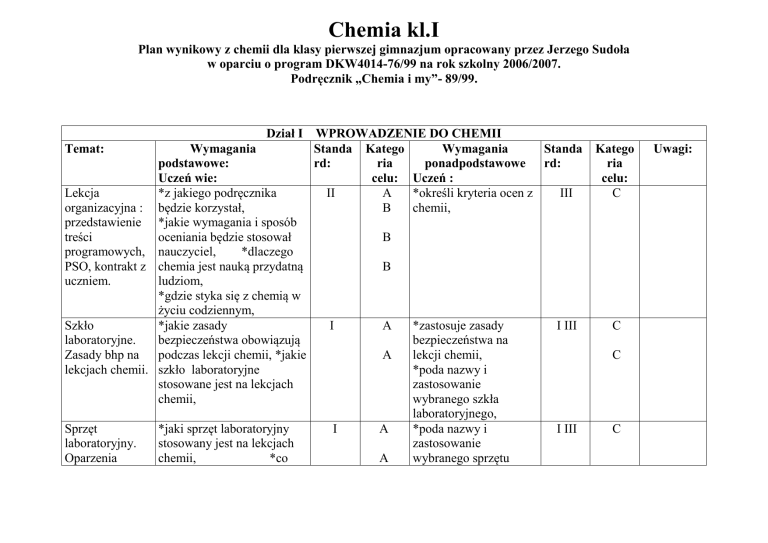
Chemia kl.I
Plan wynikowy z chemii dla klasy pierwszej gimnazjum opracowany przez Jerzego Sudoła
w oparciu o program DKW4014-76/99 na rok szkolny 2006/2007.
Podręcznik „Chemia i my”- 89/99.
Dział I WPROWADZENIE DO CHEMII
Temat:
Wymagania
Standa Katego
Wymagania
Standa
podstawowe:
rd:
ria
ponadpodstawowe rd:
Uczeń wie:
celu: Uczeń :
Lekcja
*z jakiego podręcznika
II
A
*określi kryteria ocen z
III
organizacyjna : będzie korzystał,
B
chemii,
przedstawienie *jakie wymagania i sposób
treści
oceniania będzie stosował
B
programowych, nauczyciel,
*dlaczego
PSO, kontrakt z chemia jest nauką przydatną
B
uczniem.
ludziom,
*gdzie styka się z chemią w
życiu codziennym,
Szkło
*jakie zasady
I
A
*zastosuje zasady
I III
laboratoryjne.
bezpieczeństwa obowiązują
bezpieczeństwa na
Zasady bhp na podczas lekcji chemii, *jakie
A
lekcji chemii,
lekcjach chemii. szkło laboratoryjne
*poda nazwy i
stosowane jest na lekcjach
zastosowanie
chemii,
wybranego szkła
laboratoryjnego,
Sprzęt
*jaki sprzęt laboratoryjny
I
A
*poda nazwy i
I III
laboratoryjny.
stosowany jest na lekcjach
zastosowanie
Oparzenia
chemii,
*co
A
wybranego sprzętu
Katego
ria
celu:
C
C
C
C
Uwagi:
chemiczne
termiczne.
i
powoduje oparzenie
chemiczne
i co
termiczne,
*różnicę między ciałem
fizycznym
a substancją,
*podział substancji: na
proste (pierwiastki) i złożone
(związki chemiczne)
*jak zbudowana jest materia,
*najważniejsze założenia
teorii atomistycznocząsteczkowej budowy
materii,
Nieciągła
*podział substancji na trzy
budowa
stany skupienia: stały,
substancji (trzy ciekły, gazowy, *wymienia
stany skupienia). substancje w każdym stanie
skupienia,
I II
Właściwości
*co to są właściwości
charakteryzujące fizyczne substancji,
substancje.
I
Mieszaniny jako *co to jest mieszanina
układy
substancji,
*co to jest
substancji.
mieszanina jednorodna,
*co to jest mieszanina
I
Materia i jej
podział.
B
A
A
B
I
A
A
A
A
A
A
laboratoryjnego,
*zastosuje pierwszą
pomoc przy oparzeniu
chemicznym
i termicznym,
*wskazuje substancje
w najbliższym
otoczeniu,
*
podaje przykłady
zastosowań substancji z
wykorzystaniem ich
właściwości,
*rozróżnia stany
skupienia ze względu
na budowę ciał,
*rozróżnia stany
skupienia ze względu
na właściwości stanu,
*określi właściwości
fizyczne danej
substancji,
*odczyta z tablic
właściwości fizyczne
substancji,
*wykona proste
czynności
laboratoryjne,
sporządzając
C
I III
B
C
III
C
B
III
C
B
III
B
C
niejednorodna,
Rozdzielanie
mieszanin
niejednorodnych
.
*sposoby rozdzielania
mieszaniny niejednorodnych
na składniki i na czym
polegają,
II
Rozdzielanie
mieszanin
jednorodnych.
*sposoby rozdzielania
mieszaniny jednorodnej na
składniki,
II
Zjawiska
fizyczne
przemiany
chemiczne.
Teoria
*co to jest przemiana
i chemiczna,
*co to jest
zjawisko fizyczne,
*wymienia przykłady
przemian chemicznych i
zjawisk fizycznych,
*historię kształtowania się
I
I II
B
B
A
A
B
B
mieszaninę substancji,
*sformułuje obserwacje
na podstawie
wykonanego
doświadczenia
*potrafi rozdzielić
mieszaninę
niejednorodną na
składniki, *wyciągnie
wnioski
z
przeprowadzonego
doświadczenia,
*dokona podziału
substancji ze względu
na jej właściwości
i skład,
*poda przykłady
poszcze- gólnych
rodzajów substancji,
*przeprowadzi, proste
doświadczenie
obrazujące przemianę
chemiczną,
*poda
różnicę między
przemianą chemiczną a
zjawiskiem fizycznym ,
*w podanych
przykładach zanalizuje
przemianę chemiczną i
zjawisko fizyczne,
*wykona
III IV
C
D
III IV
D
C
III
C
C
C
III
C
atomistyczna.
Atomy ich masy
i inne
właściwości.
Cząsteczki
elementarne
wchodzące w
skład atomu.
Izotopy.
poglądów pojęcie „atomu”,
*jaki jest rząd wielkości
rozmiarów atomów,
*jaki jest rząd wielkości
masy atomów,
*że atom jest najmniejszą
cząstkom pierwiastka
zachowującą jego
właściwości,
*że istnieją różnice we
właściwościach atomów
pierwiastków,
*budowę atomu pierwiastka,
*co to są i jakie mają cechy
cząsteczki
elementarne(protony,
neutrony, elektrony),
*co to są elektrony
walencyjne,
*jaki jest
związek pomiędzy liczbą
protonów i elektronów w
atomie danego pierwiastka,
*co to jest liczba atomowa,
*maksymalną liczbę
elektronów
w
powłokach elektronowych,
*co to są izotopy
pierwiastka,
*izotopy
wodoru i czym się różnią
między sobą
*zastosowanie izotopów w
A
B
B
doświadczenie
potwierdzające
ziarnistość materii,
*odczyta masy
atomowe pierwiastków,
B
B
I
A
A
A
B
B
A
A
B
B
*określi liczbę
protonów
i
elektronów w atomie
pierwiastka, gdy znane
są liczby: atomowa i
masowa,
*
narysuje planetarny (
pełny
i
uproszczony) model
atomu pierwiastka, gdy
znane są liczby:
atomowa i masowa,
*wyjaśni, dlaczego
bardzo często masa
atomowa pierwiastka
nie jest liczbą
całkowitą,
III
C
C
C
Jony.
Cząsteczki.
Wiązania
chemiczne
kowalencyjne
(atomowe).
Wiązania
chemiczne
jonowe.
różnych dziedzinach życia,
*co to są jony, kationy,
aniony, *czym się różni
kation od anionu,
*w
jaki sposób powstają jony,
*różnicę między atomem,
a cząsteczką,
*rolę elektronów
walencyjnych
w
tworzeniu cząsteczek,
*że oktet elektronowy jest
trwałym stanem atomu,
*jak tworzą się cząsteczki
pierwiastków,
*na czym polega tworzenie
się wspólnych par
elektronowych,
*co to jest wiązanie
kowalencyjne
spolaryzowane i
niespolaryzowane,
*co to są jony i że
wytwarzają pole
elektrostatyczne,
*na czym polega tworzenie
się wiązania jonowego,
*kiedy pomiędzy atomami
wytwarza się wiązanie
jonowe, a kiedy wiązanie
kowalencyjne
spolaryzowane,
I
A
A
A
*wyjaśni, kiedy
powstaje kation a
kiedy anion,
I II
A
*zapisze określone
liczby cząsteczek
pierwiastków
gazowych,
*napisze wzory
elektronowe
i
kreskowe cząsteczek
pierwiastków
gazowych(O2, N2, Cl2,
H2,)
*buduje modele
powyższych cząsteczek,
III
*zapisze powstawanie
jonów, *zbuduje model
cząsteczki
o
wiązaniu jonowym,
III
A
A
B
B
B
I II
A
B
B
A
III
C
C
C
C
C
C
Pierwiastki
chemiczne i
ich symbole.
Metale i
niemetale.
Związki
chemiczne
ich wzory.
*rodzaje wiązań
chemicznych,
* co to jest pierwiastek
chemiczny, *dlaczego
istniała potrzeba
wprowadzenia symboliki
chemicznej, *które
symbole powinien opanować
pamięciowo,
*co to są metale i ich
właściwości fizyczne,
*co to są niemetale i ich
właściwości fizyczne,
*co to jest związek
i chemiczny,
*że różni się mieszanina
dwu pierwiastków od
utworzonego przez nie
związku chemicznego,
I
A
A
*odszuka w układzie
okresowym podane
pierwiastki chemiczne,
III
C
*poda przykład
III
pierwiastków (metali i IV
niemetali),
*wyróżni ze zbioru
pierwiastków metale i
niemetale,
*poda przykłady
III
związków
chemicznych,
* wyróżni ze zbioru
substancji mieszaniny i
związki chemiczne, *
wyróżni ze zbioru
substancji pierwiastki
i związki chemiczne,
*wyjaśnia co się dzieje
z atomami i
cząsteczkami
substancji w reakcjach
chemicznych,
*wykazuje różnicę w
budowie pierwiastka i
C
A
I II
A
B
II
B
B
D
C
C
C
C
C
Masa atomowa. *co to jest atomowa
Masa
jednostka masy, *co to jest
cząsteczkowa.
masa atomowa,
*co to jest masa
cząsteczkowa,
Reakcja
chemiczna.
Substrat i
produkt reakcji.
Równanie
reakcji
chemicznej.
Reakcje
chemiczne
I
*co to jest reakcja
chemiczna,
*co to
jest substrat i produkt
reakcji chemicznej
I
*co to jest równanie reakcji
chemicznej,
*co to są współczynniki
stechiometryczne równania
reakcji, *na czym polega
bilansowanie równania
reakcji chemicznej,
*przemiany chemiczne
w zachodzące w otoczeniu,
I II
A
A
A
A
A
A
A
B
II
B
związku chemicznego,
*wyjaśnia
wprowadzenie pojęcia
masy atomowej,
*wyjaśni dlaczego
masy atomów i
cząsteczek wyraża się
w atomowych
jednostkach masy,
*obliczy masy
cząsteczkowe prostych
związków
chemicznych,
*przeliczy atomową
jednostkę masy na
gramy,
*zapisuje słownie
reakcje chemiczne,
*wyjaśnia dlaczego
podczas reakcji
chemicznej powstają
nowe substancje,
*prawidłowo dobiera
współczynniki
stechiometryczne w
równaniach reakcji
chemicznych,
*opisuje reakcje
chemiczne
w
III
C
C
C
C
III
C
C
III
C
III
C
najbliższym
otoczeniu i ich
objawy.
Energia w
reakcjach.
Powtórzenie
wiadomości
o substancjach i
ich
przemianach.
Sprawdzian
wiadomo- ści o
substancjach
i ich
przemianach.
*co to są reakcje
egzotermiczne
i endotermiczne,
*przykłady reakcji
egzoenergetycznych
i endoenergetycznych,
I II
A
B
otoczeniu,
*charakteryzuje
substraty
i
produkty przemian
chemicznych
zachodzących
w
otoczeniu,
*zapisuje słownie
przebieg reakcji
różnego typu,
*wyjaśnia, dlaczego do
przebiegu niektórych
reakcji konieczne jest
stałe dostarczanie
energii,
*wyjaśnia, dlaczego do
zapoczątkowania
niektórych reakcji
należy dostarczyć
energii na sposób
ciepła,
C
III IV
C
D
D
I II
AB
III IV
CD
I II
AB
III IV
CD
Omówienie i
poprawa
sprawdzianu.
Dział II POWIETRZE I TLENKI
Temat:
Wymagania
Standard: Kategoria
Wymagania
Standard: Kategoria Uwagi:
podstawowe:
celu:
ponadpodstawowe
celu:
Uczeń wie/zna:
Uczeń:
Skład powietrza.
*powietrze jest
I II
A
*zbada przybliżony
III
C
Tlen najważniejszy mieszaniną
skład powietrza,
składnik powietrza. jednorodną gazów,
A
*zapisze słownie
C
*główne składniki
B
przebieg reakcji
powietrza,
B
rozkładu tlenku rtęci
C
*jaka jest rola
(II), *określi, które
powietrza w życiu,
A
składniki powietrza
*jakie jest
B
zalicza się do
C
zastosowanie
B
stałych, a które do
powietrza w
zmiennych,
przebiegu niektórych
*obliczy przybliżoną
procesów,
*co to
objętość tlenu i azotu
jest tlen,
w klasie,
*właściwości
*wykaże obecność
fizyczne tlenu,
pary wodnej w
*jak można otrzymać
atmosferze,
tlen i jaka jest jego
rola w przyrodzie,
Azot, wodór, i inne *co to jest azot,
niemetale.
wodór, gazy
szlachetne,
*właściwości
fizyczne i chemiczne
azotu, wodoru i
gazów szlachetnych,
*zastosowanie azotu,
wodoru i gazów
szlachetnych,
Układ okresowy
*co to jest okresowy
pierwiastków.
układ pierwiastków,
*kto jest twórcą układ
okresowego
pierwiastków,
*jakich informacji o
atomie pierwiastka
dostarcza układ
okresowy
pierwiastków,
*prawo okresowości ,
Informacja o
*jakich informacji o
pierwiastkach na
pierwiastkach
podstawie położenia dostarcza układ
w układzie
okresowy
okresowym.
pierwiastków,
*jakich informacji o
budowie atomu
dostarcza numer
I II
A
B
B
I II
A
A
B
*porówna
właściwości azotu,
tlenu, wodoru,
gazów szlachetnych,
*dokona prostych
obliczeń na
podstawie
znajomości składu
procentowego
powietrza,
* wskaże położenie
wskazanego
pierwiastka w
układzie
okresowym,
III
C
II I
C
* poda informacje na
podstawie położenia
pierwiastka w
układzie
okresowym,
*przewidzi
właściwości
dowolnego
III IV
C
A
II
B
B
B
D
grupy, a jakich numer
okresu w układzie
okresowym
pierwiastków,
*o czym informuje
liczba atomowa
pierwiastka,
Reakcje łączenia
* jakie cechy zalicza
tlenu z wybranymi się do właściwości
pierwiastkami.
chemicznych
Tlenki. Wzory
substancji, *co to jest
sumaryczne.
reakcji analizy czyli
rozkładu,
*które substancje są
substratami,
a
które produktami w
reakcji analizy,
*co to są tlenki,
*czym się różni
reakcja spalania od
utleniania,
*co mówi nam wzór
sumaryczny,
*jak należy tworzyć
wzór związku
chemicznego,
pierwiastka na
podstawie jego
położenia
w
układzie
okresowym,
I
B
A
A
A
B
A
B
*wskaże substraty,
produkty,
pierwiastki, związki
chemiczne w
reakcji analizy,
*przeprowadzi
reakcję spalania
pierwiastków,
*zapisze w sposób
ogólny proces
łączenia się
pierwiastków
z tlenem,
*określi właściwości
chemiczne tlenu,
* zapisze wzór
sumaryczny na
podstawie liczby
atomów
pierwiastków
tworzący dany
związek chemiczny,
korzy- stając z
wartościowości tych
III
C
C
C
C
C
C
C
C
Wartościowości
pierwiastków.
Wzory strukturalne
tlenków.
*jakie są rodzaje
wiązań chemicznych,
*co to jest
wartościowość
pierwiastka,
*że pierwiastek może
mieć kilka
wartościowości,
*że pierwiastki w
stanie wolnym mają
wartościowość równą
zero,
I II
A
A
B
B
pierwiastków,
*określi
wartościowość
pierwiastków
w
związkach
chemicznych,
*zapisze wzór
sumaryczny
cząsteczki związku
chemicznego na
podstawie
znajomości wzoru
strukturalnego,
*poda nazwę
związku
chemicznego na
podstawie jego
wzoru
sumarycznego,
*napisze wzory
sumaryczne,
elektronowe i
strukturalne
( kreskowe)
cząsteczek,
*określi możliwe
wartościowości
pierwiastka na
podstawie położenia
tego pierwiastka
w układzie
III IV
C
D
C
C
Reakcje analizy
i wymiany.
*co to jest reakcja
analizy czyli
rozkładu,
*które substancje są
substratami,
a
które produktami
reakcji analizy, *co
to jest reakcja
wymiany
pojedynczej,
*które substancje są
substratami,
a
I
A
B
A
B
okresowym,
*określi liczbę
pierwiastków
wchodzących w
skład związku
chemicznego,
*poda liczbę
atomów wchodzących w skład
cząsteczki określonego związku
chemicznego,
*przedstawi
modelowo
cząsteczki związków
chemi- cznych na
podstawie wzorów:
sumarycznego i
strukturalnego,
*wskaże substraty,
produkty,
pierwiastki, związki
chemiczne w
reakcji analizy,
*wskaże substraty,
produkty,
pierwiastki, związki
chemiczne
w
reakcji wymiany
pojedynczej,
C
III
C
C
Równania reakcji
chemicznych.
Ćwiczenia w
doborze
współczynników
stechiometrycznych.
Prawa: stałości
składu i
zachowania masy.
które produktami
reakcji wymiany
pojedynczej,
*zna typy reakcji na
podstawie zapisu jej
przebiegu,
*treść zachowania
masy,
*treść
prawa stałości
związku
chemicznego,
* kto sformułował
prawo stałości
I
I
B
A
A
A
A
*zapisze za pomocą
symboli
pierwiastków i
wzorów związków
chemicznych oraz
uzgodni równania
reakcji chemicznych,
*odczyta zapisane
równanie reakcji
chemicznej,
*modelowo
przedstawi przebieg
określonej reakcji
chemicznej,
*przewidzi i
prawidłowo zapisze
produkty wybranej
reakcji chemicznej,
*prawidłowo pisze
równania różnych
reakcji chemicznych,
* sprawdzi
doświadczalnie
prawo zachowania
masy,
III IV
C
C
C
D
D
III
C
związku
chemicznego,
*co to jest stosunek
wagowy
pierwiastków w
związku
chemicznym,
Zależności masowe *co można obliczyć,
w związkach i
stosując prawo
reakcjach
zachowania masy,
chemicznych.
*co można obliczyć
stosując prawo
stałości składu
związku chemicznego
Mol- miarą ilości
substancji.
*pojecie mola,
*co to jest masa
molowa pierwiastków
i związków
chemicznych,
Ćwiczenia
obliczeniowe z
wykorzystaniem
znajomości mola.
*objętość molową
gazów
w
warunkach
normalnych,
Dwutlenek węgla
*co to jest dwutlenek
II
B
B
I II
A
B
II
B
I II
A
*obliczy stosunek
wagowy
pierwiastków w
związku
chemicznym,
*dokona prostych
obliczeń związanych
z zastosowaniem
prawa stałości
składu związku
chemicznego,
*przedstawia masy
molowe
pierwiastków,
*oblicza masy
molowe związków
chemicznych,
*wykorzysta pojęcie
mola, objętości
molowej, masy
molowej w prostych
obliczeniach
stechoimetrycznych,
*wyjaśni rolę
III
C
D
III
C
C
III
C
III IV
C
właściwości
i zastosowanie.
Tlenki w
najbliższym
otoczeniu i ich
właściwości.
Korozja metali.
węgla,
*występowanie
dwutlenku węgla,
*proces fotosyntezy,
na czym polega efekt
cieplarniany,
*otrzymywanie
dwutlenku węgla,
*reakcję
charakterystyczną
dla dwutlenku węgla,
*otrzymywanie
dwutlenku węgla,
*co to jest korozja
metali,
*sposoby
zapobiegania korozji
wyrobów żelaznych,
*występowanie
najbardziej
rozpowszechnionych
w przyrodzie
tlenków,
*zastosowania
niektórych poznanych
tlenków,
Obieg tlenu i
*obieg tlenu w
dwutlenku węgla w przyrodzie,
B
B
B
B
B
I II
A
B
B
B
II
B
B
fotosyntezy
w
naszym życiu,
*określi zagrożenia
wynikające z efektu
cieplarnianego,
*przeprowadzi
reakcję
otrzymywania
dwutlenku węgla,
wykryje
doświadczalnie
obecność dwutlenku
węgla, *zapisze
przebieg reakcji
magnezu z
dwutlenkiem węgla,
*wyjaśni, dlaczego
gnicie, pomimo że
jest procesem
szkodliwym,
odgrywa znaczącą
rolę dla rozwoju
roślin,
*uzasadni, które z
procesów
przebiegających z
udziałem tlenu
uważane są za
szkodliwe,
*omówi, przebieg
procesu
w
C
D
C
III IV
C
D
III
C
przyrodzie.
Zanieczyszczenia
powietrza i ich
*obieg dwutlenku
w przyrodzie,
*procesy
przebiegające z
udziałem tlenu
uważane za
szkodliwe,
*procesy w których
tlen i dwutlenek
węgla są na przemian
substratami i
produktami,
*główne
zanieczyszczenia
B
B
II
B
przyrodzie, w
którym bierze udział
tlen, podając
produkty reakcji,
*wyjaśni, dlaczego
ograniczenie dostępu
tlenu lub obniżenie
temperatury
spowalnia reakcje
chemiczne, których
następstwem jest
zepsucie produktów
żywnościowych,
*wyjaśni, dlaczego
zawartość tlenu w
powietrzu jest
praktycznie stała,
mimo że jest on
substratem w tak
wielu procesach,
*wyjaśni, jakie
znaczenie dla
zachowania
równowagi
chemicznej i
biologicznej
w
przyrodzie ma obieg
tlenu
i
dwutlenku węgla,
*wyjaśni jakie mogą
być skutki
C
C
C
III
C
skutki.
powietrza i ich
źródła,
*skutki szkodliwego
działania ołowiu i
tlenku węgla na
otoczenie,
*skutki działania
dwutlenku siarki na
rośliny,
B
B
Ochrona powietrza *co to jest dziura
przed
ozonowa,
zanieczyszczeniami. *co jest powodem
zanieczyszczeń
powietrza,
*skąd się biorą
kwaśne opady,
*zastępcze środki
dróg oddechowych i
skóry,
*co najmniej dwa
sposoby zapobiegania
nadmiernej emisji
dwutlenku węgla do
atmosfery,
I II
Powtórzenie
wiadomości o
powietrzu i
I II
B
B
B
A
B
AB
nadmiernej ilości
dwutlenku węgla,
*omówi możliwości
działania
przeciętnego
człowieka w celu
zmniejszenia
zanieczyszczenia
atmosfery,
*wykaże zależności
między rozwojem
cywilizacji
a występującymi
zagrożeniami,
*zaproponuje
sposoby
zmniejszania
zanieczyszczeń
powietrza,
*wyjaśni, w jaki
sposób można
zapobiec
przedostawaniu się
dwutlenku siarki i
dwutlenku azotu do
atmosfery,
C
III IV
D
D
C
III IV
CD
tlenkach.
Sprawdzian
wiadomości o
powietrzu i
tlenkach.
Omówienie i
poprawa
sprawdzianu.
I II
AB
III IV
CD










