Wiązanie jonowe
LiF
NaCl
Wiązanie jonowe
energia jonizacji
powinowactwo elektronowe
siły odpychania
siły kulombowskie
Kryształy jonowe
Sól kuchenna – chlorek sodu
NaCl
Struktura ciasnego upakowania
Kryształy jonowe są kruche – pękają pod wpływem naprężeń
CsCl
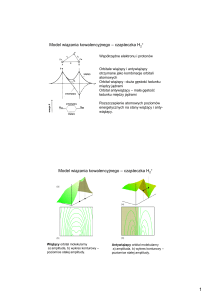
Wiązanie kowalencyjne
Tworzenie się wiązania w
atomie wodoru H2
Hybrydyzacje
W kryształach uzyskuje się obniżenie energii dla przekrywania się
większej ilości orbitali - hybrydyzacje
Kształty orbitali po
hybrydyzacji muszą być
jednakowe !
Hybrydyzacja sp
Cząsteczki o budowie liniowej
Acetylen C2H2
kąt 180°
Hybrydyzacja sp2
Grafit
kąt 120°
Hybrydyzacja sp3
Metan CH4
Diament
kąt 109.5°
Hybrydyzacja sp3d
PCl5
Podwójne i potrójne wiązania kowalencyjne
O2
O=O
CO2
O=C=O
orbitale π
Etan C2H4
orbitale σ
Wiązanie wodorowe
-Atom wodoru wiąże się z dwoma innymi atomami
-Elektron z wodoru prawie całkowicie przeniesiony
na silnie elektroujemny atom
-Proton może przyciągnąć kolejny ujemnie
naładowany atom
Symetryczne: A-H-A
Antysymetryczne: A-H...B
Wiązanie wodorowe
Wiązanie Van der Waalsa
-Występuje zawsze
-Źródło: fluktuacje ładunku w atomach, moment
dipolowy atomów i cząsteczek
-Wiąże atomy o zamkniętych powłokach,
nasycone cząsteczki (kryształy molekularne)
-Duży promień atomowy.
Kształt potencjału w wiązaniu Van
der Waalsa może być przybliżony
potencjałem Lennarda-Jonesa
Wiązanie Van der Waalsa
Przykład: atom helu
Oscylacje ładunku
Wiązanie metaliczne
-Funkcje falowe zewnętrznych elektronów
ulegają przekrywaniu
-Konsekwencją przekrywania się jest
rozszczepienie poziomów i utworzenie
pasma
-Chmura elektronowa rozkłada się na cały
kryształ poprzez pryciąganie elektronów do
kolejnych jąder atomowych
-Nie ma wyróżnionego kierunku wiązania
(struktura krystaliczna związana z
upakowaniem w przestrzeni)
„Morze” swobodnych elektronów pomiędzy „rdzeniami” atomowymi o ładunku dodatnim
Wiązanie metaliczne
Metale grupy 1 uwspólniają tylko po jednym
elektronie – niska temperatura topnienia
(np. sód Na 98°C)
Im więcej elektronów jest uwspólnianych,
tym silniejsze wiązanie (np. magnez Mg – 2
elektrony - 650°C)
Własności metali:
-dobre przewodnictwo elektryczne
-dobre przewodnictwo cieplne
-własności mechaniczne (twardość,
wytrzymałość itp.)