Zaliczenie przedmiotu:
1. J. D. Caserio, M. C. Roberts CHEMIA ORGANICZNA,
PWN Warszawa, 1969
2. R. T.Morrison, R. N. Boyd CHEMIA ORGANICZNA,
PWN Warszawa, 1997
3. J. McMurry CHEMIA ORGANICZNA, PWN Warszawa,
2002
-
ocena z ćwiczeń wynika z sumy
punktów uzyskanych na kolokwiach
wykładowych i sprawdzianach
ćwiczeniowych – na ocenę pozytywną
niezbędne jest zgromadzenie co najmniej
60% punktów
-
ocena pozytywna z ćwiczeń jest
warunkiem koniecznym przystąpienia do
egzaminu
KOLOKWIUM
11.04.2017
20.06.2017
obejmuje materiał wykładowy przedstawiony odpowiednio do dnia
4.04 oraz 13.06
STRUKTURA I WIĄZANIA W ZWIĄZKACH ORGANICZNYCH
ĆWICZENIA Z CHEMII ORGANICZNEJ
PONIEDZIAŁEK
godz. 11.15 s. 360GG
ŚRODA
12.15 s. 410GG
PIĄTEK
9.15 s. 360GG
1828 r. - Friedrich Wöhler
O
+
WYKŁADY Z CHEMII ORGANICZNEJ
NH4 CNO
-
∆
H2N
NH2
WTOREK, godz. 9.15 s. 213GG
1
STRUKTURA I WIĄZANIA W ZWIĄZKACH ORGANICZNYCH
STRUKTURA I WIĄZANIA W ZWIĄZKACH ORGANICZNYCH
1. Atomy pierwiastków występujących w związkach
organicznych biorą udział w określonej liczbie wiązań, np.
Poznawanie względnego rozmieszczenia atomów w
cząsteczce
atomy węgla – czterowiązalne
atomy tlenu – dwuwiązalne
C
O
atomy wodoru i halogenów – jednowiązalne H
Cl
2. Atomy węgla są zdolne do tworzenia wiązań pomiędzy sobą
Poznawanie reakcji chemicznych
WIĄZANIA C – C
C C
C C
C C
pojedyncze
podwójne
potrójne
IZOMERIA
IZOMERY
– różne związki chemiczne o takim
samym wzorze sumarycznym
CH3CH2OH
etanol
IZOMERIA
CH3OCH3
eter dimetylowy
C2H6O
temp. wrzenia [°C]
temp. topnienia [°C]
reakcja z Na
CH3CH2OH
CH3OCH3
etanol
eter dimetylowy
78.5
- 117.3
wydziela się H2
- 24.9
- 138
brak reakcji
IZOMERY KONSTYTUCYJNE
–
różne związki
chemiczne o takim samym wzorze sumarycznym, ale
różniące się konstytucją (sposobem połączenia
atomów ze sobą)
2
STRUKTURA I WIĄZANIA W ZWIĄZKACH ORGANICZNYCH
ENZYMY
SYNTETYCZNY JEDWAB
nylon, rayon
HORMONY
DODATKI DO ŻYWNOŚCI
BIAŁKA
TWORZYWA SZTUCZNE
teflony
polistyren
poliuretany
polipropylen
SYNTETYCZNE
ZWIĄZKI
ORGANICZNE
barwniki
WĘGLOWODANY
sztuczne słodziki
LIPIDY
konserwanty
OH
CH3
KWASY NUKLEINOWE
sztuczne środki zapachowe
CH3
O
TESTOSTERON
męski hormon płciowy
LEKI
PALIWA
SYNTETYCZNE GUMY
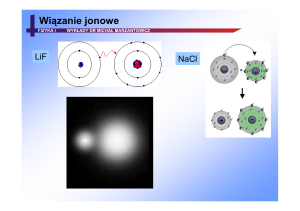
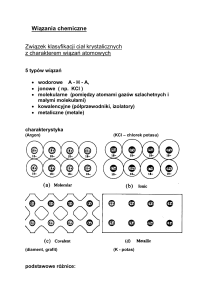
WIĄZANIA JONOWE
WIĄZANIA CHEMICZNE
występuje pomiędzy atomem metalu o małej wartości energii
jonizacji, a atomem niemetalu o dużej ujemnej wartości
powinowactwa elektronowego
oddziaływanie pomiędzy atomami warunkujące powstanie
trwałych pod względem chemicznym cząsteczek
1916 r.
G. N. LEWIS (University of California, Berkeley)
KATION
W. KÖSSEL (Uniwersität München)
11Na
WIĄZANIE JONOWE – elektrostatyczne przyciąganie przeciwnie
naładowanych ładunków elektrycznych
WIĄZANIE KOWALENCYJNE – tworzy się przez ‘uwspólnienie’
elektronów obu atomów biorących udział w wiązaniu
1s2 2s2 2p6 3s1
-1e -
Na+: 1s2 2s2 2p6
[Ne]
ANION
17Cl
1s2 2s2 2p6 3s2 3p5
+1e -
Cl-: 1s2 2s2 2p6 3s2 3p6 [Ar]
3
WIĄZANIA JONOWE
WIĄZANIA JONOWE
występuje pomiędzy dwoma atomami: jednym o niskim potencjale
jonizacyjnym oraz drugim – o dużym powinowactwie elektronowym
NaCl
ELEKTROUJEMNOŚĆ KILKU WYBRANYCH PIERWIASTKÓW
Be
B
C
N
O
1.0
1.5
2.0
2.5
3.0
3.5
Na
Mg
Al.
Si
P
S
0.9
1.2
1.5
1.8
2.1
2.5
K
0.8
WZROST ELEKTROUJEMNOŚCI
WZROST ELEKTROUJEMNOŚCI
Li
MgSO4 NaHCO3
NH4Cl
NaF
F
4.0
związki krystaliczne o wysokich temp. topnienia i wrzenia
dla NaCl tt. 801°C i tw. 1413°C
Cl
3.0
Br
2.8
WIĄZANIA KOWALENCYJNE
ATOMOWE POWINOWACTWO ELEKTRONOWE – jest to miara
dążenia wyizolowanego atomu w fazie gazowej do
przyłączenia elektronu
tworzy się poprzez ‘uwspólnienie‘ elektronów obu atomów
biorących udział w wiązaniu chemicznym
dwa atomy tego samego pierwiastka – para elektronów należy
w równym stopniu do każdego z atomów tworzących wiązanie
ATOMOWA ENERGIA JONIZACJI – jest to ilość energii
potrzebna do usunięcia elektronu z wyizolowanego atomu w
fazie gazowej
··
·
:F:
+
··
·
:F:
·· ··
·· ··
:F:F:
F
– F
WZÓR
STRUKTURALNY
LEWISA
4
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE
WIĄZANIA KOWALENCYJNE
tworzy się poprzez ‘uwspólnienie‘ elektronów obu atomów
biorących udział w wiązaniu chemicznym
··
+
··
2H·
:O:H
H··
δ+
H
O
–O–
N
δ−
H
δ+
–C–
H – Br
dwa atomy różnych pierwiastków o zbliżonym powinowactwie
elektronowym – para elektronów jest przesunięta w stronę
atomu bardziej elektroujemnego
:O:
B
N
H – Cl
δ+
H–F
F
δ−
δ−
δ+
H
O
H
δ+
≡ N
δ−
δ−
B
F
δ+
O=C=O
δ+
δ−
WZÓR
STRUKTURALNY
LEWISA
WIĄZANIE KOWALENCYJNE
SPOLARYZOWANE
WIĄZANIE CHEMICZNE
WIĄZANIE KOWALENCYJNE
X
δ−
δ−
WIĄZANIE KOWALENCYJNE SPOLARYZOWANE
WIĄZANIE JONOWE
δ+
X
F
X
POLARNOŚĆ WIĄZANIA – jest spowodowana różnicą
elektroujemności atomów biorących udział w wiązaniu
chemicznym
δ−
Y
X+ Y-
ELEKTROUJEMNOŚĆ – jest to zdolność atomu do
przyciągania elektronów w wiązaniu chemicznym
WIĄZANIE KOWALENCYJNE
SPOLARYZOWANE
Pauling przyjął elektroujemność równą 4 dla atomu fluoru F
2.5 dla atomu węgla C
CHARAKTER JONOWY WIĄZANIA
5
ŁADUNEK FORMALNY
2.5 dla atomu węgla C
pierwiastek o mniejszej
elektroujemności od węgla
<
<
2.5
O
pierwiastek o większej
elektroujemności od węgla
CH3
N
ŁADUNEK FORMALNY UJEMNY
C
2.5
H
2.1
Li
1.0
Cl
H
H
Li
−δ
C
H
H
ŁADUNEK FORMALNY DODATNI
O
H
C
2.5
H
2.1
Cl
3.0
C +δ
H
ŁADUNEK
FORMALNY
ŁADUNEK
FORMALNY
=
=
e-
liczba
walencyjnych
2
liczby
liczba ewalencyjnych
w atomie
związanym
ŁADUNEK FORMALNY
liczba ewalencyjnych
w atomie
wolnym
1
=
ŁADUNEK
FORMALNY
ŁADUNEK FORMALNY
liczba ewalencyjnych
w atomie
wolnym
H +1
H C N
liczba ewalencyjnych
w atomie
związanym
e-
wiążących
liczba eniewiążących
0
O
O
H
-1
dla
O
O
N
e- walencyjne
6
6
5
e- wiążące
2
4
8
e- niewiążące
6
4
0
ŁADUNEK FORMALNY
-1
0
+1
ŁADUNEK FORMALNY = 6 - 2/2 - 6 = -1
ŁADUNEK FORMALNY = 6 - 4/2 - 4 = 0
ŁADUNEK FORMALNY = 5 - 8/2 - 0 = +1
6
GRUPA
+1
0
-1
B
B
3
4
5
6
7
Obliczamy ogólną liczbę elektronów walencyjnych atomów
wchodzących w skład cząsteczki
4
C
C
C
C
C
C
C
C
STRUKTURY LEWISA
CH3F
+
C
N
N
N
O
O
X
N
N
N
N
N
H3
+
7
= 14 elektronów
F
H
H C F
Pary elektronów umieszczamy
pomiędzy atomami tak, aby
połączyć wszystkie atomy
wchodzące w skład cząsteczki.
H
14 - 4(2) = 6 elektronów
O
O
O
3(1)
C
Pozostające elektrony umieszcza się
jako niewiążące pary elektronów tak,
aby każdy z atomów posiadał ‘oktet
elektronowy’
X
X
H
H C F
H
X = F, Cl, Br, I
6 : 2 =3
STRUKTURY LEWISA
STRUKTURY REZONANSOWE
O
Atomy pierwiastków grupy 3 w wysoce
reaktywnych cząsteczkach mają mniej
niż 8 elektronów, tzw. niepełny oktet
elektronowy
F
O C
F
B
O
C
O
O
O
F
C=O
Atomy pierwiastków okresów 3 i wyższych
(dysponują orbitalami d) mogą
przyjmować więcej niż 8 elektronów, tzw.
rozszerzony oktet elektronowy
O
O
O C
F
F
F
S
F
1.2Å
C–O
1.34Å
-
O
2
3
O
-
2
3
C
F
O -
F
2
3
1.28Å
7
PODSTAWOWE REGUŁY PISANIA STRUKTUR REZONANSOWYCH
1. Struktury graniczne nie istnieją realnie – łączymy je za pomocą
suma polarności poszczególnych wiązań oraz rozmieszczenie
wolnych, niewiążących par elektronowych w cząsteczce
2. Wszystkie struktury rezonansowe różnią się między sobą
położeniem elektronów π oraz elektronów niewiążących
+
+
+
CH3–CH–CH=CH2
CH2–CH2–CH=CH2
CH3–CH=CH–CH2
POLARNOŚĆ CZĄSTECZEK
3. Wszystkie struktury rezonansowe muszą być typu Lewisa
4. Wszystkie atomy należące do układu zdelokalizowanego muszą
leżeć w jednej płaszczyźnie
5. Wszystkie struktury rezonansowe muszą mieć taką samą liczbę
sparowanych elektronów
CH2=CH–CH=CH2
MOMENT DIPOLOWY µ
CH2 –CH=CH–CH2
6. Struktur rezonansowych przedstawiających układy o bardzo
dużej energii nie bierze się pod uwagę, np. CH3 CH3+
POLARNOŚĆ CZĄSTECZEK
GEOMETRIA CZĄSTECZEK
MOMENT DIPOLOWY µ – jest to iloczyn wielkości ładunku Q
na krańcu dipola cząsteczkowego oraz odległości między
ładunkami r
µ=Q ×r
VSEPR – Valence Shell Electron-Pair Repulsion
(Gillespie 1957)
1. Rozważana cząsteczka/jon jest zbudowana z atomu centralnego,
kowalencyjnie związanego z co najmniej dwoma atomami lub
grupami atomów
1D = 3.336 ×10-30 C × m
2. Rozważane są wszystkie walencyjne pary elektronowe atomu
centralnego; rozróżnia się :
µ = 1.85 D
Pary elektronowe ‘wiążące’ – elektrony biorące udział w wiązaniu
kowalencyjnym
H
µ=0
Cl
Cl
Cl
C
Cl
O
H
H
H
Pary elektronowe ‘niewiążące’
H
N
H
C
H
H
H
3. Par elektronowe będą przyjmowały takie ułożenie w przestrzeni,
aby zminimalizować wzajemne oddziaływania odpychające
µ = 1.47 D
8
Poziom
Obszar przestrzeni, w którym prawdopodobieństwo
znalezienia się elektronu jest największe określa się
zwyczajowo ORBITALEM
Podpoziom
energetyczny
konfiguracja elektronowa
przy max. obsadzeniu
1s2
(1)
K
s
(2)
L
s, p
ORBITALE ATOMOWE różnią się:
•
kształtem
•
wielkością
(3)
M
s, p, d
•
energią elektronów opisywanych przez dany orbital
(4)
N
s, p, d, f
2s2 2p6
3s2 3p6 3d10
2e8e18e-
4s2 4p6 4d10 4f14
32e-
ENERGIA
4s < 4p < 4d < 4f
ORBITALE ATOMOWE
ORBITALE ATOMOWE
ZASADY OBSADZANIA ORBITALI PRZEZ ELEKTRONY
1s
płaszczyzna
nodalna
1. Orbital może być ’zajmowany’ co najwyżej przez dwa
elektrony o przeciwnych spinach – zakaz Pauli’ego
2s
2. Następny orbital jest obsadzany wtedy, gdy zajęte są
orbitale o niższej energii
płaszczyzna
nodalna
2py
3. Obsadzanie orbitali o takiej samej energii następuje
zgodnie z regułą Hunda, tzn. elektrony zapełniają tak
orbitale, aby jak największa liczba elektronów była
‘niesparowana’
2p
9
ORBITALE CZĄSTECZKOWE – MOLEKULARNE
ORBITALE ATOMOWE
6C
1s2 2s2 2p2
2e-
1s2 2s2 2p3
7N
3epx py pz
1s2 2s2 2p4
8O
4epx py pz
px py pz
2p
2s
1s
1. Każda para elektronów jest zlokalizowana w pobliżu jąder
2. Kształt orbitali molekularnych i ich wzajemne
rozmieszczenie wynika z kształtu i rozmieszczenia
przestrzennego orbitali atomowych atomów wchodzących
w skład cząsteczki
2H·
1s
H–H
2H·
H–H
1s
σ
ORBITAL ANTYWIĄŻĄCY σ*
2×
×218 kJ mol-1
E
H–H
ENERGIA ABSORBOWNA PODCZAS
PĘKANIA WIĄZANIA
2H·
ENERGIA UWALNIANA PODCZAS
TWORZENIA WIĄZANIA
σ∗
ORBITAL WIĄŻĄCY σ
10
ORBITALE SHYBRYDYZOWANE
MO antywiążący
CH4
ENERGIA
π*
2 orbitale p
π∗
π
MO wiążący
Cząsteczka symetryczna
Wiązania C – H są równocenne; o takiej samej długości i mocy
Kąty walencyjne H – C – H wynoszą 109º28’
2 orbitale p
6C
1s2 2s2 2p2
6C
π
1s2 2s2 2p2
1s2 2s2 2p2
6C
4
1s
×
1H
4 ×
1H
1s1
4 × sp3
1s1
2s 2px py pz
HYBRYDYZACJA
4 ×
1s
1s
2s
2px py pz
4 × sp3
HYBRYDYZACJA
TETRAEDRYCZNA
11
5B
STRUKTURA ETANU
6
węgiel sp3
1s
węgiel sp3
2s 2px py pz
HYBRYDYZACJA
1s
wiązanie σ C–H
wiązanie σ C–C
1s
3 × sp2
2p
HYBRYDYZACJA
TRYGONALNA
STAN WZBUDZONY
STAN sp 2 SHYBRYDYZOWANY
STAN PODSTAWOWY
STRUKTURA ETENU
wiązanie σ C–C
2p
2p
p ORBITAL
sp2
2s
1s
1s
przeniesienie elektronu
wiązanie σ C–H
hybrydyzacja
wiązanie π C–C
C
płaszczyzna nodalna
12
STAN WZBUDZONY
4Be
STAN sp SHYBRYDYZOWANY
STAN PODSTAWOWY
2p
2p
sp
2s
1s
2s 2px py pz
1s
1s
HYBRYDYZACJA
1s
180°°
1s
hybrydyzacja
2 × sp
2p
HYBRYDYZACJA
DYGONALNA
STRUKTURA ETYNU
1.06 A
wiązanie σ C–C
1.09 A
1.10 A
H
H
H
H
H
C
C
1.20 A
wiązanie π C–C
wiązanie π C–C
H
C
1.34 A
1.54 A
wiązanie σ C–H
C
180°°
C
118°°
109.5°°
C
H
H
H
H
H
H
13