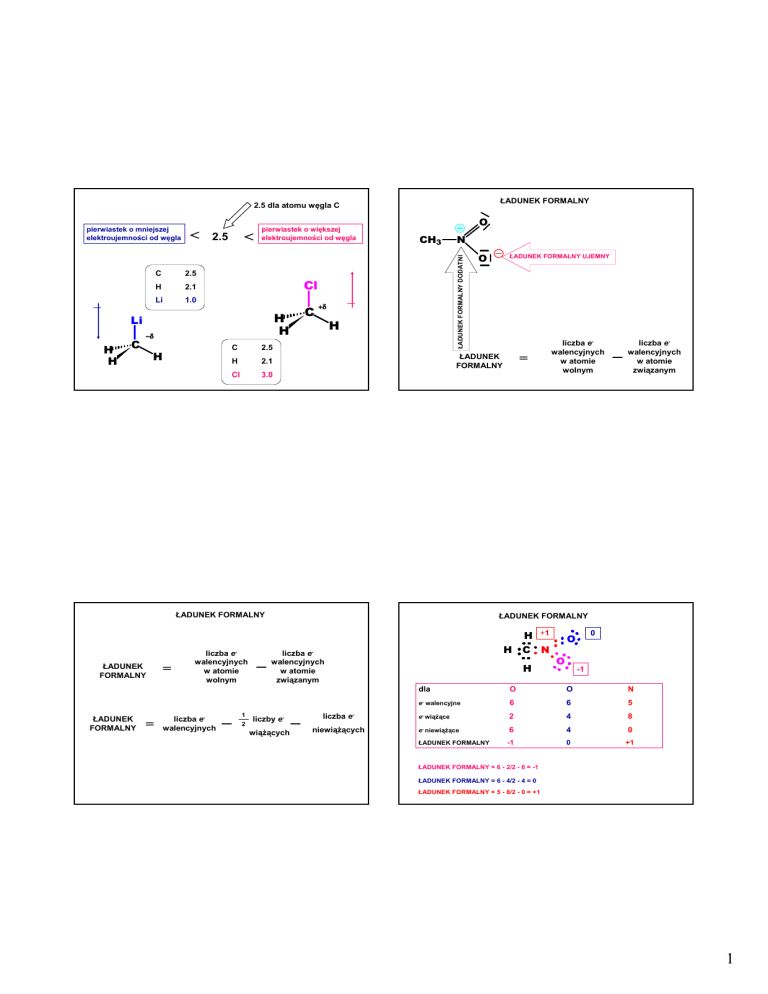
ŁADUNEK FORMALNY
2.5 dla atomu węgla C
O
<
C
2.5
H
2.1
Li
1.0
<
2.5
pierwiastek o większej
elektroujemności od węgla
Cl
H
H
Li
−δ
H
H
C
H
CH3
C
2.5
H
2.1
Cl
3.0
C
N
ŁADUNEK FORMALNY DODATNI
pierwiastek o mniejszej
elektroujemności od węgla
+δ
H
ŁADUNEK
FORMALNY
=
=
liczba ewalencyjnych
w atomie
wolnym
liczba ewalencyjnych
1
2
=
ŁADUNEK
FORMALNY
ŁADUNEK FORMALNY
ŁADUNEK
FORMALNY
ŁADUNEK FORMALNY UJEMNY
O
liczba ewalencyjnych
w atomie
wolnym
liczba ewalencyjnych
w atomie
związanym
ŁADUNEK FORMALNY
H +1
H C N
liczba ewalencyjnych
w atomie
związanym
liczby e-
liczba e-
wiążących
niewiążących
0
O
O
H
-1
dla
O
O
N
e- walencyjne
6
6
5
e- wiążące
2
4
8
e- niewiążące
6
4
0
ŁADUNEK FORMALNY
-1
0
+1
ŁADUNEK FORMALNY = 6 - 2/2 - 6 = -1
ŁADUNEK FORMALNY = 6 - 4/2 - 4 = 0
ŁADUNEK FORMALNY = 5 - 8/2 - 0 = +1
1
GRUPA
+1
0
STRUKTURY LEWISA
-1
CH3F
B
B
3
4
5
6
7
4
C
C
Obliczamy ogólną liczbę elektronów walencyjnych atomów
wchodzących w skład cząsteczki
C
C
C
C
C
C
C
N
N
N
O
O
N
N
3(1)
+
7
H3
= 14 elektronów
F
Pary elektronów umieszczamy
pomiędzy atomami tak, aby
połączyć wszystkie atomy
wchodzące w skład cząsteczki.
H
H C F
H
14 - 4(2) = 6 elektronów
O
O
O
H
Pozostające elektrony umieszcza się
jako niewiążące pary elektronów tak,
aby każdy z atomów posiadał ‘oktet
elektronowy’
X
X
X
N
N
N
+
C
H C F
H
X = F, Cl, Br, I
6 : 2 =3
STRUKTURY LEWISA
STRUKTURY REZONANSOWE
O
Atomy pierwiastków grupy 3 w wysoce
reaktywnych cząsteczkach mają mniej
niż 8 elektronów, tzw. niepełny oktet
elektronowy
F
O C
F
B
O
O
C
O
O
F
C=O
Atomy pierwiastków okresów 3 i wyższych
(dysponują orbitalami d) mogą
przyjmować więcej niż 8 elektronów, tzw.
rozszerzony oktet elektronowy
O
O
O C
F
F
F
S
F
1.2Å
C–O
1.34Å
-
O
2
3
O
-
2
3
C
F
O -
F
2
3
1.28Å
2
PODSTAWOWE REGUŁY PISANIA STRUKTUR REZONANSOWYCH
suma polarności poszczególnych wiązań oraz rozmieszczenie
wolnych, niewiążących par elektronowych w cząsteczce
1. Struktury graniczne nie istnieją realnie – łączymy je za pomocą
2. Wszystkie struktury rezonansowe różnią się między sobą
położeniem elektronów π oraz elektronów niewiążących
+
+
+
CH3–CH–CH=CH2
CH2–CH2–CH=CH2
CH3–CH=CH–CH2
3. Wszystkie struktury rezonansowe muszą być typu Lewisa
POLARNOŚĆ CZĄSTECZEK
4. Wszystkie atomy należące do układu zdelokalizowanego muszą
leżeć w jednej płaszczyźnie
5. Wszystkie struktury rezonansowe muszą mieć taką samą liczbę
sparowanych elektronów
CH2=CH–CH=CH2
MOMENT DIPOLOWY µ
CH2 –CH=CH–CH2
6. Struktur rezonansowych przedstawiających układy o bardzo
dużej energii nie bierze się pod uwagę, np. CH3 CH3+
GEOMETRIA CZĄSTECZEK
POLARNOŚĆ CZĄSTECZEK
VSEPR – Valence Shell Electron-Pair Repulsion
MOMENT DIPOLOWY µ – jest to iloczyn wielkości ładunku Q
na krańcu dipola cząsteczkowego oraz odległości między
ładunkami r
µ=Q ×r
(Gillespie 1957)
1. Rozważana cząsteczka/jon jest zbudowana z atomu centralnego,
kowalencyjnie związanego z co najmniej dwoma atomami lub
grupami atomów
1D = 3.336 ×10-30 C × m
2. Rozważane są wszystkie walencyjne pary elektronowe atomu
centralnego; rozróżnia się :
µ = 1.85 D
Pary elektronowe ‘wiążące’ – elektrony biorące udział w wiązaniu
kowalencyjnym
H
µ=0
Cl
Cl
Cl
C
Cl
O
H
H
H
Pary elektronowe ‘niewiążące’
H
N
H
C
H
H
H
3. Par elektronowe będą przyjmowały takie ułożenie w przestrzeni,
aby zminimalizować wzajemne oddziaływania odpychające
µ = 1.47 D
3
Poziom
Obszar przestrzeni, w którym prawdopodobieństwo znalezienia się
elektronu jest największe określa się zwyczajowo ORBITALEM
Podpoziom
energetyczny
przy max. obsadzeniu
1s2
(1)
K
s
(2)
L
s, p
(3)
M
s, p, d
(4)
N
s, p, d, f
ORBITALE ATOMOWE różnią się:
•
kształtem
•
wielkością
•
energią elektronów opisywanych przez dany orbital
konfiguracja elektronowa
2e-
2s2 2p6
3s2 3p6 3d10
4s2 4p6 4d10 4f14
8e18e32e-
ENERGIA
4s < 4p < 4d < 4f
ORBITALE ATOMOWE
ORBITALE ATOMOWE
ZASADY OBSADZANIA ORBITALI PRZEZ ELEKTRONY
1s
płaszczyzna
nodalna
1. Orbital może być ’zajmowany’ co najwyżej przez dwa elektrony o
przeciwnych spinach – zakaz Pauli’ego
2s
3. Obsadzanie orbitali o takiej samej energii następuje zgodnie z
regułą Hunda, tzn. elektrony zapełniają tak orbitale, aby jak
największa liczba elektronów była ‘niesparowana’
płaszczyzna
nodalna
2py
2. Następny orbital jest obsadzany wtedy, gdy zajęte są orbitale o
niższej energii
2p
4
ORBITALE ATOMOWE
6C
1s2 2s2 2p2
7N
2e-
1s2 2s2 2p3
3epx py pz
ORBITALE CZĄSTECZKOWE – MOLEKULARNE
1s2 2s2 2p4
8O
4epx py pz
px py pz
2p
2s
1s
1. Każda para elektronów jest zlokalizowana w pobliżu jąder
2. Kształt orbitali molekularnych i ich wzajemne rozmieszczenie
wynika z kształtu i rozmieszczenia przestrzennego orbitali
atomowych atomów wchodzących w skład cząsteczki
2H·
1s
2H·
H–H
H–H
1s
σ
2×
×218 kJ mol-1
ORBITAL ANTYWIĄŻĄCY
σ∗
E
H–H
ENERGIA ABSORBOWNA PODCZAS
PĘKANIA WIĄZANIA
2H·
ENERGIA UWALNIANA PODCZAS
TWORZENIA WIĄZANIA
σ∗
ORBITAL WIĄŻĄCY σ
5
ORBITALE SHYBRYDYZOWANE
MO antywiążący
CH4
ENERGIA
π*
2 orbitale p
π∗
π
MO wiążący
Cząsteczka symetryczna
Wiązania C – H są równocenne; o takiej samej długości i mocy
Kąty walencyjne H – C – H wynoszą 109º28’
2 orbitale p
6C
1s2 2s2 2p2
1s2 2s2 2p2
6C
4
1s
4 ×
1s2 2s2 2p2
6C
π
×
1H
1H
1s1
4 × sp3
1s1
2s 2px py pz
HYBRYDYZACJA
4 ×
1s
1s
2s
2px py pz
4 × sp3
HYBRYDYZACJA
TETRAEDRYCZNA
6
5B
STRUKTURA ETANU
6
węgiel sp3
1s
węgiel sp3
2s 2px py pz
HYBRYDYZACJA
1s
wiązanie σ C–H
wiązanie σ C–C
1s
3 × sp2
2p
HYBRYDYZACJA
TRYGONALNA
STAN WZBUDZONY
STAN sp 2 SHYBRYDYZOWANY
STAN PODSTAWOWY
STRUKTURA ETENU
2p
2p
p ORBITAL
wiązanie σ C–C
sp2
2s
1s
1s
przeniesienie elektronu
wiązanie σ C–H
hybrydyzacja
wiązanie π C–C
C
płaszczyzna nodalna
7
STAN WZBUDZONY
4Be
STAN sp SHYBRYDYZOWANY
STAN PODSTAWOWY
2p
2p
sp
2s
1s
2s 2px py pz
1s
HYBRYDYZACJA
1s
1s
180°°
1s
hybrydyzacja
2 × sp
2p
HYBRYDYZACJA
DYGONALNA
STRUKTURA ETYNU
wiązanie σ C–C
H
1.06 A
H
wiązanie π C–C
H
H
H
C
C
1.20 A
wiązanie π C–C
1.09 A
1.10 A
H
C
1.34 A
1.54 A
wiązanie σ C–H
C
C
C
H
H
H
H
H
H
8