CHEMIA ORGANICZNA
Wykład 1
ORGANIZACJA ZAJĘĆ
Warunki zaliczenia
Ćwiczenia
•
3 kartkówki (10 min.) punktowane 0 – 20 pkt.
•
Minimum 50% punktów na zaliczenie (30 pkt.). Skala ocen
zamieszczona jest na stronie katedry
•
2 terminy kartkówki poprawkowej (45 min.), w terminach
egzaminów
•
Zaliczenie z ćwiczeń jest warunkiem dopuszczenia do
egzaminu!!!
ORGANIZACJA ZAJĘĆ
Warunki zaliczenia cd.
Egzamin
• 3 terminy, 2 części po 45 min.
• Część pierwsza - test wyboru, część druga - test aktywny,
• Maksymalnie można uzyskać 100 pkt.
• Egzamin zaliczony po uzyskaniu 51 pkt.
• Ocena z egzaminu to ocena średnia ze wszystkich terminów,
w których student uczestniczył
ORGANIZACJA ZAJĘĆ
Ocena końcowa
• Ocena końcowa z przedmiotu to średnia ważona z oceny
otrzymanej na ćwiczeniach tablicowych i średniej oceny z
egzaminów
• Waga dla oceny z ćwiczeń - 0,4
• Waga dla oceny z egzaminu - 0,6
ORGANIZACJA ZAJĘĆ
Literatura
•Francis A. Carey; Organic Chemistry 4 th Ed. McGraw-Hill Higher Education
2001
•Robert T. Morrison, Robert N. Boyd; Chemia organiczna, PWN 1990 lub
nowsze wydania
•John McMurry Chemia Organiczna, PWN 2005
•Marche’s Advanced Organic Chemistry 5 th Ed. John Wiley & Sons Inc. 2001
Konsultacje
•Laboratorium 9/N1 (pierwszy pawilon Nowej Chemii, parter)
Informacje
•http://www.polsl.pl/wydzialy/RCh/RCh2/Strony/organicznaB.aspx
POCZĄTKI
CHEMII
ORGANICZNEJ
Alchemia
Substancje otrzymywane
z minerałów
Poszukiwania KAMIENIA FILOZOFICZNEGO
niezbędnego do transmutacji
metali nieszlachetnych w złoto
Odkrył że powietrze składa się z więcej niż jednego składnika,
jeden z nich – „ukryty pokarm życia” – nazywamy dzisiaj tlenem.
Michał Sędziwój 1566–1636
Alchemik króla Zygmunta III Wazy
POCZĄTKI CHEMII ORGANICZNEJ
XVIII w.
Substancje otrzymywane
z organizmów żywych różnią się znacznie
od tych otrzymywanych z minerałów
Vis vitalis
Chemia organiczna
Michel Eugène Chevreul
1786 - 1889
POCZĄTKI CHEMII ORGANICZNEJ
Friedrich Wöhler
1800 - 1882
POCZĄTKI CHEMII ORGANICZNEJ
CHEMIA ORGANICZNA – CHEMIA ZWIĄZKÓW WĘGLA
PODZIAŁ POMIĘDZY CHEMIĄ ORGANICZNĄ A NIEORGANICZNĄ JEST PODZIAŁEM UMOWNYM,
PONIEWAŻ NIEKTÓRE ZWIĄZKI NIE DAJĄ SIĘ PRZYPISAĆ TYLKO DO JEDNEJ Z NICH.
CHEMICZNE PISMO OBRAZKOWE
Wiązania chemiczne
Wiązania chemiczne
Wiązania chemiczne
Wiązania chemiczne
sposoby przedstawiania wzorów przestrzennych
Wiązania chemiczne
sposoby przedstawiania wzorów przestrzennych
Wiązania chemiczne
sposoby przedstawiania wzorów przestrzennych
Wiązania chemiczne
wiązanie chemiczne zdelokalizowane
Pozostałe symbole
strzałki
Strzałka wskazująca kierunek przemiany,
stosowana w zapisie
większości schematów reakcji chemicznych
Pozostałe symbole
strzałki
Strzałka wskazująca, na wyraźnie
odwracalny charakter reakcji
Pozostałe symbole
strzałki
Strzałka stanu równowagi dynamicznej
Tautomeria
keto-enolowa
Pozostałe symbole
strzałki
Strzałka „mezomeryczna”,
stosowana przy rysowaniu struktur granicznych
Pewnego letniego dnia powracałem ostatnim omnibusem przez puste w tym czasie ulice,
tego zwykle ożywionego miasta [Londynu].
Zatonąłem w marzeniach i przed moimi oczami
zaczęły krążyć atomy. Zawsze widziałem te małe twory
w ruchu. Teraz widziałem, jak dwa mniejsze
łączą się ze sobą w pary,
jak większe otaczają dwa mniejsze, a jeszcze większe
utrzymywały to wszystko w zawrotnym tańcu.
Widziałem, jak większe atomy tworzyły łańcuch,
wciągając mniejsze, ale tylko na końcach łańcucha (...).
Tak powstała teoria strukturowa.*
Friedrich August Kekulé von Stradonitz
1829-1896
* Cyt. za: Andrzej Wróblewski, Taniec atomów, Wiedza i Życie, sierpień 2009, s. 65. Warszawa: Prószyński Media. ISSN 0137-8929
Pozostałe symbole
strzałki
Strzałki oznaczająca
pozorne przesunięcie par elektronowych
Pozostałe symbole
strzałki
Strzałki oznaczająca
przesunięcie/przeniesienie elektronu
Pozostałe symbole
ładunki formalne, rodniki, pary elektronowe
Niesparowany elektron, używany do oznaczania rodników
Para elektronowa (wolna para elektronowa)
Dodatni ładunek formalny atomu, ładunek jonu
Ujemny ładunek formalny atomu, ładunek jonu
Zasady zapisu wzorów chemicznych Lewisa
1. Dla każdego indywiduum chemicznego
Pozostałe symbole - zastosowanie
posiadającego elektrony zlokalizowane
można
napisać wzór
elektronowy
2. Całkowita
liczba
elektronów walencyjnych w cząsteczce i rodniku,
zwanymusi
strukturą
Lewisa
obrazujący
położenie
tych elektronów
być równa
sumie
wszystkich
znajdujących
się na
(przedstawia się jedynie elektrony walencyjne)
powłokach zewnętrznych elektronów dostarczanych cząsteczce
przez poszczególne atomy.
Zasady zapisu wzorów chemicznych Lewisa cd.
2. W przypadku anionów liczbę elektronów
powiększa się odpowiednio o ładunek jonu,
natomiast w przypadku kationów odpowiednio zmniejsza
Zasady zapisu wzorów chemicznych Lewisa cd.
3. Należy ustalić, które z elektronów znajdują się
w wiązaniach kowalencyjnych, a które pozostają niewiążącymi
4. Elektrony niewiążące stanowią część powłoki walencyjnej tylko jednego atomu,
natomiast elektrony w wiązaniach kowalencyjnych
stanowią część powłok walencyjnych obydwu atomów tworzących wiązanie
Zasady zapisu wzorów chemicznych Lewisa cd.
B
C
N
O F
5. Atomy drugiego okresu mogą mieć najwyżej osiem elektronów walencyjnych
H
6. Wodór, należący do pierwszego okresu, może ich mieć co najwyżej dwa
5. Jeżeli istnieje wybór między strukturami z sześcioma lub siedmioma elektronami
w sferze walencyjnej pierwiastka z drugiego okresu,
a strukturą z oktetem elektronowym, to ta druga, na ogół,
odpowiada strukturze rzeczywistej
Wyjątek!
Tlen w stanie
trypletowym
Tlen w stanie
singletowym
5. W wielu przypadkach, pomimo tego że mamy do czynienia
z cząsteczką nienaładowaną, istnieje potrzeba zapisania
ładunku na poszczególnych atomach – jest to tzw. ładunek formalny
ładunek
formalny
atomu
=
Liczba elektronów
dostarczana przez
atom
(Liczba wolnych
elektronów
+
Połowa elektronów
tworzących wiązanie)
Jeżeli wynik > 0, to atom posiada ładunek formalny dodatni i zapisuje się
go ze znakiem
Jeżeli wynik < 0, to atom posiada ładunek formalny ujemny i zapisuje się
go ze znakiem
PRZYKŁAD
ładunek
1
formalny
atomu
ładunek
-1
formalny
atomu
=
(Liczba wolnych
elektronów
(0 ++ 4)
Połowa elektronów
tworzących wiązanie)
Liczba elektronów
dostarczana
5 przez
atom
==
6
-
(6 + 1)
ZADANIE
DOMOWE
Narysować strukturę Lewisa poniższego związku:
Rodzaje wiązań chemicznych
Wiązanie kowalencyjne
Wiązanie kowalencyjne spolaryzowane
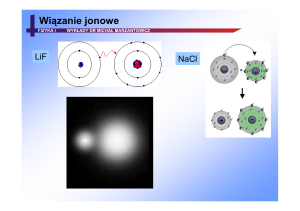
Wiązanie jonowe
Wiązanie wodorowe
Rodzaje wiązań chemicznych
Elektroujemność –
zdolność atomów pierwiastka
do przyciągania elektronów
H
2,2
Li
B
C
N
O
F
1,0
2,0
2,5
3,0
3,5
4,0
Na
0,9
*Wartości elektroujemności podane w skali Paulinga
H
2,2
Li
B
C
N
O
F
1,0
2,0
2,5
3,0
3,5
4,0
Na
0,9
Wiązanie kowalencyjne – różnica elektroujemności
atomów 0 – 0,4
Wiązanie kowalencyjne
spolaryzowane –
różnica elektroujemności
atomów 0,4 -1,7
Wiązanie jonowe - różnica elektroujemności atomów >1,7
Wiązanie kowalencyjne
Orbital molekularny s – orbital utworzony przez takie
nałożenie dwóch orbitali atomowych, że środek
gęstości elektronowej leży na osi
łączącej dwa jądra atomowe
Wiązanie kowalencyjne
Wiązanie kowalencyjne
Wiązanie kowalencyjne
Hybrydyzacja
12
6
C
CH4
1s2
2s2
2p2
Hybrydyzacja
12
6
C
CH4
1s2
2s2
2p2
1s2
sp3
Hybrydyzacja sp3 – kombinacja jednego orbitalu s i trzech orbitali p
Hybrydyzacja
1s2
sp3
Orbital sp3 atomu węgla i orbital atomowy s wodoru
Orbital molekularny wiążący ssp3-s
KONIEC