"Z A T W I E R D Z A M"
Dziekan Wydziału Nowych Technologii i Chemii
Dr hab. inż. Stanisław CUDZIŁO, prof. WAT
Warszawa, dnia ..........................
SYLABUS PRZEDMIOTU
NAZWA PRZEDMIOTU: ............ CHEMIA OGÓLNA I NIEORGANICZNA..........................................................
SUBJECT NAME: ............ GENERAL AND INORGANIC CHEMISTRY.................................................................
Kod przedmiotu: ................ WTCCXCSI-ChON..............................................................................................................
Podstawowa jednostka organizacyjna (PJO): .......... Instytut Chemii.................................................................
(prowadząca kierunek studiów)
Kierunek studiów: ............ CHEMIA.....................................................................................................................................
Specjalność: ................ wszystkie specjalności................................................................................................................
Poziom studiów:
studia pierwszego stopnia .................................................................................................
Forma studiów:
studia stacjonarne ....................................................................................................................
Język prowadzenia: .............. polski.....................................................................................................................................
Sylabus ważny dla naborów od roku akademickiego ..........2012/13...................................................................
1. REALIZACJA PRZEDMIOTU
Osoba(-y) prowadząca(-e) zajęcia (koordynatorzy): prof. dr hab. inż. Krzysztof Czupryński
PJO/instytut/katedra/zakład WTC / Instytut Chemii / Zakład Chemii
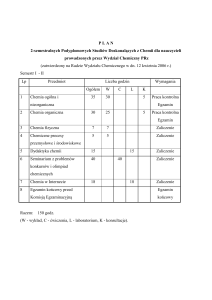
2. ROZLICZENIE GODZINOWE
forma zajęć, liczba godzin/rygor
(x egzamin, + zaliczenie, # projekt)
semestr
I
razem
wykłady
ćwiczenia
90
60 / x
30 / +
II
razem
150
60 / x
30 / +
laboratoria
projekt
punkty
ECTS
seminarium
8
60 / +
6
60 / +
14
3. PRZEDMIOTY WPROWADZAJĄCE WRAZ Z WYMAGANIAMI WSTĘPNYMI
Chemia; Wymagania wstępne: poziom szkoły średniej ogólnokształcącej;
Fizyka; Wymagania wstępne: poziom szkoły średniej ogólnokształcącej;
Matematyka; Wymagania wstępne: poziom szkoły średniej ogólnokształcącej;
4. ZAKŁADANE EFEKTY KSZTAŁCENIA
Symbol
Efekty kształcenia
odniesienie do
efektów kształcenia dla kierunku
W1
Student zna współczesne poglądy na budowę materii, w tym na budowę
atomu, cząsteczki i wiązań chemicznych oraz praw rządzących przemianami chemicznymi. Potrafi pisać i uzgadniać reakcje chemiczne.
K_W01
W2
Student zna właściwości chemiczne pierwiastków i ich związków
K_W01, K_W17
W3
Student zna klasyczne metody badań i obserwacji stosowane w analizie
jakościowej kationów, anionów, substancji prostych i złożonych.
K_W04
W4
Zna podstawowe metody obliczeniowe stosowane do rozwiązywania typowych problemów z zakresu chemii ogólnej.
K_W09
W5
Zna podstawowe zasady bezpieczeństwa i higieny pracy w laboratorium
analizy jakościowej.
K_W10
U1
Potrafi analizować problemy chemiczne oraz znajdować ich rozwiązania w
oparciu o poznane prawa, twierdzenia i metody.
K_U01
U2
Student potrafi dokonać usystematyzowanego opisu właściwości chemicznych pierwiastków w kontekście podziału na grupy i podgrupy według układu okresowego pierwiastków.
K_U01
U3
Student potrafi analizować chemiczne aspekty środowiska naturalnego, w
którym żyje.
K_U13, K_U14
U4
Student potrafi przygotować i przedstawić dobrze udokumentowane opracowanie problemu z zakresu analizy związków nieorganicznych.
K_U05, K_U08
K1
Student potrafi pracować i współdziałać w grupie.
K_K01, K_K02
K2
Student ma świadomość wpływu działalności substancji chemicznych na
środowisko i związanej z tym odpowiedzialności za podejmowane decyzje.
K_K07
5. METODY DYDAKTYCZNE
Wykład z wykorzystaniem metod multimedialnych.
Samodzielne studia literaturowe.
Metody obliczeniowe w ramach ćwiczeń audytoryjnych.
Samodzielne prowadzenie eksperymentów w ramach analizy jakościowej kationów i anionów.
6. TREŚCI PROGRAMOWE
lp
tematyka zajęć
1.
SEMESTR I
Podstawy chemii
Zadania i zakres chemii. Prawa chemiczne. Prawo
zachowania masy. Prawo stosunków stałych.
Związek chemiczny. Prawo stosunków wielokrotnych.
Atomy, pierwiastki i układ okresowy.
Teoria atomistyczna Daltona. Cząstki subatomowe.
Masa atomowa. Jednostka masy atomowej. Teoria
Bohra. Liczby kwantowe. Dwoista natura elektronów. Zasada nieoznaczoności Heisenberga. Równanie falowe Schrödingera. Orbitale atomowe. Zakaz Pauliego. Reguła Hunda. Kolejność obsadzania
poziomów energetycznych. Pierwiastki chemiczne.
Układ okresowy pierwiastków.
Cząsteczki i wiązania chemiczne.
Budowa cząsteczki chemicznej. Wiązania chemiczne, podstawy teorii wiązań walencyjnych, założenia teorii orbitali molekularnych. Podstawowe
typy wiązań chemicznych: wiązanie jonowe, wiązanie kowalencyjne, wiązanie kowalencyjne spolaryzowane, wiązanie koordynacyjne, wiązanie metaliczne.
Stechiometria.
Reakcje chemiczne. Stopień utlenienia. Utlenianie
i redukcja. Stopień utlenienia, a nomenklatura
2.
3.
4.
liczba godzin
wykł.
ćwicz.
4
4
6
2
6
2
2
8
lab.
proj.
semin.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
związków nieorganicznych. Bilansowanie równań
chemicznych. Obliczenia z zastosowaniem równań
chemicznych. Równoważnik.
Roztwory i równowagi w roztworach wodnych.
Stężenie. Elektrolity. Reakcje w roztworach. Obliczenia z wykorzystaniem stałej dysocjacji. Dysocjacja wody, pH. Miareczkowanie i wskaźniki. Roztwory buforowe. Jony kompleksowe. Iloczyn rozpuszczalności. Amfoteryczność. Hydroliza.
Podstawowe pojęcia termodynamiki chemicznej.
Pojęcie układu. Energia wewnętrzna. I zasada
termodynamiki. Funkcje stanu. Entalpia. Pojemność cieplna układu pod stałym ciśnieniem i w stałej objętości. II zasada termodynamiki. Entropia.
Energia swobodna. Entalpia swobodna. Ciepło reakcji.
Podstawy kinetyki.
Szybkość reakcji. Rząd reakcji. Mechanizm reakcji.
Cząsteczkowość reakcji. Równania kinetyczne reakcji chemicznych. Zależność szybkości reakcji od
temperatury. Akt reakcyjny oraz zespół reakcyjny
aktywny. Teorie szybkości reakcji.
Podstawy statyki chemicznej.
Reakcje odwracalne. Prawo działania mas. Potencjał chemiczny. Termodynamiczna stała równowagi. Wyznaczanie stałych równowagi. Temperaturowa zależność stałych równowagi.
Wodór, metale alkaliczne (litowce) i metale ziem
alkalicznych (berylowce).
Występowanie, otrzymywanie, właściwości i zastosowanie wodoru. Właściwości metaliczne. Występowanie, otrzymywanie i zastosowanie pierwiastków metalicznych i ziem alkalicznych. Związki.
Pierwiastki przejściowe.
Konfiguracja elektronowa. Jony kompleksowe.
Podgrupy: skandu, tytanu, wanadu, chromu, manganu, żelaza. Triada platynowców lekkich
Pierwiastki grupy IIIA.
Występowanie, otrzymywanie, właściwości i zastosowanie boru, glinu, galu, indu i talu. Związki
Pierwiastki grupy IVA.
Występowanie, otrzymywanie, właściwości i zastosowanie węgla, krzemu, germanu, cyny i ołowiu.
Związki.
Pierwiastki grupy VA.
Występowanie, otrzymywanie, właściwości i zastosowanie azotu, fosforu, arsenu, antymonu i bizmutu. Związki
Pierwiastki grupy VIA.
Występowanie, otrzymywanie, właściwości i zastosowanie tlenu, siarki, selenu, telluru i polonu.
Związki.
Pierwiastki grupy VIIA.
2
10
4
4
2
4
6
2
4
4
4
2
4
16.
17.
1.
2.
4.
5.
6.
7.
8.
Występowanie, otrzymywanie, właściwości i zastosowanie fluoru, chloru, bromu, jodu i astatu.
Związki.
Pierwiastki grupy 0.
Występowanie, otrzymywanie, właściwości i zastosowanie helowców. Związki helowców.
Chemiczne środowisko człowieka.
Powietrze. Zanieczyszczenie atmosfery. Silniki spalinowe. Smog fotochemiczny. Zanieczyszczenie
wody. Detergenty i eutrofizacja. Dodatki do żywności. Substancje rakotwórcze.
SEMESTR II
Techniki i zasady pracy w laboratorium.
Sprzęt, naczynia laboratoryjne, odczynniki, bezpieczeństwo pracy. Równowagi jonowe w roztworach
elektrolitów. Rozpuszczalność, iloczyn rozpuszczalności, stany równowag jedno i wielofazowych.
+
Reakcje charakterystyczne dla kationów Ag ,
2+
2+
Hg2 .Pb .
Analiza wybiorcza i systematyczna kationów I grupy. Zadanie kontrolne.
2+
2+
Reakcje charakterystyczne dla kationów Hg ,Cu
2+
3+
3+
5+
3+
5+
2+
4+
, Cd , Bi , As , As , Sb ,Sb , Sn , Sn
Analiza wybiórcza i systematyczna kationów II grupy.
Osady krystaliczne i koloidalne – warunki strącania.
Reakcje utleniania – redukcji w analizie jakościowej. Zadanie kontrolne.
2+
Reakcje charakterystyczne dla kationów Co ,
2+
2+
3+
2+
3+
2+
3+
Ni , Fe , Fe , Mn , Cr , Zn , Al .
Analiza wybiórcza i systematyczna kationów III
grupy. Związki kompleksowe – warunki tworzenia
się kompleksów, trwałość związków kompleksowych, zastosowanie w analizie jakościowej. Zadanie kontrolne.
2
2
2
6
12
12
2+
Reakcje charakterystyczne dla kationów Ca ,
2+
2+
+
+
2+
+
Ba , Sr , K , Na , Mg ,NH4 .
6
Analiza wybiórcza i systematyczna kationów IV i V
grupy. Analiza płomieniowa, mikrokrystaloskopowa,
kroplowa – jako metody analizy jakościowej. Zadanie kontrolne.
Reakcje charakterystyczne dla anionów.
Analiza wybiórcza i systematyczna anionów. Zadanie kontrolne.
12
Badanie składu złożonej mieszaniny substancji
nieorganicznych.
10
Zadanie kontrolne
Razem
60
30
60
.....
......
7. LITERATURA
podstawowa:
1. A. Bielański
Podstawy chemii nieorganicznej
2. J. Konarski, K. Radomska Chemia nieorganiczna cz. I. Podstawy analizy jakościowej
3. K. Radomska, J. Konarski Chemia nieorganiczna cz. II. Analiza jakościowa
uzupełniająca:
1. P.A. Cox
Krótkie wykłady. Chemia nieorganiczna
2010
1986
1987
2006
2. J. Choma
3. F. A. Cotton, G. Wilkinson,
P. L. Gaus,
4. red. A. Śliwa
Chemia ogólna i nieorganiczna
Chemia nieorganiczna. Podstawy
1991
1995
Obliczenia chemiczne. Zbiór zadań z chemii
ogólnej, analitycznej i nieorganicznej
1970
5. A. Jabłoński,
6. H. Całus,
”Obliczenia w chemii nieorganicznej”
„Podstawy obliczeń chemicznych”
O W PWr. 2002
WNT 1987
8. SPOSOBY WERYFIKACJI ZAKŁADANYCH EFEKTÓW KSZTAŁCENIA
Przedmiot zaliczany jest na podstawie: egzaminu, zaliczenia ćwiczeń audytoryjnych i laboratoriów.
Egzamin jest przeprowadzany w formie pisemnej i ustnej.
Warunkiem dopuszczenia do egzaminu jest zaliczenie ćwiczeń.
Warunek konieczny do uzyskania zaliczenia ćwiczeń audytoryjnych: zaliczenie pisemnego
sprawdzianu.
Warunek konieczny do uzyskania zaliczenia laboratoriów: poprawne przeprowadzenie analizy,
zaliczenie sprawdzianów pisemnych (wejściówek), poprawny opis eksperymentów - zatwierdzone
sprawozdania laboratoryjne.
efekty W1, W2, U1, U2, U3, K1 sprawdzane są: na egzaminie
efekty W2, W4, U1, K1, K2 sprawdzane są: na zaliczeniu ćwiczeń
efekty W3, W5, U1, U4, K1, K2 sprawdzane są: na laboratoriach
autor(rzy) sylabusa
kierownik jednostki organizacyjnej
odpowiedzialnej za przedmiot
................................
................................
Prof. dr hab. inż. Krzysztof Czupryński
Prof. dr hab. inż. Jerzy CHOMA