WYDZIAŁ CHEMICZNY POLITECHNIKI GDAŃSKIEJ
Kierunek Inżynieria Materiałowa
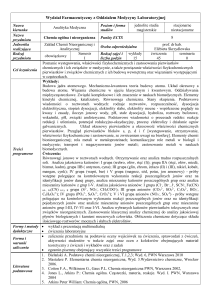
Nazwa przedmiotu
Semestr
Chemia I – Chemia Ogólna i Nieorganiczna
I
Godziny
2
w
c
l
p
Kod
Punkty ECTS
IM 3.1
s
Sposób zaliczenia
E
Katedra Chemii Nieorganicznej
dr inż. Maciej Walewski
Odpowiedzialny (a)
Przedmioty poprzedzające: Brak
Wymagania wstępne: Znajomość chemii w
zakresie szkoły średniej
Założenia i cele przedmiotu: Przekazanie aktualnej wiedzy o budowie materii. Wykazanie wpływu
struktury wewnętrznej na właściwości chemiczne i fizyczne związków chemicznych.
Metody dydaktyczne: Wykład tradycyjny
Treści programowe:
1. Atomy i cząsteczki: Materia, masa, energia. Model standardowy. Atom, izotop,
pierwiastek chemiczny. Liczba atomowa, masowa, masa atomowa. Mol.
2. Struktura elektronowa atomu: Podstawy mechaniki kwantowej. Równania de Broglie’a,
Schrödingera, zasada Heisenberga. Liczby kwantowe. Orbitale. Reguły Pauli’ego i Hunda.
Rozpis elektronów.
3. Klasyfikacja pierwiastków chemicznych: Układ okresowy a budowa atomów. Bloki
elektronowe. Typy pierwiastków chemicznych. Okresowa zmiana właściwości fizycznych i
chemicznych.
4. Wiązania chemiczne: Wiązania: jonowe, kowalencyjne, spolaryzowane, koordynacyjne.
Geometria cząsteczek. Hybrydyzacja orbitali. Metoda LCAO i VSEPR. Wiązanie
wodorowe, metaliczne, van der Waalsa.
5. Klasyfikacja związków chemicznych: Wodorki, tlenki, kwasy, zasady, sole. Współczesna
nomenklatura. Wpływ typu wiązań na właściwości fizyczne i chemiczne.
6. Reakcje chemiczne: Typy reakcji chemicznych. Efekty energetyczne. Podstawy
termodynamiki i termochemii. Równowaga chemiczna. Kinetyka reakcji chemicznych.
7. Równowagi w roztworach wodnych: Stężenia roztworów. Dysocjacja elektrolityczna.
Elektrolity mocne i słabe. Równowaga ac-bas. Teorie kwasów i zasad. Wskaźniki.
Hydroliza, bufory, amfoteryzm. Strącanie osadów, iloczyn rozpuszczalności.
8. Podstawy elektrochemii: Potencjał red-ox. Reakcje red-ox. Szereg elektrochemiczny.
Ogniwa galwaniczne. Elektroliza.
Wykaz literatury podstawowej i uzupełniającej:
1. A. Bielański, Podstawy chemii nieorganicznej, PWN. Warszawa 1987
2. L. Jones, P. Atkins, Chemia ogólna, Wydawnictwo Naukowe PWN, Warszawa 2004
Warunki zaliczenia przedmiotu: zaliczenie ćwiczeń rachunkowych i pozytywny wynik egzaminu.
Proszę o wypełnienie szarych pól Odpowiedzialny(a) i Treść programu
WYDZIAŁ CHEMICZNY POLITECHNIKI GDAŃSKIEJ
Kierunek Inżynieria Materiałowa
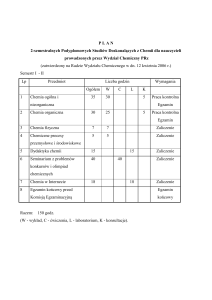
Chemia Ogólna i Nieorganiczna- ćwiczenia
rachunkowe
Semestr I
Godziny
1
Nazwa przedmiotu
w
c
l
p
Kod
IM 3.1
Punkty ECTS
s
Sposób zaliczenia
Z
Katedra Chemii Nieorganicznej
dr inż. Maciej Walewski
Odpowiedzialny (a)
Przedmioty poprzedzające: Brak
Wymagania wstępne: Podstawy
chemicznych – zakres szkoły średniej
obliczeń
Założenia i cele przedmiotu: Przedstawienie podstawowych obliczeń chemicznych w aspekcie ich
praktycznego zastosowania, zwłaszcza w chemii analitycznej oraz technologii chemicznej.
Metody dydaktyczne: Ćwiczenia tablicowe
Treści programowe:
9. Układanie równań reakcji chemicznych: Reakcje utleniania i redukcji. Stopnie
utlenienia. Bilansowanie reakcji red-ox. Dobór środowiska reakcji. Reakcje dysproporcji.
10. Roztwory: Sposoby wyrażania stężeń roztworów. Przeliczanie stężeń. Przygotowywanie
roztworów. Mieszanie roztworów. Reakcje w roztworach. Miareczkowanie. Obliczanie
wyników analiz wolumetrycznych.
11. Stechiometria: Obliczenia stechiometryczne i ich zastosowanie do ustalania wzorów
rzeczywistych, wyników analizy grawimetrycznej oraz bilansowania procesów
technologicznych.
Wykaz literatury podstawowej i uzupełniającej:
3. Z. Bądkowska, E. Koliński, M. Wojnowska, Obliczenia z chemii nieorganicznej,
Wydawnictwo PG, 1996r - skrypt
4. Praca zbiorowa, Obliczenia z chemii 2008 – skrypt, w wersji elektronicznej:
http://siorpc12.chem.pg.gda.pl/?co=analiza
Warunki zaliczenia przedmiotu: Pozytywne zaliczenie kolokwiów.
Proszę o wypełnienie szarych pól Odpowiedzialny(a) i Treść programu
WYDZIAŁ CHEMICZNY POLITECHNIKI GDAŃSKIEJ
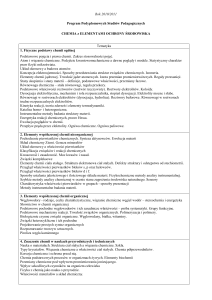
Kierunek Inżynieria Materiałowa
Chemia Ogólna i Nieorganiczna- ćwiczenia
laboratoryjne
Semestr II
Godziny
2
Nazwa przedmiotu
w
c
l
p
Kod
IM 3.2
Punkty ECTS
s
Sposób zaliczenia
Z
Katedra Chemii Nieorganicznej
dr inż. Maciej Walewski
Odpowiedzialny (a)
Przedmioty poprzedzające: Chemia I, sem. I
Wymagania wstępne: Brak
Założenia i cele przedmiotu: Poznanie właściwości fizycznych i chemicznych podstawowych grup
związków chemicznych w aspekcie ich zastosowania w analizie jakościowej.
Metody dydaktyczne: Indywidualna praca studentów.
Treści programowe:
Wykorzystanie reakcji chemicznych związków nieorganicznych w analizie jakościowej.
Analiza jakościowa kationów: Rozdział i analiza kationów w obrębie poszczególnych grup
analitycznych. Analiza mieszaniny kationów.
Analiza jakościowa anionów: Charakterystyczne reakcje analityczne anionów. Identyfikacja w
obrębie grup analitycznych. Analiza mieszaniny anionów.
Identyfikacja substancji nieorganicznych: Tlenki, wodorotlenki, kwasy, sole, metale, stopy,
minerały, produkty przemysłu nieorganicznego.
Wykaz literatury podstawowej i uzupełniającej:
5. J. Prejzner, Chemia nieorganiczna – laboratorium – skrypt, Wydawnictwo PG, 2004
Warunki zaliczenia przedmiotu: Pozytywne zaliczenie kolokwiów oraz praktyczne wykonanie
programu ćwiczeń.
Proszę o wypełnienie szarych pól Odpowiedzialny(a) i Treść programu