Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej
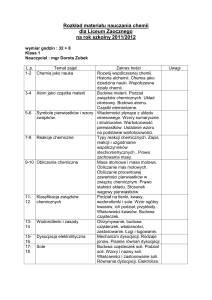
Nazwa
kierunku
Nazwa
przedmiotu
Jednostka
realizująca
Rodzaj
przedmiotu
Analityka Medyczna
Chemia ogólna i nieorganiczna
Poziom i forma
studiów
Punkty ECTS
jednolite studia
magisterskie
stacjonarne
niestacjonarne
8
Zakład Chemii Nieorganicznej i
prof. dr hab.
Osoba odpowiedzialna
Analitycznej
Elżbieta Skrzydlewska
Semestr
ćwiczenia
seminaria
Rodzaj zajęć i wykłady
obowiązkowy
I
15
45
0
liczba godzin
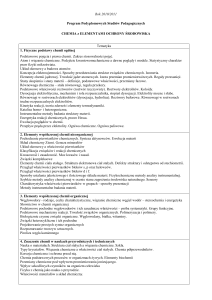
Poznanie występowania, właściwości fizykochemicznych i zastosowania pierwiastków
chemicznych i ich związków w medycynie, a także powiązanie właściwości fizykochemicznych
Cel kształcenia
pierwiastków i związków chemicznych z ich budową wewnętrzną oraz wiązaniami występującymi
w cząsteczkach.
Wykłady:
Budowa jądra atomowego. Mechaniczno-kwantowa teoria budowy atomu. Układ okresowy a
budowa atomu. Wiązania chemiczne w ujęciu klasycznym i kwantowym. Oddziaływania
międzycząsteczkowe. Związki kompleksowe i ich znaczenie w naukach biomedycznych. Elementy
kinetyki chemicznej, katalizatory. Równowaga chemiczna. Stany skupienia. Podstawowe
wiadomości o roztworach wodnych: rodzaje roztworów, rozpuszczalność, dysocjacja
elektrolityczna, stopień dysocjacji, elektrolity słabe, elektrolity mocne - współczesne poglądy na
kwasy i zasady, iloczyn jonowy wody, pH, stałe dysocjacji, hydroliza, roztwory buforowe,
wskaźniki, pH, związki amfoteryczne. Podstawowe wiadomości o procesach redoks: reakcje
redukcji i utleniania, potencjał redukcyjno-oksydacyjny, procesy elektrolizy i działanie ogniw
galwanicznych.
Układ okresowy pierwiastków a okresowość właściwości chemicznych
pierwiastków. Przegląd pierwiastków bloków s, p, d i f [występowanie, otrzymywanie,
właściwości fizykochemiczne i zastosowanie, ze zwróceniem uwagi na biosferę]. Elementy chemii
bionieorganicznej; rola metali w metaloproteinach; komunikacyjne role metali w biologii i
medycynie; transport i magazynowanie jonów metali; zastosowanie metali w naukach
biomedycznych.
Treści
programowe
Ćwiczenia:
Równowagi jonowe w roztworach wodnych. Otrzymywanie oraz analiza trudno rozpuszczalnych
soli. Analiza jakościowa kationów: I grupa (srebro, ołów, rtęć (I)); grupa IIA (rtęć, ołów, miedź,
bizmut, kadm), grupa IIB ( antymon, cyna); III grupa (glin, chrom, żelazo (II) i (III), nikiel, kobalt,
mangan, cynk); IV grupa (wapń, bar) i V grupa (magnez, sód, potas, jon amonowy) - próby
wstępne polegające na kontrolowanym wykonaniu reakcji poszczególnych jonów oraz na
identyfikacji jonów danej grupy, analiza mieszaniny kationów poszczególnych grup oraz analiza
mieszaniny kationów z grup I-V. Analiza jakościowa anionów: I grupa (Cl–, Br–, J-, SCN-, Fe(CN)
222264-, Fe(CN) 63-); II grupa (S , NO2 , CH3COO ); III grupa anionów (CO3 , SO3 , C2O4 , BO2 ,
C4H4O62-); IV grupa (PO43-, S2O32-, CrO42-); V i VI grupa anionów (NO3-, SO4-2) - próby wstępne
polegające na kontrolowanym wykonaniu reakcji poszczególnych jonów oraz na identyfikacji
pojedynczych jonów oraz analizie mieszaniny anionów poszczególnych grup oraz mieszaniny
anionów grup I-III, IV-VI oraz I-VI. Analiza wybranych kationów pierwiastków toksycznych oraz
związków nieorganicznych. Zastosowanie klasycznej analizy chemicznej do analizy jakościowej
płynów biologicznych i kamieni moczowych człowieka. Obliczenia chemiczne dotyczące składu
ilościowego roztworów: mocnych i słabych elektrolitów.
Formy i metody wykład z prezentacją multimedialną
dydaktyczne
ćwiczenia laboratoryjne
zaliczenie przedmiotu na podstawie oceny wejściówek na ćwiczenia, sprawozdań z ćwiczeń,
Forma i
aktywności studentów w trakcie zajęć oraz ocen z kolokwiów obejmujących materiał
warunki
teoretyczny z ćwiczeń i wykładów oraz z zadań
zaliczenia
egzamin pisemny obejmujący wszystkie treści programowe
1. Bielański A. Podstawy chemii nieorganicznej, T.1,2,3; Wyd. 6, PWN Warszawa 2010
2. Mastalerz P. Elementarna chemia nieorganiczna, Wyd. 3.Wydawnictwo chemiczne, Wrocław
2006.
Literatura
3. Cotton F.A., Wilkinson G., Gaus P.L. Chemia nieorganiczna PWN, Warszawa 2002,
podstawowa
4. Jones L., Atkins P.: Chemia ogólna. Cząsteczki, materia, reakcje. Wyd. I. PWN, Warszawa
2004
5. Atkins Peter William: Chemia ogólna, PWN, 2006
Literatura
uzupełniająca
Przedmiotowe
efekty
kształcenia
P-W01
P-U01
P-K01
P-K02
Bilans nakładu
pracy studenta
Wskaźniki
ilościowe
Nr efektu
kształcenia
P-W01
P-U01
P-K01
P-K02
Data
opracowania
programu
6. Minczewski J., Marczenko Z.: Chemia analityczna. T.1. Podstawy teoretyczne i analiza
jakościowa. PWN, Warszawa 2012.
1. Skrypt do ćwiczeń z chemii ogólnej, nieorganicznej i analitycznej, Białystok 2010, pod
redakcją E. Skrzydlewskiej.
2. Cox P.A. Chemia nieorganiczna. Wyd. I PWN, Warszawa 2004
3. H. Puzanowska-Tarasiewicz, L. Kuźmicka, M. Tarasiewicz. Wstęp do chemii nieorganicznej
Wydawnictwo Uniwersytetu w Białymstoku, Białystok 2001
4. Galus Z. (red.): Ćwiczenia rachunkowe z chemii analitycznej. Wyd. 9. WNT, Warszawa, 2007.
5. Z. Warnke (red.): Obliczenia z chemii ogólnej, Wydawnictwo Uniwersytetu Gdańskiego,
Gdańsk, 2008
Odniesienie do
Efekty kształcenia
kierunkowych efektów
kształcenia
Rozumie relacje między strukturą związków chemicznych a reakcjami
K_W09
zachodzącymi w organizmie człowieka.
Potrafi posługiwać się odczynnikami chemicznymi, precyzyjnie ważyć i
mierzyć, sporządzać roztwory i mieszaniny, przeprowadzać obliczenia
K_U32, K_U33
chemiczne.
Rozumie potrzebę uczenia się przez całe życie, potrafi inspirować i
K_K01
organizować proces uczenia się.
Potrafi dbać o bezpieczeństwo własne, otoczenia i współpracowników.
K_K05
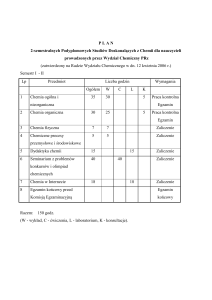
Godziny kontaktowe z nauczycielem akademickim:
udział w wykładach
7 x 97min
15h
udział w ćwiczeniach
9 x 5h
45h
udział w konsultacjach związanych z zajęciami
3 x 2h
6h
RAZEM
66h
Samodzielna praca studenta
przygotowanie do ćwiczeń
9 x 5h
45h
uzupełnienie sprawozdań
9 x 1h
9h
przygotowanie do kolokwiów
2 x 20h
40h
przygotowanie do egzaminu
1 x 40h
40h
RAZEM
134h
Ogółem
200h
ECTS
8
Nakład pracy studenta związany z zajęciami wymagającymi
bezpośredniego udziału nauczyciela
66h
ECTS
2
Nakład pracy studenta związany z zajęciami o charakterze
praktycznym [45h+6h+45h+9h+20h+10h]
135h
5
Metody weryfikacji efektu kształcenia
Formujące
Podsumowujące
wejściówka na ćwiczenia,
kolokwia, egzamin
zaliczenie ćwiczenia
obserwacja pracy studenta w trakcie ćwiczeń;
zaliczenie ćwiczenia
ocena wyciąganych wniosków z eksperymentów
ocena zdolności do samodzielnej pracy
zaliczenie ćwiczenia
obserwacja pracy studenta w trakcie ćwiczeń;
zaliczenie ćwiczenia
23.06.2016 r.
Program opracowała
prof. dr hab. Elżbieta Skrzydlewska