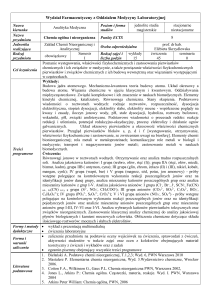
Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej
Nazwa
kierunku
Farmacja
Poziom i forma
studiów
jednolite studia
magisterskie
stacjonarne
niestacjonarne
Nazwa
przedmiotu
Chemia ogólna i
nieorganiczna
Jednostka
realizująca
Zakład Chemii Nieorganicznej i
Analitycznej
Rodzaj
przedmiotu
Semestr
wykłady
ćwiczenia
seminaria
Rodzaj zajęć i
I
60
90
0
liczba godzin
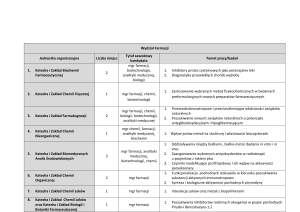
Poznanie występowania, właściwości fizykochemicznych i zastosowania pierwiastków
chemicznych i ich związków w medycynie, a także powiązanie właściwości fizykochemicznych
pierwiastków i związków chemicznych z ich budową wewnętrzną oraz wiązaniami występującymi
w cząsteczkach.
Wykłady:
Podstawowe pojęcia i prawa chemiczne. Budowa jądra atomowego. Promieniotwórczość
naturalna i sztuczna. Właściwości izotopów promieniotwórczych i ich wykorzystanie w
diagnostyce i terapii. Mechaniczno-kwantowa teoria budowy atomu, orbitale atomowe. Układ
okresowy a budowa atomu. Wiązania chemiczne w ujęciu klasycznym i kwantowym.
Oddziaływania międzycząsteczkowe. Elementy kinetyki chemicznej, katalizatory. Równowaga
chemiczna. Stany skupienia. Podstawowe wiadomości o roztworach wodnych: rodzaje roztworów,
rozpuszczalność, dysocjacja elektrolityczna, stopień dysocjacji, elektrolity słabe, elektrolity mocne
- współczesne poglądy na kwasy i zasady, iloczyn jonowy wody, pH, stałe dysocjacji, hydroliza,
roztwory buforowe, wskaźniki, pH, związki amfoteryczne. Związki kompleksowe: rodzaje
ligandów i kompleksów, typy związków kompleksowych nieorganicznych, izo- i heteropolikwasy,
kompleksy jonowo- asocjacyjne, kompleksy labilne i bierne, nomenklatura związków
kompleksowych, barwność związków kompleksowych, odczynniki organiczne stosowane w
analizie związków nieorganicznych. Związki kompleksowe w funkcjonowaniu organizmu
człowieka, wykorzystanie w farmacji i medycynie. Wiadomości o procesach redoks: reakcje
redukcji i utleniania, potencjał redukcyjno-oksydacyjny, procesy elektrolizy i działanie ogniw
galwanicznych.
Rys historyczny dotyczący odkryć pierwiastków i sformułowania prawa okresowości. Układ
okresowy aokresowość właściwości fizyko-chemicznych pierwiastków; powiązanie budowy
wewnętrznej pierwiastków z ich właściwościami. Przegląd poszczególnych grup pierwiastków (118) z omówieniem zmian właściwości fizycznych i chemicznych pierwiastków w obrębie grup.
Omówienie zagadnień dotyczących metali aktywnych chemicznie reprezentatywnych dla
poszczególnych grup – sodu z grupy litowców i magnezu z grupy berylowców, ze zwróceniem
uwagi na: występowanie w przyrodzie oraz w organizmie człowieka, właściwości fizyczne i
chemiczne metali i ich związków, zastosowanie metali oraz ich związków w gospodarce, w
medycynie oraz w farmacji. Omówienie występowania w przyrodzie oraz w organizmie
człowieka, właściwości fizycznych i chemicznych metali przejściowych i ich związków,
zastosowania tych metali oraz ich związków w gospodarce, w medycynie oraz w farmacji na
przykładzie metali reprezentatywnych poszczególnych grup metali przejściowych - skandu z
grupy skandanowców, manganu z grupy manganowców, wanadu z grupy wanadowców, chromu z
grupy chromowców, manganu z grupy manganowców, żelaza, paladu i platyny z triad
żelazowców i platynowców; porównanie właściwości miedzi, srebra i złota z grupy miedziowców
oraz cynku, kadmu i rtęci z grupy cynkowców. Omówienie właściwości fizykochemicznych grup:
lantanowców i aktynowców. Omówienie elementów chemii metaloorganicznej. Szczegółowe
omówienie występowania w przyrodzie oraz w organizmie człowieka, właściwości fizycznych i
chemicznych pierwiastków reprezentatywnych bloku p – glinu z grupy borowców, węgla i krzemu
z grupy węglowców, azotu i fosforu z grupy azotowców, tlenu i siarki z grupy tlenowców, chloru
z grupy fluorowców oraz ich związków i zastosowania w gospodarce, w medycynie oraz w
farmacji. Elementy chemii bionieorganicznej; znaczenie metali i niemetali w biologii i medycynie;
funkcje metali w procesach życiowych. Omówienie wykorzystania związków nieorganicznych w
farmacji.
Ćwiczenia:
Równowagi jonowe w roztworach wodnych. Otrzymywanie oraz analiza trudno rozpuszczalnych
soli. Analiza jakościowa kationów: I grupa (srebro, ołów, rtęć (I) ); grupa IIA (rtęć (II), ołów,
Celkształcenia
Treści
programowe
obowiązkowy
Punkty ECTS
Osoba odpowiedzialna
14
prof. dr hab.
Elżbieta Skrzydlewska
miedź, bizmut, kadm), grupa IIB (antymon, cyna); III grupa (glin, żelazo (II) i (III), nikiel, kobalt,
mangan, cynk); IV grupa (wapń, bar) i V grupa (magnez, sód, potas, jon amonowy) - próby
wstępne polegające na kontrolowanym wykonaniu reakcji poszczególnych jonów oraz na
identyfikacji jonów danej grupy, analiza mieszaniny kationów poszczególnych grup oraz analiza
mieszaniny kationów z grup I-V. Analiza jakościowa anionów: I grupa (Cl–, Br–, J-, SCN-,
Fe(CN)64-, Fe(CN)63-); II grupa (S2-, NO2-, CH3COO-); III grupa anionów (CO32-, SO32-, C2O42-,
BO2-, C4H4O62-); IV grupa (PO43-, S2O32-, CrO42-); V i VI grupa anionów (NO3-, SO4-2) - próby
wstępne polegające na kontrolowanym wykonaniu reakcji poszczególnych jonów oraz na
identyfikacji pojedynczych jonów oraz analizie mieszaniny anionów poszczególnych grup oraz
mieszaniny anionów grup I-III, IV-VI oraz I-VI. Analiza kationów z grupy mikroelementów,
wybranych kationów pierwiastków toksycznych oraz związków nieorganicznych; identyfikacja
pojedynczych związków w tym trudno rozpuszczalnych w wodzie. Analiza jakościowa
preparatów farmaceutycznych zawierających związki nieorganiczne – identyfikacja zawartych w
nich kationów i anionów. Obliczenia chemiczne dotyczące składu ilościowego roztworów:
mocnych i słabych elektrolitów.
Formy i metody wykłady z prezentacją multimedialną
dydaktyczne
ćwiczenia laboratoryjne
Forma zaliczenia – egzamin.
Warunki zaliczenia: zaliczenie przedmiotu na podstawie oceny wejściówek na ćwiczenia,
Forma i
sprawozdańz ćwiczeń, aktywności studentów w trakcie zajęć oraz ocen z kolokwiów
warunki
obejmujących materiał teoretyczny z ćwiczeń i wykładów,egzamin pisemny obejmujący wszystkie
zaliczenia
treści programowe.
1. Bielański A.: Podstawy chemii nieorganicznej, T.1,2,3; Wyd. 6, PWN Warszawa 2010
2. Mastalerz P.: Elementarna chemia nieorganiczna, Wyd. 3.Wydawnictwo chemiczne, Wrocław
2006
3. Cotton F.A., Wilkinson G., Gaus P.L.: Chemia nieorganiczna PWN, Warszawa 2002
Literatura
4. Jones L., Atkins P.: Chemia ogólna. Cząsteczki, materia, reakcje. Wyd.I. PWN, Warszawa
podstawowa
2004
5. Atkins Peter William: Chemia ogólna, PWN, 2006
6. Minczewski J., Marczenko Z.: Chemia analityczna. T.1. Podstawy teoretyczne i analiza
jakościowa. PWN, Warszawa 2012
1. Skrypt do ćwiczeń z chemii ogólnej, nieorganicznej i analitycznej, Białystok 2010, pod
redakcją E. Skrzydlewskiej
2. Cox P.A.: Chemia nieorganiczna. Wyd. I PWN, Warszawa 2004
3. Puzanowska-Tarasiewicz H., Kuźmicka L., Tarasiewicz M.:Wstęp do chemii
Literatura
nieorganicznejWydawnictwo Uniwersytetu w Białymstoku, Białystok 2001
uzupełniająca
4. Galus Z. (red.): Ćwiczenia rachunkowe z chemii analitycznej. Wyd. 9. WNT, Warszawa, 2007
5. Warnke Z. (red.): Obliczenia z chemii ogólnej, Wydawnictwo Uniwersytetu Gdańskiego,
Gdańsk, 2008
Przedmiotowe
Odniesienie do
efekty
Efekty kształcenia
kierunkowych efektów
kształcenia
kształcenia
Zna budowę atomu i cząsteczki, układu okresowego pierwiastków i
właściwości izotopów promieniotwórczych w aspekcie ich
wykorzystania w diagnostyce i terapii. Zna charakterystykę metali i
KB.W5, KB.W9,
P- W01
niemetali oraz nomenklaturę i właściwości związków nieorganicznych
KB.W11
i związków kompleksowych. Zna problematykę stosowania substancji
nieorganicznych w farmacji.
Zna mechanizmy tworzenia i rodzaje wiązań chemicznych oraz
P-W02
mechanizmy oddziaływań międzycząsteczkowych w różnych stanach
KB.W6
skupienia materii.
Zna rodzaje i właściwości roztworów. Zna metody identyfikacji
KB.W7, KB.W8
P-W03
substancji nieorganicznych. Definiuje i objaśniaprocesy utleniania i
KB.W10
redukcji.
Opisuje właściwości chemiczne pierwiastków i związków
P-U01
nieorganicznych, ocenia trwałość wiązań oraz reaktywność związków
KB.U4
nieorganicznych na podstawie ich budowy.
P-U02
Identyfikuje substancje nieorganiczne.
KB.U5
P-U03
P-K01
Bilans nakładu
pracy studenta
Wskaźniki
ilościowe
Wykorzystuje wiedzę o właściwościach substancji nieorganicznych w
farmacji.
Wyciąga i formułuje wnioski z własnych pomiarów i obserwacji.
Godziny kontaktowe z nauczycielem akademickim:
udział w wykładach
udział w ćwiczeniach
udział w konsultacjach związanych z zajęciami
Samodzielna praca studenta:
przygotowanie do ćwiczeń
uzupełnienie sprawozdań z ćwiczeń
przygotowanie do kolokwiów
przygotowanie do egzaminu
Nakład pracy studenta związany z zajęciami wymagającymi
bezpośredniego udziału nauczyciela.
Nakład pracy studenta związany z zajęciami o charakterze
praktycznym.
KB.K2
28 x 2.14h
14 x289min
6 x 1h
Razem
60h
90h
6h
156h
14 x 7h
12 x 3h
2 x 10h
1 x 40h
Razem
Ogółem
ECTS
98h
36h
20h
40h
194h
350h
14
ECTS
6
156h
240h
9
Metody weryfikacji efektu kształcenia
Nr efektu
kształcenia
P- W01
P-W02
P-W03
P-U01
P-U02
P-U03
P-K01
Data
opracowania
programu
KB.U6
Formujące
wejściówka na ćwiczenia,
wejściówka na ćwiczenia,
wejściówka na ćwiczenia
wejściówka na ćwiczenia, zaliczenie praktyczne zajęć
obserwacja i ocena pracy studenta w trakcie zajęć
obserwacja i ocena pracy studenta w trakcie zajęć
obserwacja pracy studenta w trakcie zajęć
22.06.2016 r.
Program opracowała
Podsumowujące
kolokwia, egzamin
kolokwia, egzamin
kolokwia, egzamin
kolokwia, egzamin
zaliczenie ćwiczenia
zaliczenie ćwiczenia
zaliczenie ćwiczenia
prof. dr hab. Elżbieta Skrzydlewska