Chemia kwantowa #13.3.0182
Sylabusy - Ośrodek Informatyczny UG
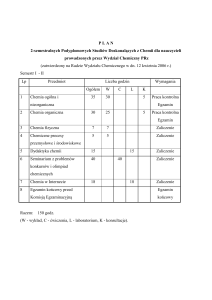
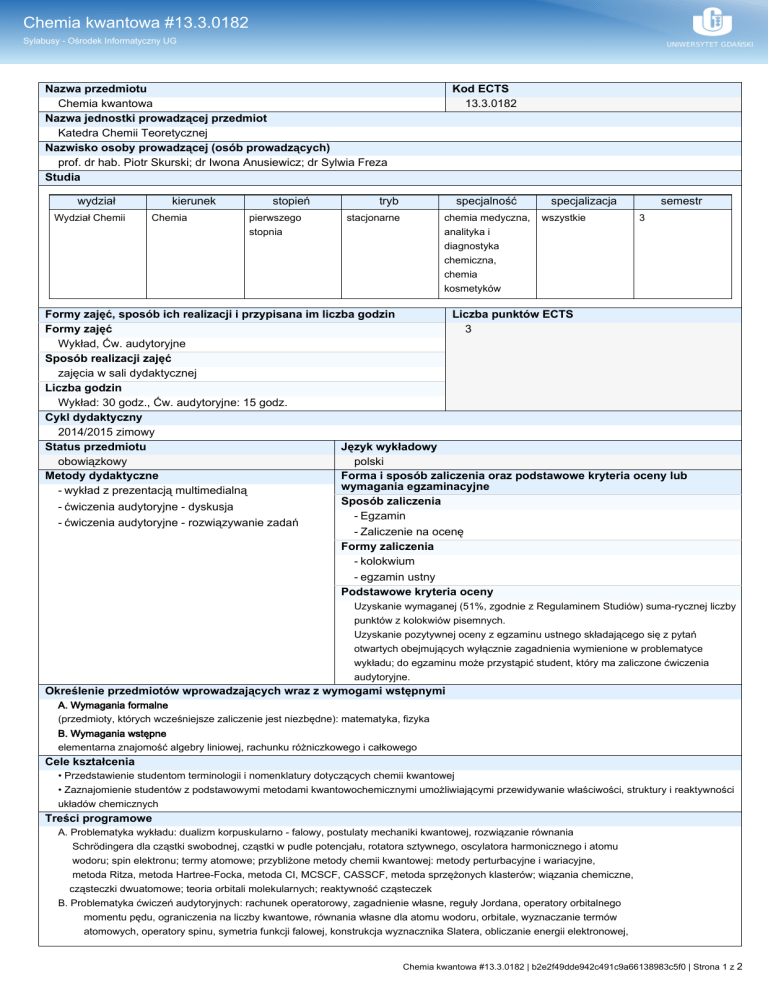
Nazwa przedmiotu
Chemia kwantowa
Nazwa jednostki prowadzącej przedmiot
Katedra Chemii Teoretycznej
Nazwisko osoby prowadzącej (osób prowadzących)
prof. dr hab. Piotr Skurski; dr Iwona Anusiewicz; dr Sylwia Freza
Studia
wydział
Wydział Chemii
kierunek
Chemia
stopień
pierwszego
stopnia
Kod ECTS
13.3.0182
tryb
specjalność
stacjonarne
chemia medyczna,
analityka i
diagnostyka
chemiczna,
chemia
kosmetyków
specjalizacja
wszystkie
semestr
3
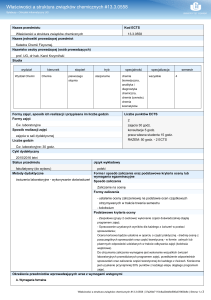
Formy zajęć, sposób ich realizacji i przypisana im liczba godzin
Liczba punktów ECTS
Formy zajęć
3
Wykład, Ćw. audytoryjne
Sposób realizacji zajęć
zajęcia w sali dydaktycznej
Liczba godzin
Wykład: 30 godz., Ćw. audytoryjne: 15 godz.
Cykl dydaktyczny
2014/2015 zimowy
Status przedmiotu
Język wykładowy
obowiązkowy
polski
Metody dydaktyczne
Forma i sposób zaliczenia oraz podstawowe kryteria oceny lub
wymagania egzaminacyjne
- wykład z prezentacją multimedialną
Sposób zaliczenia
- ćwiczenia audytoryjne - dyskusja
- Egzamin
- ćwiczenia audytoryjne - rozwiązywanie zadań
- Zaliczenie na ocenę
Formy zaliczenia
- kolokwium
- egzamin ustny
Podstawowe kryteria oceny
Uzyskanie wymaganej (51%, zgodnie z Regulaminem Studiów) suma-rycznej liczby
punktów z kolokwiów pisemnych.
Uzyskanie pozytywnej oceny z egzaminu ustnego składającego się z pytań
otwartych obejmujących wyłącznie zagadnienia wymienione w problematyce
wykładu; do egzaminu może przystąpić student, który ma zaliczone ćwiczenia
audytoryjne.
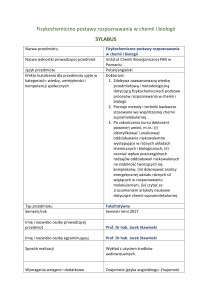
Określenie przedmiotów wprowadzających wraz z wymogami wstępnymi
A. Wymagania formalne
(przedmioty, których wcześniejsze zaliczenie jest niezbędne): matematyka, fizyka
B. Wymagania wstępne
elementarna znajomość algebry liniowej, rachunku różniczkowego i całkowego
Cele kształcenia
• Przedstawienie studentom terminologii i nomenklatury dotyczących chemii kwantowej
• Zaznajomienie studentów z podstawowymi metodami kwantowochemicznymi umożliwiającymi przewidywanie właściwości, struktury i reaktywności
układów chemicznych
Treści programowe
A. Problematyka wykładu: dualizm korpuskularno - falowy, postulaty mechaniki kwantowej, rozwiązanie równania
Schrödingera dla cząstki swobodnej, cząstki w pudle potencjału, rotatora sztywnego, oscylatora harmonicznego i atomu
wodoru; spin elektronu; termy atomowe; przybliżone metody chemii kwantowej: metody perturbacyjne i wariacyjne,
metoda Ritza, metoda Hartree-Focka, metoda CI, MCSCF, CASSCF, metoda sprzężonych klasterów; wiązania chemiczne,
cząsteczki dwuatomowe; teoria orbitali molekularnych; reaktywność cząsteczek
B. Problematyka ćwiczeń audytoryjnych: rachunek operatorowy, zagadnienie własne, reguły Jordana, operatory orbitalnego
momentu pędu, ograniczenia na liczby kwantowe, równania własne dla atomu wodoru, orbitale, wyznaczanie termów
atomowych, operatory spinu, symetria funkcji falowej, konstrukcja wyznacznika Slatera, obliczanie energii elektronowej,
Chemia kwantowa #13.3.0182 | b2e2f49dde942c491c9a66138983c5f0 | Strona 1 z 2
Chemia kwantowa #13.3.0182
Sylabusy - Ośrodek Informatyczny UG
wyznaczanie gęstości π-elektronowych i rzędów wiązań metodą Hückla
Wykaz literatury
A. Literatura wymagana do ostatecznego zaliczenia zajęć (zdania egzaminu):
A.1. wykorzystywana podczas zajęć: Włodzimierz Kołos „Chemia kwantowa”
A.2. studiowana samodzielnie przez studenta : Włodzimierz Kołos „Chemia kwantowa”, Alojzy Gołębiewski „Elementy mechaniki i chemii kwantowej”
B. Literatura uzupełniająca
Lucjan Piela „Idee chemii kwantowej”
P.W. Atkins „Molekularna mechanika kwantowa”
Efekty uczenia się
Wiedza
K_W01: wymienia podstawowe prawa i teorie z zakresu
formułuje postulaty mechaniki kwantowej, wyjaśnia proste zastosowania chemii
chemii, fizyki, matematyki i biologii;
kwantowej, identyfikuje symetrię funkcji falowej, rozróżnia multipletowość stanów
K_W06: wybiera techniki matematyki wyższej w zakresie
elektronowych, charakteryzuje podstawowe przybliżenia stosowane w chemii
niezbędnym dla zrozumienia i opisu procesów chemicznych
kwantowej, wyjaśnia efekt tunelo-wy, opisuje powierzchnie graniczne orbitali,
oraz procesów fizycznych ważnych dla zrozumienia chemii;
formułuje zakaz Pauliego i regułę Hunda, charaktery-zuje wartości średnie
K_W07: rozumie oraz opisuje prawidłowości, zjawiska i
hamiltonianu i przemiennych z nim operatorów dla prostych układów, wy-mienia
procesy fizykochemiczne wykorzystując język matematyki;
podstawowe metody chemii kwantowej
K_W08: wykazuje się znajomością podstawowych metod
Umiejętności
rozwiązuje równania własne z operatorami obserwabli, przewiduje mierzalność
obliczeniowych do rozwiązywania problemów z zakresu
wielkości fizycznych, szacuje prawdopodobieństwo znalezienia elektronu w
chemii, fizyki i matematyki;
określonym obszarze, konstruuje wyznacznikową funkcję falową, oblicza energię
K_U01: identyfikuje, analizuje i rozwiązuje problemy z
elektronową molekuł, planuje właści-wy dobór metody obliczeniowej
zakresu szeroko pojętej chemii w oparciu o zdobytą wiedzę;
K_U08: przedstawia w sposób przystępny, językiem
Kompetencje społeczne (postawy)
rozumie potrzebę dalszego kształcenia się, zachowuje ostrożność i krytycyzm w
naukowym typowym dla nauk chemicznych podstawowe
wyrażaniu opinii, wykazuje otwartość na nowatorskie koncepcje
fakty z chemii;
K_U09: umie uczyć się samodzielnie;
Kontakt
[email protected]
Chemia kwantowa #13.3.0182 | b2e2f49dde942c491c9a66138983c5f0 | Strona 2 z 2