Druk DNiSS nr 11D
SYLABUS
NAZWA PRZEDMIOTU:.......Chemia ogólna i analityczna - General and Analytical Chemistry
Kod przedmiotu:……………………………………………………………………………….
Rodzaj przedmiotu: podstawowy/kierunkowy/ogólny/specjaln.*; obowiązkowy/obieralny*
Wydział:………Nauk o Materiałach i Środowisku………………………………………………………………
Kierunek:......Ochrona Środowiska….....................................................................……………
Specjalność:...........................................................................................................................................................
Specjalizacja (w przypadku kierunku: filologia):.................................................................................
Poziom studiów: pierwszego stopnia / drugiego stopnia *
System studiów: stacjonarne / wieczorowe / zaoczne *
Rok:....1.........Semestr:..........1.............
Formy zajęć i liczba godzin: wykłady –18; ćw. audytoryjne -9,
Język/i, w którym/ch realizowane są zajęcia:……język polski
Liczba punktów ECTS: 6
Osoby prowadzące:
wykład: dr inż. Beata Fryczkowska
ćwiczenia audytoryjne dr inż. Beata Fryczkowska
1. Założenia i cele przedmiotu, w tym zakładane efekty kształcenia zdefiniowane w
kategoriach wiedzy, umiejętności i innych kompetencji:
W trakcie wykładu student rozszerzy posiadane wiadomości z zakresu budowy materii,
układu okresowego, klasyfikacji związków chemicznych, typów wiązań i reakcji
chemicznych, reakcji w roztworach. Zapozna się z chemią związków kompleksowych. Na tej
podbudowie przybliżone mu zostaną zagadnienia z chemii analitycznej (identyfikacja
związków, ilościowa ich analiza) oraz elektrochemii
W trakcie ćwiczeń audytoryjnych student pogłębia wiedzę ze znajomości okresowości
własciwości pierwiastków, sposobu zapisu związków, ich nomenklatury, opisu drogi reakcji
chemicznych i różnego typu obliczeń chemicznych, które stanowią niezbędne przygotowanie
do ćwiczń laboratoryjnych z tego przedmiotu.
2. Określenie przedmiotów wprowadzających wraz z wymaganiami wstępnymi:
brak.
1
3. Opis form zajęć
a) Wykłady
Treści programowe (tematyka zajęć)
Budowa materii. Układ okresowy pierwiastków (2 godz). Klasyfikacja i nomenklatura
związków niorganicznych (2 godz). Typy wiązań chemicznych. Związki kompleksowe;
rodzaje i struktura kompleksów (2 godz). Podział reakcji chemicznych (synteza, analiza,
wymiana, redoks, reakcje dysproporcjonowania) (2 godz). Roztwory. Rodzaje stężeń.
Dysocjacja. Hydroliza. Rozpuszczalność i iloczyn rozpuszczalności (2 godz). Moc kwasów i
zasad. Odczyn środowiska-pH. Roztwory buforowe (2 godz). Analiza jakościowa
pierwiastków (1 godz). Analiza ilościowa. Metody miareczkowe w chemii analitycznej.
Alkacymetria (2 godz). Analiza instrunmentalna (1 godz). Elementy elektrochemii. Szereg
napięciowy metali. Elektroliza. Korozja i pasywacja (2 godz).
Metody dydaktyczne:
W trakcie wykładu studentowi zastają przekazane usystematyzowane informacje na temat
podstaw chemii oraz metod analitycznych stosowanych w chemii.
Metody ewaluacji wiedzy, umiejętności i innych kompetencji:
W trakcie wykładu na bazie wiadomości ze szkoły średniej zostaną rozszerzone wiadomości
dotyczące chemii ogólnej oraz omówione podstawy elektrochemii i chemii analitycznej
(jakościowej, ilościowej i instrumentalnej). Przewidywany jest krótki test sprawdzający
wiedzę na początku i po zakończeniu wykładu.
Forma i warunki zaliczenia:
Warunkiem
zaliczenia
przedmiotu
jest
egzamin
pisemny
z
zakresu
materiału
zaprezentowanego na wykładach.
Wykaz literatury podstawowej i uzupełniającej (maksymalnie 5 pozycji w każdej grupie):
1. B. Jasińska; Chemia ogólna
2. M. J. Sienko, R. Plane; chemia-podstawy i zastosowania
3. L. Pajdowski; Chemia ogólna
4. J. Minczewski, Z. Marczenko; Chemia analityczna
5. A. F. Cotton; Chemia nieorganiczna
2
b) Ćwiczenia audytoryjne
Treści programowe (tematyka zajęć)
Zasady pisania wzorów chemicznych. Nomenklatura związków nieorganicznych oraz
związków kompleksowych (2 godz). Zasady pisania reakcji chemicznych. Typowe reakcje
redoks oraz reakcje dysproporcjonowania (2 godz). Obliczanie i przeliczanie stężeń
roztworów (2 godz). Hydroliza i dysocjacja. Obliczanie pH. Pojemność buforu (2 godz).
Reakcje elektrodowe (1 godz).
Metody dydaktyczne:
W trakcie ćwiczeń audytoryjnych student zapozna się ze skomplikowanymi związkami
chemicznymi, nauczy sposobu ich zapisu i systematycznej nomenklatury. Ponadto będzie
samodzielnie wykonywał obliczenia z zakresu stężeń, mieszania roztworów, pH, reakcji w
roztworach wodnych oraz reakcji elektrodowych.
Metody ewaluacji wiedzy, umiejętności i innych kompetencji:
Na bazie wcześniej nabytych wiadomości oraz treści wykładów z chemii ogólnej i
analitycznej student rozszerzy w praktyce swoje wiadomości dotyczące pełnego zapisu
wzorów chmicznych, reakcji chemicznych oraz obliczeń chemicznych.
Forma i warunki zaliczenia:
Warunkiem zaliczenia przedmiotu jest wykazanie się studenta wiedzą z zakresu
prowadzonych ćwiczeń audytoryjnych i poprawne napisanie kolokwium.
Wykaz literatury podstawowej i uzupełniającej (maksymalnie 5 pozycji w każdej grupie):
1. B. Jasińska; Chemia ogólna
2. M. J. Sienko, R. Plane; chemia-podstawy i zastosowania
3. J. Ciba; Obliczenia chemiczne
4. M. Bodzek, J. Cebula; Materiały pomocnicze do ćwiczeń tablicowych z chemii dla
kierunku inżynieria środowiska
3
Druk DNiSS nr 11D
SYLABUS
NAZWA PRZEDMIOTU:.......Chemia ogólna i analityczna - General and Analytical Chemistry
Kod przedmiotu:……………………………………………………………………………….
Rodzaj przedmiotu: podstawowy/kierunkowy/ogólny/specjaln.*; obowiązkowy/obieralny*
Wydział:………Nauk o Materiałach i Środowisku………………………………………………………………
Kierunek:......Ochrona Środowiska….....................................................................……………
Specjalność:...........................................................................................................................................................
Specjalizacja (w przypadku kierunku: filologia):.................................................................................
Poziom studiów: pierwszego stopnia / drugiego stopnia *
System studiów: stacjonarne / wieczorowe / zaoczne *
Rok:....1.........Semestr:..........2............
Formy zajęć i liczba godzin: wykłady – ……; ćwiczenia laboratoryjne - ...18....
Język/i, w którym/ch realizowane są zajęcia:……język polski
Liczba punktów ECTS: 1
Osoby prowadzące:
ćwiczenia laboratoryjne: dr inż. Beata Fryczkowska, dr inż. Włodzimierz Biniaś
1. Opis form zajęć
a) Ćwiczenia laboratoryjne
Treści programowe (tematyka zajęć)
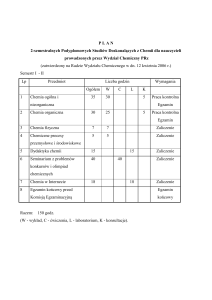
Ćwiczenie 1a. Kationy (ślepe próby); Ćwiczenie 1b. Kationy (analiza); Ćwiczenie 2a.
Alkacymetria (wyznaczanie miana HCl).; Ćwiczenie 2b. Alkacymetria (oznaczenie NaOH w
próbce).; Ćwiczenie 3a. Kompleksy (synteza kompleksu).; Ćwiczenie 3b. Kompleksy (pomiar
przewodnictwa roztworu). ; Ćwiczenie 4a. Spektrofotometria (krzywa wzorcowa)
Ćwiczenie 4b. Spektrofotometria (oznaczenie Fe3+); Ćwiczenie 5. Elektroliza; Ćwiczenie
6. Chromatografia.
Forma i warunki zaliczenia: zaliczenie
Wykaz literatury podstawowej i uzupełniającej (maksymalnie 5 pozycji w każdej grupie):
1. I Baranowska, A. Pielesz, M. Wyszomirski., „Chemia ogólna”, Bielsko-Biała
1996.
4
2.
I Baranowska, A. Pielesz, U. Ostrowska-Prus, W. Prus, "Chemia analityczna z
elementami analizy instrumentalnej", Wydawnictwo P. Ł. Filii w Bielsku-Białej,
wydanie II (poprawione), Bielsko-Biała 1999
5