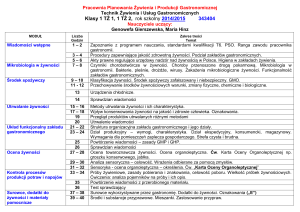
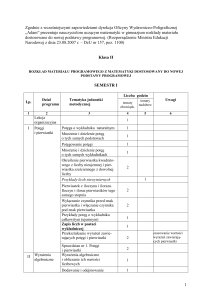
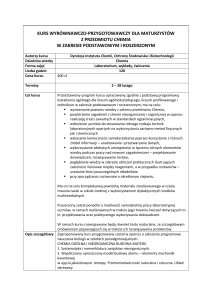
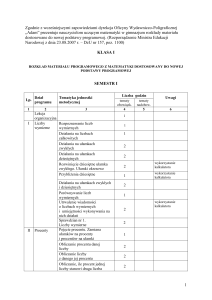
Rozkład materiału z chemii dla liceum ogólnokształcącego
(4godz. w cyklu nauczania: 2 godz. w kl. I i 2 godz. w kl. II).
Dział 1: Budowa atomu. Wiązania chemiczne.
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
Lekcja organizacyjna. Zapoznanie z programem nauczania i kryteriami oceniania.
Zasady bezpiecznej pracy w szkolnym laboratorium chemicznym.
Rozwój poglądów na budowę materii. Budowa atomu.
Budowa jądra atomowego. Izotopy.
Przemiany promieniotwórcze.
Blaski i cienie promieniotwórczości.
Pozajądrowa budowa atomu. Konfiguracja elektronów w atomach.
Struktura elektronowa atomu.
Układ okresowy pierwiastków a budowa atomów.
Masa atomowa i cząsteczkowa.
Lekcja powtórzeniowa.
Pisemny sprawdzian wiadomości.
Próby klasyfikacji pierwiastków chemicznych.
Współczesny układ okresowy pierwiastków.
Wiązania chemiczne. Reguła dubletu i oktetu.
Elektroujemność.
Wiązanie jonowe.
Wiązanie kowalencyjne i kowalencyjne spolaryzowane.
Wiązanie wodorowe.
Wiązanie metaliczne.
Właściwości związków a typy wiązań chemicznych.
Lekcja powtórzeniowa.
Pisemny sprawdzian wiadomości.
Dział 2: Reakcje chemiczne. Podstawy obliczeń chemicznych.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
Zjawiska fizyczne i chemiczne.
Typy reakcji chemicznych.
Szybkość rekcji chemicznych.
Stopnie utlenienia pierwiastków.
Reakcje utleniania i redukcji.
Elektronowa interpretacja reakcji utleniania – redukcji.
Utleniacze i reduktory. Praktyczne zastosowanie reakcji utleniania – redukcji.
Powtórzenie wiadomości.
Sprawdzian wiadomości.
Mol i masa molowa.
Prawo zachowania masy.
Prawo stałości składu związku chemicznego.
1
36.
37.
38.
40.
41.
42.
43.
Prawa gazowe: Prawo Avogadra i prawo Gay – Lussaca.
Prawa ilościowe w chemii – zadania.
Obliczenia stechiometryczne (2 godz.).
Wagowy stosunek stechiometryczny reagentów.
Objętościowy stosunek stechiometryczny reagentów.
Powtórzenie wiadomości.
Pisemny sprawdzian wiadomości.
Dział 3: Roztwory.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
Rodzaje mieszanin i sposoby ich rozdzielania.
Roztwory, koloidy i zawiesiny.
Proces rozpuszczania i krystalizacji.
Obliczenia dotyczące rozpuszczalności.
Stężenie procentowe roztworu.
Stężenie molowe roztworu.
Przeliczanie stężeń roztworów.
Sporządzanie roztworów. Mieszanie roztworów.
Rozcieńczanie i zatężanie roztworów.
Sposoby wyrażania stężeń roztworów – rozwiązywanie zadań.
Pisemny sprawdzian wiadomości.
Dział 4: Klasyfikacja związków nieorganicznych. Reakcje w roztworach wodnych.
55.
56.
57.
58.
59.
60.
62.
64.
66.
67.
68.
69.
71.
72.
73.
74.
75.
76.
77.
78.
79.
Tlenki – budowa, wzory, nomenklatura i metody otrzymywania.
Właściwości fizyczne i chemiczne tlenków.
Tlenki kwasowe, zasadowe i amfoteryczne.
Nadtlenki i wodorki.
Wodorotlenki - budowa, wzory, nomenklatura i metody otrzymywania.
Kwasy - budowa, wzory, nomenklatura, podział i metody otrzymywania (2 godz.).
Sole – budowa, wzory, nazewnictwo (2 godz.).
Otrzymywanie soli (2 godz.).
Lekcja powtórzeniowa.
Sprawdzian wiadomości.
Dysocjacja elektrolityczna.
Kwasy, zasady i sole według teorii Arrheniusa (2 godz.).
Stopień dysocjacji.
Odczyn roztworów wodnych.
Reakcje zobojętniania.
Reakcje strącania osadów.
Charakter chemiczny tlenków metali i tlenków niemetali.
Reakcje hydrolizy soli.
Obliczenia dotyczące stopnia dysocjacji i pH – roztworu.
Reakcje w roztworach wodnych – powtórzenie.
Powtórzenie wiadomości.
2
80. Sprawdzian wiadomości.
Dział 5: Elementy chemii nieorganicznej. Właściwości wybranych pierwiastków i związków
chemicznych.
81.
82.
83.
84.
85.
Metale i niemetale.
Tlen – najpopularniejszy pierwiastek na Ziemi.
Charakterystyka wodoru i jego związków.
Woda – najpopularniejszy związek chemiczny.
Charakterystyka litowców – występowanie w przyrodzie, budowa atomów, właściwości
fizyczne i aktywność chemiczna, zastosowanie.
86. Właściwości sodu i potasu.
87. Charakterystyka berylowców – Właściwości magnezu i wapnia.
88. Co wiemy o metalach? Właściwości wybranych metali (glinu, żelaza, cynku, ołowiu, miedzi,
srebra i złota). Zastosowanie metali (4 godz.).
92. Charakterystyka fluorowców – występowanie, właściwości fizyczne i chemiczne, znaczenie
i zastosowanie (2 godz.).
94. Właściwości wybranych niemetali (siarki, azotu, krzemu, fosforu), (3 godz.).
97. Węgiel w przyrodzie. Alotropowe odmiany węgla.
98. Nieorganiczne związki węgla. Związki węgla z tlenem.
99. Węglany – sole kwasu węglowego.
100. Otrzymywanie metali w przemyśle.
101. Tworzywa pochodzenia mineralnego.
102. Ważne produkty przemysłu chemicznego.
103. Powtórzenie wiadomości.
104. Sprawdzian wiadomości.
Dział 6: Chemia organiczna. Węglowodory.
105. Chemia organiczna jako chemia związków węgla.
106. Budowa cząsteczek związków organicznych – teoria strukturalna.
107. Skład pierwiastkowy związków organicznych.
108. Węglowodory nasycone – alkany. Budowa i nazewnictwo alkanów, szereg homologiczny.
109. Otrzymywanie i właściwości fizyczne alkanów.
110. Chemiczne właściwości alkanów.
111. Izomeria alkanów.
112. I zomeria alkanów i halogenoalkanów.
113. Węglowodory nienasycone – alkeny. Budowa i otrzymywanie.
114. Właściwości fizyczne i chemiczne alkenów.
115. Węglowodory nienasycone – alkiny. Budowa, otrzymywanie, właściwości fizyczne
i chemiczne na przykładzie acetylenu.
116. Izomeria węglowodorów nienasyconych (2 godz.).
118. Węglowodory nasycone i nienasycone – utrwalenie wiadomości.
119.
Węglowodory cykloalifatyczne.
120. Węglowodory aromatyczne (2 godz.).
3
122.
123.
124.
Węglowodory w przyrodzie.
Lekcja powtórzeniowa.
Sprawdzian wiadomości.
Dział 7: Pochodne węglowodorów.
125.
126.
127.
128.
129.
130.
131.
132.
133.
134.
136.
137.
138.
139.
140.
141.
142.
143.
144.
145.
146.
147.
148.
149.
150.
151.
152.
154.
156.
158.
159.
160.
Halogenowęglowodory
Alkohole jednowodorotlenowe.
Alkohole wielowodorotlenowe.
Porównanie właściwości alkoholi jednowodorotlenowych i wielowodorotlenowych.
Fenole.
Powtórzenie wiadomości.
Sprawdzian.
Aldehydy.
Ketony.
Właściwości fizyczne i chemiczne kwasów karboksylowych (2 godz.).
Sole kwasów karboksylowych.
Mydła.
Estry.
Budowa i właściwości amin.
Powtórzenie wiadomości.
Sprawdzian wiadomości.
Wielofunkcyjne pochodne węglowodorów - aminokwasy.
Białka – właściwości fizyczne i chemiczne.
Białka – struktura przestrzenna i funkcje biologiczne.
Cukry proste.
Dwucukry.
Wielocukry.
Hydroksykwasy.
Powtórzenie wiadomości.
Sprawdzian wiadomości.
Chemia w naszym życiu.
Podstawowe surowce i produkty przemysłu chemicznego (2 godz.).
Tworzywa sztuczne (2 godz.).
Chemia w służbie medycyny (2 godz.).
Środki uzależniające (2 godz.).
Działalność człowieka a środowisko przyrodnicze.
Substancje niebezpieczne w życiu codziennym.
4