PRACE POGLĄDOWE
Małgorzata Kołodziej1
Kamil Zaleski1
Magdalena Majewska2
Agnieszka Górska1
Ewelina Kwiecień-Obara1
Jarosław Szponar1
Uszkodzenie serca w przebiegu zatrucia
tlenkiem węgla - zastosowanie badań
obrazowych
Heart injury secondary to carbon monoxide poisoning
- the use of imaging techniques
Wojewódzki Szpital Specjalistyczny
im. Stefana Kardynała Wyszyńskiego
Samodzielny Publiczny Zakład Opieki
Zdrowotnej w Lublinie
Oddział Toksykologiczno-Kardiologiczny
Kierownik:
Dr n. med. Jarosław Szponar
1
Samodzielny Publiczny Szpital Wojewódzki
im. Jana Bożego w Lublinie
Oddział Internistyczny
Ordynator:
Dr n. med. Hanna Lewandowska-Stanek
2
Dodatkowe słowa kluczowe:
zatrucie tlenkiem węgla
uszkodzenie mięśnia sercowego
badania obrazowe
Additional key words:
carbon monoxide poisoning
myocardial injury
imaging techniques
Adres do korespondencji:
Dr n. med. Jarosław Szponar
W.S.S. im. Stefana Kardynała Wyszyńskiego
SPZOZ w Lublinie
20-718 Lublin, Al. Kraśnicka 100
Tel.: 81 537 40 80
e-mail: [email protected]
Przegląd Lekarski 2013 / 70 / 8
Mięsień sercowy jest szczególnie
wrażliwy na toksyczne działanie tlenku
węgla. Powikłania sercowo-naczyniowe dotyczą 30-40% zatrutych. Obecnie
złotym standardem w diagnostyce
uszkodzenia serca jest kilkukrotne
wykonywanie zapisu EKG oraz przynajmniej dwukrotne oznaczenie stężeń
markerów sercowych (głównie troponiny I), zwłaszcza w przypadku zatruć
o przebiegu średnim i ciężkim. Do tej
pory nie powstały zalecenia odnośnie
kolejnych kroków diagnostycznych w
przypadku stwierdzenia nieprawidłowości w wspomnianych badaniach.
W pracy przedstawiono przegląd
aktualnie dostępnym metod obrazowania oraz analizę ich przydatności
w ocenie uszkodzenia serca w zatruciu tlenkiem węgla. Według autorów
szczególnie ważnym badaniem jest
echokardiografia, która dzięki swojej
dostępności oraz nieiwazyjności powinna być wykonywana u wszystkich
chorych z podejrzeniem uszkodzenia
miokardium, wysuniętym na podstawie
obrazu klinicznego, zapisów EKG czy
markerów biochemicznych.
The heart muscle is particularly
sensitive to the toxic effects of carbon
monoxide. Cardiovascular complications are present in 30-40% poisoned
patients. Currently, multiple ECG
records and at least two-time determination of cardiac markers’ concentration (mainly troponin I) are known
as the gold standard practice in the
diagnosis of cardiac injury especially
with regard to medium and severe
poisoning. So far there have not been
any recommendations for further diagnostic steps in case of abnormalities
in these examinations.
This paper presents a review of
cardiac imaging techniques as well
as the analysis of their usefulness in
carbon monoxide poisoning. According to the authors echocardiography
is considered to be an extremely
important examination which, thanks
to its accessibility and non-invasive
nature, should be performed on all
patients with myocardium injury suspicion made on the basis of clinical
image, ECG records and biochemical
markers.
Wstęp
Tlenek węgla (CO) jest bezbarwnym,
bezwonnym, łatwopalnym i wybuchowym
gazem trudno rozpuszczalnym w wodzie.
Nie drażni dróg oddechowych. Nazywany
jest „milczącym mordercą”, ponieważ jest
niewykrywalny przez zmysły człowieka. Powstaje w wyniku niepełnego spalania związków węgla zawartych w gazie ziemnym przy
niedostatecznym dopływie tlenu.
Do zatruć tlenkiem węgla najczęściej
dochodzi przypadkowo, przy niesprawnie
działającej instalacji grzewczej lub wentylacji, a także poprzez narażenie na spaliny
samochodowe. Zatrucia cechuje sezonowość występowania. Większość zatruć w
Polsce ma miejsce w sezonie grzewczym
(październik-marzec). Zdarzają się także
przypadki celowych zatruć tlenkiem węgla
(samobójstwa, w tym także zbiorowe, zabójstwa).
Toksyczne działanie CO wynika ze
zdolności do tworzenia trwałych połączeń z
metaloproteinami. Do wiązania tlenku węgla
z hemoglobiną dochodzi już przy niewielkim
jego stężeniu we wdychanym powietrzu. CO
wiąże się z hemoglobiną z 220-300 razy
większym powinowactwem niż tlen, tworząc
hemoglobinę tlenkowęglową (COHb) [17].
Połączenie CO z jednym miejscem hemowym hemoglobiny powoduje, że wiązania
pozostałych grup hemowych z tlenem są
trwalsze, a także zmienia się budowa konformacyjna cząsteczki hemoglobiny. Krzywa
dysocjacji hemoglobiny przesuwa się w
lewo, oddawanie tlenu komórkom i tkankom
staje się znacznie utrudnione, dochodzi do
hipoksji tkankowej.
Zmniejszona ilość tlenu dostarczanego do komórek prowadzi do zwiększenia
wentylacji i zwiększonego pobierania CO,
zasadowicy oddechowej, a w konsekwencji
dalszego przesunięcia w lewo krzywej dysocjacji hemoglobiny utlenowanej. Nasila się
hipoksja, dochodzi do uszkodzenia tkanek i
narządów, zwłaszcza tych najbardziej wrażliwych na niedotlenienie, czyli ośrodkowego
układu nerwowego oraz układu sercowonaczyniowego.
Tlenek węgla wiąże się kompetycyjnie również z innymi białkami, takimi jak
mioglobina, oksydaza cytochromu P-450,
623
oksydaza cytochromu C, cykloza guanylowa, synteza tlenku węgla, wypierając z nich
cząsteczki tlenu.
Mioglobina pełni w organizmie funkcję
krótkotrwałego rezerwuaru tlenowego.
U pacjentów z niewydolnością serca czy
kardiomiopatią zastoinową, u których obserwuje się spadek ilości mioglobiny w sercu,
powstawanie karboksymioglobiny znacznie
nasila hipoksję, upośledzając funkcję komórek miokardium.
Blokowanie oksydazy cytochromowej
zaburza oddychanie wewnątrzkomórkowe,
co powoduje m.in. wzrost metabolizmu beztlenowego, pogłębienie niedotlenienia, przyczynia się do rozwoju kwasicy mleczanowej,
może prowadzić do apoptozy komórki.
Należy pamiętać również o prozakrzepowym działaniu tlenku węgla. Zwiększone
ryzyko powikłań zakrzepowo-zatorowych
występuje zwłaszcza u osób z dodatkowymi
czynnikami ryzyka zakrzepicy. U osób z
chorobą niedokrwienną serca może dojść
do zakrzepicy w zwężonej tętnicy wieńcowej
lub w stencie [17,22].
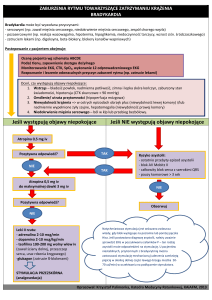
Objawy zatrucia zależą od stężenia
tlenku węgla w powietrzu, czasu ekspozycji,
a także aktywności fizycznej, która wpływa
na wielkość wentylacji minutowej. Nie ma
ścisłej zależności pomiędzy stwierdzonym
odsetkiem hemoglobiny tlenkowęglowej
a objawami, przebiegiem i powikłaniami
zatrucia. W średnich i ciężkich zatruciach
CO bardzo często pojawiają się objawy ze
strony układu krążenia. Najbardziej narażone są m.in. dzieci, osoby starsze oraz
obciążone współistniejącymi chorobami
zmniejszającymi rezerwę tlenową organizmu (choroby układu krążeniowo-oddechowego, niedokrwistości), a także kobiety
w ciąży. Powikłania sercowo-naczyniowe
dotyczą 30-40% zatrutych tlenkiem węgla.
Również u osób młodych, bez rozpoznanych
obciążeń kardiologicznych, może dojść do
groźnych zaburzeń rytmu serca, zawału
mięśnia sercowego, spadku ciśnienia tętniczego, prowadzących do wstrząsu kardiogennego, co jest najczęstszą przyczyną
wczesnych zgonów w przebiegu zatrucia
tlenkiem węgla [17].
Mięsień sercowy jest bardzo wrażliwy na niedotlenienie, dlatego istotne jest
właściwe monitorowanie funkcji serca w
zatruciu CO. Obecnie złotym standardem
w diagnostyce uszkodzenia serca jest kilkukrotne wykonywanie zapisu EKG oraz
przynajmniej dwukrotne oznaczenie stężeń
markerów sercowych (głównie troponiny I),
zwłaszcza w przypadku zatruć o przebiegu
średnim i ciężkim. W przypadku stwierdzenia
nieprawidłowości w wyżej wymienionych
badaniach, przy utrzymywaniu się objawów
klinicznych (stenokardia) wskazana jest
dalsza diagnostyka. Dostępnych jest wiele
metod obrazowych, inwazyjnych i nieinwazyjnych, pozwalających na ocenę stopnia
uszkodzenia mięśnia serca, takich jak: echokardiografia, koronarografia, scyntygrafia
perfuzyjna serca (SPECT), metoda SPECTCT, pozytronowa tomografia emisyjna (PET),
pozytronowa tomografia emisyjna połączona
z tomografią komputerową PET-CT, wielorzędowa tomografia komputerowa (MDCT),
rezonans magnetyczny (cardiovascular magnetic resonance imaging - CMR) [22].
624
Echokardiografia
Echokardiografia jest metodą diagnostyczną wykorzystującą ultradźwięki, umożliwiającą m. in. obserwację struktur serca w
ruchu. Badanie to posiada szereg zalet - jest
powszechnie dostępne, nieinwazyjne, bez
przeciwwskazań czy powikłań. Ogromne doświadczenie w zastosowaniu tego badania
w diagnostyce przewlekłej choroby wieńcowej, zawałów mięśnia sercowego i ich
powikłań oraz monitorowaniu pacjentów po
epizodach wieńcowych możne być również
wykorzystane w ocenie funkcji serca u chorych zatrutych CO. Niedokrwienie mięśnia
sercowego, czy odcinkowe, jak w chorobie
niedokrwiennej serca, czy globalne jak w
zatruciu CO powoduje zaburzenia kurczliwości, które narastają w określony sposób
zwany kaskadą niedokrwienia. Początkowo
pojawia się dysfunkcja rozkurczowa i zaburzenia relaksacji mięśnia lewej komory,
następnie dyskretne zaburzenia funkcji
skurczowej, które można uwidocznić korzystając z dopplerowskiej echokardiografii
tkankowej. Wraz z narastaniem niedokrwienia można zaobserwować nieprawidłową
ruchomość ścian i zmniejszoną frakcję
wyrzutową, które są wyrazem znacznie
zaburzonej czynności skurczowej. Kolejne
w kaskadzie niedokrwienia są zmiany w
zapisie EKG, stenokardia oraz zawał/blizna
[4]. Podsumowując, nieprawidłowości w
badaniu echokardiograficznym pojawiają
się wcześniej, przy mniejszym niedokrwieniu
niż objawy kliniczne i elektrokardiograficzne,
które obecnie wraz z markerami biochemicznymi stanowią „złoty standard” w ocenie
serca u chorych zatrutych CO. Nasuwa to
szereg pytań o znaczenie echokardiografii,
wartość diagnostyczną czy rokowniczą
uwidocznionych zmian i ich implikacje terapeutyczne.
W badaniu przeprowadzonym przez
Satrana i wsp. przeanalizowano przypadki
230 pacjentów zatrutych CO pod kątem
uszkodzenia mięśnia sercowego. Zebrano
szczegółowy wywiad odnośnie objawów
zatrucia, także związanych z układem krążenia, chorób przebytych, jak również czynników ryzyka chorób sercowo-naczyniowych.
U pacjentów monitorowano zapisy elektrokardiograficzne, oznaczano biochemiczne
markery martwicy kardiomiocytów (CKMB, troponina I) oraz w grupie 53 chorych
wykonano badanie echokardiograficzne.
U 30 osób (57%) stwierdzono zaburzenia
kurczliwości mięśnia sercowego i w tej grupie wyodrębniono dwa wzorce uszkodzeń
serca. Pacjenci z globalnymi zaburzeniami
kurczliwości (14 osób) byli młodsi ( średnia
wieku 47 lat), mieli mniej obciążeń chorobowych oraz posiadali mniej czynników
ryzyka. Natomiast chorzy z odcinkowymi
zaburzeniami kurczliwości (16 osób) byli
starsi (średnia wieku 64 lata) oraz obciążeni
chorobami układu sercowo-naczyniowego.
Według Satrana i wsp. pierwszy typ był
ściśle związany z zatruciem CO - anoksja
histotoksyczna doprowadziła do rozsianego
uszkodzenia całego mięśnia, natomiast
w typie drugim, ze współistniejącą znaną
lub nie dławicą piersiową, niedotlenienie
spowodowane działaniem CO okazało się
szczególnie toksyczne dla fragmentów
mięśnia sercowego o zmniejszonej perfuzji
wieńcowej [20].
Szczególną rolę echokardiografia
odgrywa w diagnostyce kardiomiopatii
tako-tsubo, kilkukrotnie opisywanej w piśmiennictwie w kontekście zatrucia CO. Jest
to zespół kliniczny przebiegający podobnie
jak ostre zespoły wieńcowe, z bólem w
klatce piersiowej, zmianami w zapisie EKG
i uwolnieniem troponin sercowych. Wśród
kryteriów rozpoznania znajduje się również
charakterystyczny obraz echokardiograficzny - przemijająca hipokineza, akineza
lub dyskineza środkowych segmentów
lewej komory z lub bez zajęcia koniuszka.
Regionalne zaburzenia kurczliwości swoim
zasięgiem wykraczają poza obszar ukrwienia jednej tętnicy wieńcowej, a kształt lewej
komory z przewężeniem na środku i balonowatym poszerzeniem koniuszka przypomina
japońskie naczynie do połowu ośmiornic,
zwane właśnie tako-tsubo. Do rozpoznania
konieczne jest również wykonanie koronarografii i wykluczenie zmian w tętnicach
wieńcowych, które mogłyby odpowiadać za
obraz kliniczny [23].
Interesujący przypadek kardiomiopatii
stresowej w przebiegu zatrucia CO, powikłanej skrzepliną w lewej komorze opisali Lee i
wsp. Wykonanie badania echokardiograficznego w pierwszej dobie zatrucia pozwoliło
na uwidocznienie charakterystycznych dla
kardiomiopatii tako-tsubo odcinkowych
zaburzeń kurczliwości. W kolejnym badaniu
wykonanym w siódmej dobie hospitalizacji
uwidoczniono skrzeplinę w świetle lewej
komory - jest to stosunkowo rzadkie (2,5%)
powikłanie kardiomiopatii stresowej, w
tym przypadku przypuszczalnie związane
również z trombogennym działaniem CO.
Odkrycie skrzepliny niosło za sobą istotne
implikacje terapeutyczne - wdrożono leczenie antykoagulantem. Kolejne badanie, wykonane po trzech tygodniach, potwierdziło
całkowite ustąpienie zaburzeń kurczliwości
oraz brak skrzepliny w świetle lewej komory.
Przypadek ten ilustruje jak przydatne jest
badanie echokardiograficzne na różnych
etapach leczenia - od wstępnej oceny do
ewaluacji efektów leczenia [12].
Podobny przypadek zatrucia CO z
powikłaniami zakrzepowymi opisał Choi i
wsp. Badanie echokardiograficzne oprócz
niewielkich zaburzeń funkcji skurczowej w
zakresie koniuszka z nieznacznie zmniejszoną frakcją wyrzutową uwidoczniło dużą
uszypułowaną skrzeplinę w świetle prawego
przedsionka. Podobnie jak w poprzednim
przypadku, za pomocą TTE (przezklatkowa
echokardiografia - transthoracic echocardiogram) monitorowano efekty leczenia antykoagulacyjnego oraz normalizację funkcji
skurczowej [2].
Badanie echokardiograficzne jest bardzo ważną techniką diagnostyczną w ocenie
serca u chorych zatrutych CO - pozwala na
szybką ocenę funkcji mięśnia sercowego
oraz ewentualnych powikłań zakrzepowych. Wydaje się, że powinien je mieć
wykonane każdy pacjent z dolegliwościami
stenokardialnymi, zmianami w zapisie EKG
czy podwyższonymi stężeniami markerów
sercowych w przebiegu zatrucia CO.
Koronarografia
Koronarografia, czyli angiografia wieńM. Kołodziej i wsp.
cowa, jest metodą diagnostyczną służącą
do oceny morfologii i drożności naczyń
wieńcowych oraz ewentualnego krążenia
obocznego. Badanie jest inwazyjne, poprzez
dostęp przezskórny do tętnicy obwodowej
(najczęściej udowej lub promieniowej) wprowadza się ukształtowane cewniki do prawej i
lewej tętnicy wieńcowej, a następnie aplikuje
kontrast. Obrazy uzyskuje się w różnych
projekcjach wykorzystując promieniowanie
rentgenowskie. Zaletą tej metody, w porównaniu do pozostałych technik diagnostycznych jest możliwość jednoczasowego podjęcia działań terapeutycznych zmierzających
do rozszerzenia czy udrożnienia zwężonego
naczynia. Ta procedura znajduje zastosowanie w diagnostyce choroby niedokrwiennej
serca, szczególnie w ostrych zespołach
wieńcowych. U chorych z uszkodzeniem
mięśnia sercowego w przebiegu zatrucia CO
nie jest to metoda pierwszego wyboru, ze
względu na mechanizm uszkodzenia, które
na ogół jest globalne i związane z hipoksją.
W kontekście zatrucia CO, to badanie może
mieć wartość wykluczającą, jak na przykład
we wspomnianej już wcześniej kardiomiopatii stresowej - do rozpoznania choroby wymagane jest potwierdzenie angiograficzne
prawidłowych naczyń wieńcowych.
Pacjenci z rozpoznaną już chorobą
wieńcową są bardziej narażeni na toksyczne
działanie CO - mają upośledzony przepływ
wieńcowy, co może dodatkowo nasilać niedotlenienie w mechanizmie zmniejszonej
perfuzji przy większym zapotrzebowaniu
na tlen. Ponadto ich kardiomiocyty zawierają mniej mioglobiny, krótkotrwałego rezerwuaru tlenu, której funkcja, podobnie jak
hemoglobiny, zostaje zaburzona przez CO
[22]. Ważnym aspektem jest również prozakrzepowe działanie CO - w piśmiennictwie
opisywano przypadek zakrzepicy w stencie
w przebiegu zatrucia, wykrytej w badaniu koronarograficznym i usuniętej w wykorzystaniem technik kardiologii interwencyjnej [3].
Być może u tych chorych przeprowadzenie
badania i ewentualna interwencja mogłyby
poprawić funkcję mięśnia sercowego oraz
rokowanie odległe [8].
Wydaje się, że grupa pacjentów, która
również mogłaby odnieść korzyści z wykonania koronarografii, to chorzy starsi, mężczyźni, z czynnikami ryzyka sercowo-naczyniowego. Szczególnie w tej grupie pacjentów
nie można wykluczyć obecności istotnych
zwężeń w naczyniach wieńcowych, które do
czasu zatrucia pozostawały bezobjawowe.
Poza zmianami w zapisie EKG oraz podwyższonymi stężeniami markerów sercowych,
za chorobą niedokrwienną serca mogłaby
przemawiać obecność odcinkowych zaburzeń kurczliwości uwidocznionych w badaniu
echokardiograficznym. Potwierdzenie lub
wykluczenie choroby niedokrwiennej serca
w tej grupie chorych niesie za sobą znaczące implikacje terapeutyczne - m.in. związane
z wdrożeniem agresywnego leczenia przeciwpłytkowego.
Do oceny ryzyka w kardiologii stosuje
się kartę SCORE. Skala ta ocenia 10-letnie
ryzyko incydentu sercowo-naczyniowego
zakończonego zgonem, w zależności od
płci, wieku, ciśnienia skurczowego, stężenia
cholesterolu całkowitego oraz palenia tytoniu. Może zostać wykorzystana do wyodrębPrzegląd Lekarski 2013 / 70 / 8
nienia grupy chorych, którzy mogą odnieść
korzyści z wykonania koronarografii. Wydaje
się jednak, że decyzja o wykonaniu badania
powinna być w każdym przypadku indywidualna, po wnikliwym rozważeniu potencjalnych zysków i zagrożeń oraz skonsultowana
z doświadczonym kardiologiem.
Scyntygrafia perfuzyjna serca
(SPECT), metoda SPECT-CT oraz pozytronowa tomografia emisyjna (PET)
i pozytronowa tomografia emisyjna
połączona z tomografią komputerową
PET-CT
Scyntygrafia (SPECT), tomografia emisyjna pojedynczego fotonu (single-photon
emission-computed tomography), jest nieinwazyjną metodą stosowaną w diagnostyce
choroby niedokrwiennej serca i martwicy
miokardium. Jest to technika obrazowa,
która wykorzystuje przepływ lub wychwyt
przez tkanki podanych dożylnie związków
znakowanych radioaktywnymi izotopami
talu i technetu (najczęściej 99mTc-MIBI) [10].
Ich aktywność promieniotwórcza może być
nieinwazyjnie rejestrowana, co umożliwia
rekonstrukcję morfologii narządów i parametrów przepływu krwi. Scyntygrafia perfuzyjna
serca jest badaniem o wysokiej czułości
(90%) i swoistości (80%) [14], które pozwala
ocenić żywotność, funkcję i perfuzję mięśnia
serca. W diagnostyce dostępna jest także
metoda G-SPECT (bramkowana sygnałem
EKG tomografia emisyjna). Obecnie w
diagnostyce możliwe jest także połączenie
badań z użyciem zarówno gamma-kamery, jak i tomografu komputerowego, co
umożliwia nałożenie danych z obrazowania czynnościowej funkcji miokardium na
obraz anatomiczny serca, co jest techniką
bardziej dokładną niż klasyczne SPECT,
czy CT serca.
Pozytronowa tomografia emisyjna (PET)
jest obecnie metodą referencyjną do oceny
żywotności miokardium [22]. Umożliwia
ocenę funkcji lewej komory serca (LK), jej
unerwienie i ukrwienie, a także pozwala
zobrazować metabolizm kardiomiocytów. W
tej technice wykorzystuje się radiofarmaceutyki, które emitują pozytony (do oceny serca
najczęściej fluorek 18-deoksyglukozy). Jeśli
zobrazuje się w tym badaniu metabolizm
w komórkach, będzie to świadczyło o ich
żywotności, nawet jeśli ich funkcja jest upośledzona. Umożliwia to m.in. identyfikację
chorych, którzy wymagają pilnej reperfuzji.
Natomiast przy stwierdzeniu „braku żywotności komórki” danej części miokardium (co
tożsame jest z brakiem zdolności miokardium do poprawy swojej funkcji skurczowej)
można uniknąć niepotrzebnych już procedur
inwazyjnych i związanego z nim ryzyka.
Nałożenie obrazów czynnościowych i
anatomicznych serca przez połączenie tej
metody z obrazowaniem tomograficznym,
czyni PET-CT jedną z najbardziej kompleksowych metod oceny funkcji i budowy miokardium. Ponadto w technice PET można
zobrazować wzmożony mechanizm beztlenowy w miokardium, gdyż cykle anaerobowe
w komórkach serca powodują zwiększenie
przemian fluorku-18-deoksyglukozy.
Opisane pokrótce metody SPECT i PET
oraz ich połączenie z tomografią komputerową (SPECT-CT, PET-CT) dają możliwość
nie tylko bardzo dokładnej oceny budowy
anatomicznej i funkcji skurczowej poszczególnych obszarów mięśnia serca, ale także
aktywności fizjologicznej, metabolizmu i żywotności poszczególnych kardiomiocytów.
To dzięki tym metodom wprowadzono do
praktyki klinicznej pojęcia takie jak: „stan żywotności mięśnia sercowego”, „ogłuszenie”,
„hibernacja” i martwica miokardium [14].
„Żywotny mięsień sercowy” to ta część
miokardium, która mimo upośledzonej
funkcji skurczowej nadal zawiera żywe
komórki zdolne do poprawy ich funkcji po
przywróceniu perfuzji i utlenowania tkanki. Do „hibernacji” („zamrożenia mięśnia
serca”) dochodzi w wyniku długotrwałego
niedokrwienia i długo utrzymujących się
zaburzeń kurczliwości, co skutkuje przebudową zarówno samych kardiomiocytów,
jak i macierzy pozakomórkowej. Taki obszar
może zarówno ulec martwicy, jak i powrócić
do normalnego funkcjonowania po przywróceniu perfuzji. Do „ogłuszenia” mięśnia
serca (czyli odwracalnej dysfunkcji skurczowej) dochodzi po przywróceniu krążenia po
stosunkowo krótkim okresie niedrożności
naczynia. Dzieje się to z powodu niszczenia
aparatu kurczliwego kardiomiocyta przez
przeładowanie ich jonami wapnia po nagłym
dopływie tlenu. Natomiast o martwicy miokardium możemy powiedzieć dopiero wtedy,
kiedy oprócz braku czynności skurczowej
nie ma żadnej aktywności metabolicznej w
poszczególnym komórkach.
Bardzo często w toksykologii mamy do
czynienia z wieloprzyczynowym uszkodzeniem serca, a nie jedynie w mechanizmie
zawału serca. Dzieje się tak, nie tylko podczas zatruć związkami kardiotoksycznymi,
ale także w przebiegu zatruć powodujących
uogólnioną hipoksję, jak w przypadku
tlenku węgla [5]. Na uszkodzenie serca w
zatruciach ma także wpływ wcześniejsze
obciążenie kardiologiczne chorych toksykologicznych. Opisywano korelację nasilenia
zmian w obrazie scyntygraficznym ze stężeniem kwasu mlekowego we krwi pacjentów
tuż po przyjęciu. Jednak z powodu wysokiej
ceny oraz ograniczonej dostępności do tych
badań, na pewno przez długi jeszcze czas
nie będą one powszechne w diagnostyce
pacjentów toksykologicznych. Wydaje się
jednak, że należy rozważyć wyłonienie takiej
grupy chorych, u których wykonanie SPECT,
czy PET przyniesie wymierne korzyści w
ich leczeniu. Jeśli np. u zatrutego pacjenta
zostaną stwierdzone zmiany w zapisie
EKG, podwyższone stężenie troponin w
badaniach biochemicznych, upośledzenie
kurczliwości serca w echokardiografii, to
przy istnieniu obiektywnych przeciwwskazań do wykonania koronarografii, badanie
SPECT-CT z opcją naczyniową pozwoli na
ocenę nie tylko ukrwienia i budowy miokardium, ale również ocenę jego żywotności,
co pozwoli zweryfikować i zaplanować
leczenie. Pocieszająca jest z roku na rok
coraz większa dostępność do tych badań,
co być może umożliwi szerszą i dokładniejszą diagnostykę osób zatrutych, u których
doszło do uszkodzenia serca.
Tomografia komputerowa
Tomografia komputerowa wykorzystuje
ruchomą lampę rentgenowską do tworzenia
625
przekrojów badanej części ciała. Wprowadzona w 1999 r. wielorzędowa tomografia
komputerowa (MDCT, multi-row-detector
computed tomography) znacznie zwiększyła liczbę warstw obrazowanych w trakcie
jednego obrotu lampy wokół pacjenta, co
wpływa na skrócenie czasu badania oraz
zmniejszenie narażenie badanego na promieniowanie. Dostępne obecnie tomografy
64-rzędowe pozwalają na zobrazowanie
serca w ciągu 10 sekund, a więc jednego
zatrzymanego oddechu [13]. W fazie testów
znajdują się tomografy 256-rzędowe [15].
Ponieważ badanie wykonywane jest na
bijącym sercu, aby uzyskać dobrą jakość
obrazu stosuje się dwie metody zależne od
zapisu elektrokardiograficznego: wyzwalanie prospektywne EKG i retrospektywne
bramkowanie EKG. W pierwszej metodzie
zapis odbywa się tylko w określonym
momencie w odniesieniu każdego do załamka R. Zmniejsza to konieczną dawkę
promieniowania i skraca czas potrzebny
na wykonanie badania i analizę, jednak
zobrazowana zostaje tylko konkretna faza
cyklu pracy serca. W drugiej metodzie zapis
nie jest przerywany, a na podstawie EKG
dokonywana jest analiza obrazu serca w
różnych fazach jego pracy. Umożliwia to
przeprowadzanie wtórnych rekonstrukcji
oraz ocenę czynnościową, ale wymaga
większej dawki promieniowania. Trudności
w uzyskaniu dobrego, pozbawionego artefaktów obrazu pojawiają się przy niemiarowej pracy serca, tachykardii (im wolniejsza
akcja serca tym lepsza jakość obrazów) oraz
duszności lub braku współpracy pacjenta
(niemożność wstrzymania oddechu). W
razie tendencji do tachykardii konieczne
może być przygotowanie farmakologiczne
(np. podanie lub zwiększenie dawki leków
beta-adrenolitycznych). W związku z powyższymi ograniczeniami nasilone zaburzenia
rytmu serca, znaczna tachykardia, brak
współpracy i niewydolność oddechowa
zaliczane są do przeciwwskazań do MDCT.
Badanie jest przeciwwskazane także u pacjentów uczulonych na środki kontrastowe
i u ciężarnych.
Tomografia komputerowa znajduje
zastosowanie głównie jako nieinwazyjna
alternatywa dla koronarografii w diagnostyce choroby niedokrwiennej serca. Przy jej
pomocy można dokonać analizy zwężeń
tętnic wieńcowych, jak również morfologii blaszek miażdżycowych (uwapnione
i nieuwapnione). Dodatkowo umożliwia
wykrywanie innych przyczyn bólu w klatce
piersiowej, takich jak zatorowość płucna
czy rozwarstwienie bądź tętniak aorty piersiowej. Tomografię stosuje się do oceny
anatomii lewego przedsionka i ujść żył
płucnych przed ablacją, żył wieńcowych
przed wszczepieniem stymulatora oraz
tętnic, które mają być wykorzystane do pomostowania aortalno-wieńcowego (coronary
artery bypass graft - CABG), jak również
do wykrywania wrodzonych i nabytych
wad serca oraz nieprawidłowych struktur w
jego obrębie, takich jak guz czy skrzeplina.
Współczesne tomografy mogą także dokonać oceny hemodynamicznej funkcji serca,
z oceną objętości komór i frakcji wyrzutowej, jednak badania w tym celu są rzadko
wykonywane w obliczu dostępności metod
626
niewymagających narażenia na promieniowanie (echokardiografia, MRI) [21].
W zatruciu tlenkiem węgla CT znajduje
szczególne zastosowaniu u pacjentów,
którzy mają wskazania do wykonania
koronarografii, jednak nie wyrażają zgody
na to badanie bądź jest ono niedostępne.
Zwłaszcza jeśli pacjent jest młody i nieobciążony kardiologicznie badanie to jest dobrą
metodą do wykluczenia zmian w naczyniach
wieńcowych [2].
Rezonans magnetyczny
Obrazowanie metodą rezonansu magnetycznego (magnetic resonance imaging
- MRI) jest metodą diagnostyczną opartą na
zjawisku opisanym w 1946 r. niezależnie
przez Felixa Blocha i Edwarda Purcella [7].
Obaj uczeni otrzymali za to odkrycie nagrodę Nobla w 1952 r. Tymczasem zastosowanie MRI w medycynie datuje się dopiero od
lat 70. XX w. Obrazowanie serca metodą
rezonansu magnetycznego (cardiovascular
magnetic resonance imaging - CMR) rozwijało się równolegle z obrazowaniem innych
części ciała, jednak początkowo napotykało
na liczne trudności, związane głównie z
zakłóceniami spowodowanymi przez pracę serca oraz ruchy klatki piersiowej. W
latach 80. uzyskiwano obrazy morfologii i
funkcji mięśnia sercowego, z możliwością
uwidocznienia jego podstawowych nieprawidłowości (stłuszczenie, naciek zapalny).
Lata 90. przyniosły możliwość oceny perfuzji
miokardium i wykrycia blizny [19].
Obecnie przy pomocy CMR można
z dużą dokładnością i powtarzalnością
ocenić globalną i regionalną kurczliwość
mięśnia sercowego, przepływ krwi, perfuzję
w spoczynku i po podaniu adenozyny lub
dobutaminy, a także wykryć anomalie morfologiczne [1,9]. CMR znajduje zastosowanie
w obrazowaniu wrodzonych i nabytych wad
serca, anomalii dużych naczyń (tętniaki,
krwiaki śródścienne), a także w ocenie
budowy i funkcji mięśnia sercowego oraz
ich zaburzeń (np. guzy, zmiany zapalne,
kardiomiopatie). Przy pomocy CMR można
wykrywać chorobę niedokrwienną serca,
zarówno pośrednio, poprzez ocenę kurczliwości i perfuzji, jak i poprzez bezpośrednie
uwidocznienie zwężenia tętnic wieńcowych.
Technikę tę stosowano z dobrym skutkiem
do rozpoznawania ostrych zespołów wieńcowych, także w przypadkach bez zmian w
elektrokardiogramie i bez wzrostu stężenia
markerów sercowych. CMR znajduje zastosowanie także w ocenie powikłań po
uszkodzeniach mięśnia sercowego, takich
jak tętniaki i pseudotętniaki, perforacje,
wady zastawkowe [18]. Opisano wykrycie
przy pomocy CMR włóknienia mięśnia sercowego związane z przebytym zatruciem
tlenkiem węgla [6].
Zastosowanie CMR należy rozważyć w
każdym przypadku ostrego zatrucia, kiedy
zachodzi podejrzenie uszkodzenia mięśnia
sercowego lub dużych naczyń. Wśród niewątpliwych zalet tej metody można wymienić
możliwość nieinwazyjnej dokładnej oceny
morfologii i funkcji serca przy braku narażenia na promieniowanie. Jest to szczególnie
istotne podczas badania ciężarnych oraz
dzieci. Kwalifikując pacjenta do badania
należy pamiętać o przeciwwskazaniach,
takich jak uczulenie na kontrast, obecność
metalicznych ciał obcych. Dodatkowe
przeciwwskazania obowiązują przy CMR
stresowym. Można rozważać wykonywanie
MRI u pacjentów z niektórymi urządzeniami
wszczepialnymi, jednak należy brać pod
uwagę, że pole magnetyczne może doprowadzić do nagrzewania tkanki przylegającej
do elektrod, a także zakłócić pracę stymulatora, co niesie ze sobą duże ryzyko przede
wszystkim dla pacjentów stymulatorozależnych. Wykonywanie CMR u takich chorych
wiąże się z koniecznością przygotowania
wszczepionego urządzenia do badania,
wzmożonego monitorowania pacjenta podczas badania oraz kontrolnej oceny pacjenta
i urządzenia, po jego zakończeniu [16].
Do innych wad CMR należą wysoki koszt
i konieczność wysokospecjalistycznego
szkolenia personelu. W porównaniu do
koro-CT słabą stroną MRI jest długi czas
badania tętnic wieńcowych oraz słabsza
rozdzielczość utrudniająca dokładną ocenę
ich końcowych odcinków [11].
Podsumowanie
Uszkodzenie miokardium w przebiegu
zatrucia CO jest częstym powikłaniem, dotyczy około 30% chorych. Wydaje się nam
zasadne, że u każdego pacjenta z zatruciem
średnim lub ciężkim oraz u wszystkich
chorych toksykologicznych obciążonych
wywiadem kardiologicznym lub zakrzepowo-zatorowym należy przeprowadzić podstawową diagnostykę kardiologiczną celem
wykluczenia uszkodzenia mięśnia serca
(przynajmniej kilkukrotne powtórzenie zapisu EKG i dwukrotne oznaczenie stężenie
troponiny). Jako metodę obrazową z wyboru
w przypadku dodatniego obrazu klinicznego
(stenokardia), stwierdzenia nieprawidłowości w zapisach EKG czy badaniach laboratoryjnych (troponina, mioglobina, CK-MB)
należy wykonać echokardiografię. Wśród
jej zalet możemy wymienić praktycznie brak
przeciwwskazań i powikłań, nieinwazyjność,
szeroką dostępność oraz niski koszt wykonania. Można ją także wykonać przy łóżku
chorego, co jest ważne w przypadku chorych
wymagających intensywnej opieki. W oparciu o obraz kliniczny i echokardiograficzny
należy podjąć decyzję o ewentualnym rozszerzeniu diagnostyki obrazowej. Koronarografia jest badaniem, które należy wykonać
bezzwłocznie u wszystkich pacjentów, u których podejrzewamy martwicę mięśnia serca
spowodowaną niedokrwieniem przez zmiany w naczyniach wieńcowych lub zakrzepicę
w stencie (dotyczy to głównie pacjentów
starszych, z cukrzycą, obciążeniem kardiologicznym czy zakrzepowo-zatorowym).
W pozostałych przypadkach, obarczoną
mniejszą ilością powikłań i niebezpiecznych
skutków ubocznych jest metoda CT i angioCT serca. Pozwala ona nie tylko uwidocznić
struktury serca, ale również wykluczyć istotne zmiany w naczyniach wieńcowych. Obie
te metody są przeciwwskazane u kobiet w
ciąży. U dzieci i młodzieży należy rozważyć
korzyści wynikające z tych badań, a ryzyko
związane z koronarografią czy dużą dawką
promieniowania rentgenowskiego używanego w trakcie CT serca. Wydaje się, że
w tej grupie chorych metodą z wyboru do
rozszerzenia diagnostyki obrazowej jest
M. Kołodziej i wsp.
MRI serca, którego podstawowymi wadami są dość wysoka cena, umiarkowanie
mniejsza dokładność oraz fakt, że badanie
jest przeciwwskazane przy obecności ciał
metalowych i stymulatorów w ciele pacjenta.
Najmniej dostępnymi, ale dającymi największe możliwości oceny funkcji i żywotności
miokardium są metody nuklearne (SPECT
i PET). Jednak ze względu na swoją małą
dostępność i bardzo wysoką cenę wydają
się być na razie alternatywą dostępną
jedynie dla ośrodków akademickich i wysokospecjalistycznych. Badania z użyciem
radioizotopów są również przeciwwskazane
u ciężarnych.
Warto wspomnieć o badaniach czynnościowych układu krążenia, tj. próbie wysiłkowej, 24-godzinnym monitorowaniu zapisu
EKG i systemowego ciśnienia tętniczego
metodą Holtera, których dokładny opis wychodzi poza ramy niniejszego opracowania.
Są one zdaniem autorów cennymi metodami, które mają ograniczone zastosowanie w
diagnostyce i leczeniu w oddziałach ostrych
zatruć, ale mogą wnieść wiele istotnych
informacji, wykonane w ramach dalszej
opieki kardiologicznej, w zakresie oceny
wydolności pacjenta, ustalenia dalszego
leczenia oraz rokowania.
Piśmiennictwo
1. Attili A.K., Schuster A., Nagel E. et al.: Quantification in cardiac MRI: advances in image acquisition
and processing. Int. J. Cardiovasc. Imaging 2010,
26, 27.
Przegląd Lekarski 2013 / 70 / 8
2. Choi H., Kim D.H., Sun B.J. et al.: A case of carbon
monoxide poisoning with thrombus in right atrium. J.
Cardiovasc. Ultrasound 2012, 20, 205.
3. Dileo P.A., Tucciarone M., Castro E.R., Guerrero M.:
Late stent thrombosis secondary to carbon monoxide
poisoning. Cardiovasc. Revasc. Med. 2011, 12, 56.
4. Feigenbaum H., Armstrong W.F., Ryan T.: Echokardiografia Feigenbauma. Medipage, Warszawa
2006.
5. Fotbolcu H., Incedere O., Bakal R.B. et al.: Reversible myocardial stunning due to carbon monoxide
exposure. Cardiovasc. J. Afr. 2011, 22, 93.
6. Henry T.D., Lesser J.R., Satran D.: Myocardial
fibrosis from severe carbon monoxide poisoning
detected by cardiac magnetic resonance imaging.
Circulation 2008, 118, 792.
7. Hornak J.P.: The basics of MRI. Interactive Learning
Software, Henietta, NY 2008.
8. Hsu P.C., Lin T.H., Su H.M. et al.: Acute carbon monoxide poisoning resulting in ST elevation myocardial
infarction: a rare case report. Kaohsiung J. Med. Sci.
2010, 26, 271.
9. Jahnke C., Nagel E., Gebker R. et al.: Prognostic
value of cardiac magnetic resonance stress tests:
adenosine stress perfusion and dobutamine stress
wall motion imaging. Circulation 2007, 115, 1769.
10. Kasprzak J.: Scyntygrafia serca. [w]: Szczeklik A.
(red.): Choroby wewnętrzne. Medycyna Praktyczna,
Kraków 2005.
11. Kośmicki M.A.: Choroba niedokrwienna serca.
Inwazyjna i nieinwazyjna diagnostyka tętnic wieńcowych - koronarografia klasyczna i komputerowa
oraz rezonans magnetyczny. Kardiol. Op. Fakt.
2011, 1, 36.
12. Lee S.J., Kang J.H., Kim N.Y. et al.: A case report of
carbon monoxide poisoning induced cardiomyopathy
complicated with left ventricular thrombus. J. Cardiovasc. Ultrasound 2011, 19, 83.
13. Michalak M.J., Zawadzki M., Walecki J.: Wielorzędowa tomografia komputerowa w kardiologii. Choroby
Serca i Naczyń 2005, 2, 107.
14. Miernik S., Dziuk M.: Metody hybrydowe (SPECT-CT,
PET-CT) w diagnostyce choroby wieńcowej i ocenie
żywotności mięśnia sercowego. Choroby Serca i
Naczyń 2008, 2, 93.
15. Motoyama S., Anno H., Sarai M. et al.: Noninvasive
coronary angiography with a prototype 256-row area
detector computed tomography system: comparison
with conventional invasive coronary angiography. J.
Am. Coll. Cardiol. 2008, 51, 773.
16. Nazarian S., Beinart R., Halperin H.R.: Magnetic
resonance imaging and implantable devices. Circ.
Arrhythm. Electrophysiol. 2013, 6, 419.
17. Pach D., Pach J., Targosz D.: Tlenek węgla. [w]:
Pach J. (red.): Zarys toksykologii klinicznej. Wydawnictwo Uniwersytetu Jagiellońskiego, Kraków,
2009.
18. Pennell D.J., Sechtem U.P., Higgins C.B. et al.:
Clinical indications for cardiovascular magnetic
resonance (CMR): Consensus Panel report. J.
Cardiovasc. Magn. Reson. 2004, 6, 727.
19. Pohost G.M.: The History of Cardiovascular Magnetic
Resonance. J. Am. Coll. Cardiol. Img. 2008, 5, 672.
20. Satran D., Henry C.R., Adkinson C. et al.: Cardiovascular manifestations of moderate to severe
carbon monoxide poisoning. J. Am. Coll. Cardiol.
2005, 45, 1513.
21. Schroeder S., Achenbach S., Bengel F. et al.: Cardiac computed tomography: indications, applications,
limitations, and training requirements: report of a Writing Group deployed by the Working Group Nuclear
Cardiology and Cardiac CT of the European Society
of Cardiology and the European Council of Nuclear
Cardiology. Eur. Heart J. 2008, 29, 531.
22. Szponar J., Kołodziej M., Majewska M. i wsp.:
Uszkodzenie mięśnia sercowego w przebiegu zatrucia tlenkiem węgla. Przegl. Lek. 2012, 69, 528.
23. Szponar J., Krajewska A., Majewska M. i wsp.:
Kardiomiopatia tako-tsubo w przebiegu zatrucia
tlenkiem węgla. Przegl. Lek. 2012, 69, 611.
627