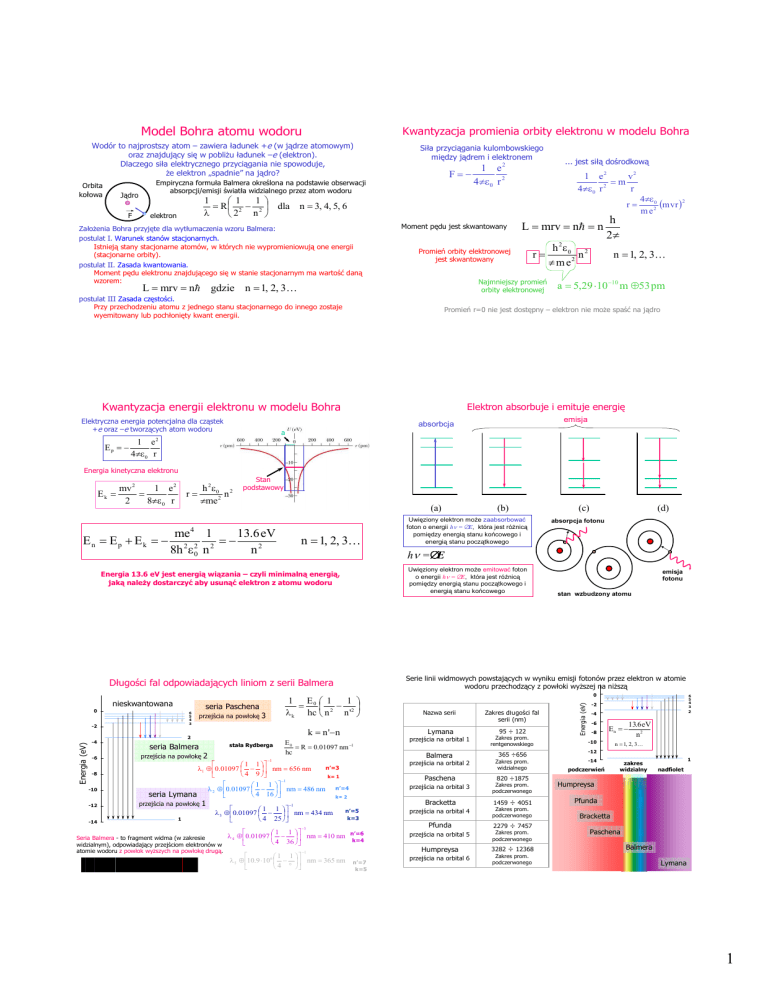
Model Bohra atomu wodoru
Kwantyzacja promienia orbity elektronu w modelu Bohra
Wodór to najprostszy atom – zawiera ładunek +e (w jądrze atomowym)
oraz znajdujący się w pobliŜu ładunek –e (elektron).
Dlaczego siła elektrycznego przyciągania nie spowoduje,
Ŝe elektron „spadnie” na jądro?
Orbita
kołowa
Jądro
F
Siła przyciągania kulombowskiego
między jądrem i elektronem
F=−
Empiryczna formuła Balmera określona na podstawie obserwacji
absorpcji/emisji światła widzialnego przez atom wodoru
1
1
1
= R 2 − 2 dla
λ
2 n
elektron
1 e2
v2
=m
4πε0 r 2
r
r=
Moment pędu jest skwantowany
L = mrv = nh = n
Promień orbity elektronowej
jest skwantowany
r=
Najmniejszy promień
orbity elektronowej
L = mrv = nh gdzie n = 1, 2, 3K
postulat III Zasada częstości.
Przy przechodzeniu atomu z jednego stanu stacjonarnego do innego zostaje
wyemitowany lub pochłonięty kwant energii.
h 2ε 0 2
n
π m e2
4πε 0
(m v r ) 2
m e2
h
2π
n = 1, 2, 3K
a = 5,29 ⋅10 −10 m ≈ 53 pm
Promień r=0 nie jest dostępny – elektron nie moŜe spaść na jądro
Kwantyzacja energii elektronu w modelu Bohra
Ep = −
... jest siłą dośrodkową
n = 3, 4, 5, 6
ZałoŜenia Bohra przyjęte dla wytłumaczenia wzoru Balmera:
postulat I. Warunek stanów stacjonarnych.
Istnieją stany stacjonarne atomów, w których nie wypromieniowują one energii
(stacjonarne orbity).
postulat II. Zasada kwantowania.
Moment pędu elektronu znajdującego się w stanie stacjonarnym ma wartość daną
wzorem:
Elektryczna energia potencjalna dla cząstek
+e oraz –e tworzących atom wodoru
1 e2
4πε0 r 2
Elektron absorbuje i emituje energię
emisja
absorbcja
a
1 e2
4πε 0 r
Energia kinetyczna elektronu
mv 2
1 e2
h 2ε0 2
=
r=
n
2
8πε 0 r
πme 2
En = Ep + Ek = −
Stan
podstawowy
(a)
me4 1
13.6 eV
=−
2 2
2
8h ε 0 n
n2
n = 1, 2, 3K
6
5
4
3
Energia (eV)
-2
-4
-6
-8
-10
-12
-14
1 E0 1
1
=
−
λ k hc n 2 n '2
seria Paschena
przejścia na powłokę
3
k = n '− n
2
stała Rydberga
seria Balmera
przejścia na powłokę
2
E0
= R = 0.01097 nm −1
hc
−1
1 1
n’=3
λ1 ≈ 0.01097 − nm = 656 nm
4 9
k= 1
−1
1 1
λ 2 ≈ 0.01097 − nm = 486 nm n’=4
seria Lymana
4 16
k= 2
przejścia na powłokę
1
1
−1
1 1
λ 3 ≈ 0.01097 − nm = 434 nm
4 25
n’=5
k=3
−1
1 1
λ 4 ≈ 0.01097 − nm = 410 nm
Seria Balmera - to fragment widma (w zakresie
4 36
widzialnym), odpowiadający przejściom elektronów w
atomie wodoru z powłok wyŜszych na powłokę drugą.
(d)
emisja
fotonu
stan wzbudzony atomu
Serie linii widmowych powstających w wyniku emisji fotonów przez elektron w atomie
wodoru przechodzący z powłoki wyŜszej na niŜszą
Długości fal odpowiadających liniom z serii Balmera
nieskwantowana
(c)
absorpcja fotonu
hν =∆
∆E
Uwięziony elektron moŜe emitować foton
o energii hν = ∆E, która jest róŜnicą
pomiędzy energią stanu początkowego i
energią stanu końcowego
Energia 13.6 eV jest energią wiązania – czyli minimalną energią,
jaką naleŜy dostarczyć aby usunąć elektron z atomu wodoru
0
(b)
Uwięziony elektron moŜe zaabsorbować
foton o energii hν = ∆E, która jest róŜnicą
pomiędzy energią stanu końcowego i
energią stanu początkowego
n’=6
k=4
−1
1 1
λ 5 ≈ 10.9 ⋅106 − nm = 365 nm
4 ∞
n’=7
k=5
0
Nazwa serii
Zakres długości fal
serii (nm)
Lymana
95 ÷ 122
przejścia na orbital 1
Zakres prom.
rentgenowskiego
Balmera
365 ÷656
przejścia na orbital 2
Zakres prom.
widzialnego
Paschena
820 ÷1875
przejścia na orbital 3
Zakres prom.
podczerwonego
Bracketta
1459 ÷ 4051
przejścia na orbital 4
Zakres prom.
podczerwonego
Pfunda
2279 ÷ 7457
przejścia na orbital 5
Zakres prom.
podczerwonego
Humpreysa
3282 ÷ 12368
przejścia na orbital 6
Zakres prom.
podczerwonego
Energia (eV)
Ek =
6
5
4
3
-2
2
-4
-6
-8
En = −
-10
13.6 eV
n2
n = 1, 2, 3K
-12
-14
podczerwień
zakres
widzialny
1
nadfiolet
Humpreysa
Pfunda
Bracketta
Paschena
Balmera
Lymana
1
Stany elektronowe atomu
Wykres zaleŜności energii jonizacji od ich liczby atomowej
Energia jonizacji (eV)
Sześć okresów z 2, 8, 8, 18, 18 i 32 pierwiastkami odpowiednio
w kaŜdym z nich. Te liczby są przewidziane przez mechanikę kwantową
Liczba kwantowa
n
orbitalna
l
orbitalna
magnetyczna
ml
spin
s
magnetyczna
spinowa
ms
L = l(l + 1) h
Orbitalny dipolowy moment
magnetyczny
r
e r
µ orb = −
L
2m
L z = m lh
µ orb = −
orbitalna liczba kwantowa
l=2
e
l(l + 1) h = µ B l(l + 1)
2m
µB =
L= 6h
r
B = Bo k̂
0, 1, 2, …, (n-1)
orbitalnemu momentowi pędu
- l, -(l -1), …+(l -1), +l
orbitalnemu momentowi pędu
(składowa wzdłuŜ osi z)
½
spinowemu momentowi pędu
±½
spinowemu momentowi pędu
(składowa wzdłuŜ osi z)
S=
Składowa spinowego
momentu pędu
S = s(s + 1) h
Spinowy magnetyczny
moment dipolowy
Sz = m s h
r
e r
µs = − S
m
(
1 1
2 2
)
+ 1 h = 0.866h
ms = + ½
eh
= 9.274 ⋅10− 24 J T
2m
Składowa spinowego
momentu magnetycznego
ms = - ½
„spin w dół”
ml = 0, ±1, ±2, ..., ± wartość maksymalna
z
Dodawanie orbitalnych i spinowych momentów magnetycznych
)
µB =
eh
= 9.274 ⋅10 − 24 J T
2m
cienka
nić
Całkowity moment pędu obojętnego atomu o liczbie atomowej Z
) (
µ s , z = −2m s µ B = m µ B
Eksperyment Einsteina-de Haasa
L
(
e
s (s + 1) h
m
Nie moŜ
moŜna zmierzyć
zmierzyć spinowego momentu
magnetycznego – moŜ
moŜna jedynie zmierzyć
zmierzyć
dowolną
dowolną jego skł
składową
adową (np. zz-tową
tową po
magnetyczna spinowa
zastosowaniu pola magnetycznego w
liczba kwantowa
kierunku osi z)
Składowa orbitalnego
momentu magnetycznego
r r r
r
r r r
r
r
J = L1 + L 2 + L 3 + K L Z + S1 + S2 + S3 + KSZ
µs = −
„spin w górę”
µ orb , z = − m l µ B
m l = −2, − 1, 0, 1, 2
odległości od jądra
Spinowy
moment pędu
Nie moŜ
moŜna zmierzyć
zmierzyć orbitalnego momentu
magnetycznego – moŜ
moŜna jedynie zmierzyć
zmierzyć dowolną
dowolną
jego skł
składową
adową (np. zz-tową
tową po zastosowaniu pola
magnetycznego w kierunku osi z)
magnetyczna orbitalna
liczba kwantowa
Odpowiada
1, 2, 3, …
Spinowy moment magnetyczny
Moment pędu i magnetyczny moment dipolowy
Składowa orbitalnego
momentu pędu
Dozwolone wartości
Wszystkie stany o jednakowej głównej liczbie kwantowej n tworzą powłokę.
Liczba n określa więc numer powłoki. Maksymalna liczba elektronów na
powłoce o numerze n to 2n2.
Wszystkie stany o jednakowych liczbach n i l tworzą podpowłokę.
Podpowłokę tworzy 2(2l+1) stanów, które charakteryzują się niemal
jednakowymi wartościami energii.
Liczba atomowa Z
Orbitalny
moment pędu
Symbol
główna
-e r
me
µ
v
Ŝelezny
walec
solenoid
Poruszający się cząstka ma
moment pędu L = r×p, gdzie
p=mv oraz sprzęŜony z nim
moment magnetyczny µ
(skierowany przeciwnie do L ).
Całkowity (efektywny) moment magnetyczny tego atomu
r
r r r
r
µ eff = µ1 + µ 2 + µ 3 + Kµ Z =
r
r
r
e r r
e r r r
=−
L1 + L 2 + L 3 + K L Z − S1 + S2 + S3 + KSZ
2m
m
(
)
(
)
a)
W nieobecności zewnętrznego pola magnetycznego ustawienia momentów pędu
atomów, a więc równieŜ momentów magnetycznych są przypadkowe. Wypadkowy
moment pędu walca jest równy zero.
b) Włączenie pola magnetycznego skierowanego wzdłuŜ osi walca powoduje, Ŝe momenty
magnetyczne ustawiają się wzdłuŜ kierunku pola, co oznacza, Ŝe stowarzyszone z nimi
momenty pędu ustawiają się równieŜ wzdłuŜ kierunku pola. PoniewaŜ na walec nie
działały Ŝadne siły zewnętrzne - jego moment pędu nie moŜe się zmienić (musi nadal
być równy zero), aby tak było walec musi się obracać.
2
Funkcje falowe opisujące uwięziony elektron
Elektron w jednowymiarowej pułapce zachowuje się jak fala stojąca
Studnia potencjału
Fale stojące dla uwięzionego elektronu spełniają warunek:
Równanie fali
2π
y n ( x ) = A sin x
λ
d=
dla fali stojącej:
d=
d = 3λ/2
nλ
2
Funkcje falowe opisujące uwięziony elektron
n = 1, 2, 3K
nπ
ψ n ( x ) = A sin x dla
d
n - jest liczbą kwantową
określającą stan (mod)
d = λ/2
0
d
nπ
ψ 2n ( x ) = A 2 sin 2 x dla n = 1, 2, 3K
d
y1 ( x ) = A sin x
d
2π
y 2 ( x ) = A sin x
d
3π
y 3 ( x ) = A sin x
d
Prawdopodobieństwo znalezienia elektronu w odległości r
od jądra wodoru w stanie podstawowym (n=1)
Orbitę Bohra zastępuje się pojęciem
orbitalu, który oznacza obszar wypełniony
chmurą ujemnego ładunku.
Zasada odpowiedniości (korespondencji):
Dla dostatecznie duŜ
duŜych liczb kwantowych przewidywania
fizyki kwantowej przechodzą
przechodzą w sposó
sposób cią
ciągły w
przewidywania fizyki klasycznej
Prawdopodobieństwo znalezienia
elektronu w odległości r
od jądra wodoru w stanie wzbudzonym
opisanym główną liczbą kwantową n=2
Radialna gęstość prawdopodobieństwa
P(r) dla n = 2, l = 0, ml = 0
Liczby kwantowe dla
atomu wodoru dla n=2
4
2r
P(r ) = 3 r 2 exp −
a
a
Radialna gęstość prawdopodobieństwa
dla stanu podstawowego atomu wodoru
Rozkład gęstości
2
prawdopodobieństwa ψ ( x )
dla stanu podstawowego
atomu wodoru
Prawdopodobieństwo znalezienia elektronu w odległości r
od jądra wodoru w stanie wzbudzonym opisanym główną
liczbą kwantową n>>1
Pierścień kropek sugeruje istnienie klasycznej orbity elektronowej dla atomu
wodoru w stanie kwantowym o stosunkowo duŜej głównej liczbie kwantowej n
n = 1, 2, 3K
Prawdopodobieństwo znalezienia elektronu w punkcie x
nπ
y n ( x ) = A sin x
d
π
d=λ
nλ
2
n
l
ml
2
0
0
2
2
2
1
1
1
+1
0
-1
Radialna gęstość prawdopodobieństwa
P(r) dla n = 2, l = 1
Zakaz Pauliego
Dowolne dwa elektrony w tym samym atomie (lub innego typu pułapce) róŜnią
się co najmniej jedną liczbą kwantową.
W układzie wieloelektronowym (atomie) liczby n, l, ml oraz ms określają
jednoznacznie stan tego układu. śadne z dwóch elektronów w atomie nie
mogą mieć jednakowych wszystkich czterech liczb kwantowych.
Oznaczenia powłok
n = 0
P(r) = ψ 2(r) dla n = 45, l = n -1 = 44
podpowłok
l
1
2
3
4
5
6 ....
K
L
M
N
O
P
Q ....
= 0
1
2
3
4
5
....
s
p
d
f
g
h
Podpowłoce s odpowiada jeden orbital s, natomiast podpowłoka p składa się
z trzech orbitali p o takim samym kształcie, lecz wzajemnie prostopadłych
(px, py oraz pz).
3
Przykłady konfiguracji elektronowej
Neon: Z = 10 → 10 elektronów
M
l = 0 (s)
l = 1 (p)
ml = 0
1
—
0
-1
2
— — —
L
2s2
K
1s2
Chlor: Z = 17 → 17 elektronów
l = 2 (d)
1
0
-1 -2
— — — — —
śelazo: Z = 26 → 26 elektronów
2p6
Dla atomów o większej liczbie elektronów oddziaływania pomiędzy
elektronami powodują powodują, Ŝe w wyniku obsadzenia przez dwa
ostatnie elektrony podpowłoki 4s energia atomu jest niŜsza niŜ w przypadku
Sód: Z = 11 → 11 elektronów
Energia
n
l = 0 (s)
l = 1 (p)
ml = 0
1
M
3s1
L
2s2
K
1s2
0
gdyby znajdowały się na podpowłoce 3d (która moŜe pomieścić 10
l = 2 (d)
-1
2
— — —
1
0
-1 -2
elektronów). Stąd rozkład 26 elektronów na poszczególne podpowłoki
przedstawia się następująco:
— — — — —
1s2 2s2 2p6 3s2 3p6 3d6 4s2
2p6
Widmo promieniowania rentgenowskiego
Widmo charakterystyczne promieniowania rentgenowskiego
Uproszczony diagram poziomów
energetycznych dla atomu
molibdenu z luką (brakującym
elektronem na określonej orbicie)
Widmo dla tarczy molibdenowej bombardowanej
elektronami o energii 35 keV
Względne natęŜenie
1s2 2s2 2p6 3s2 3p5
Ek0 - ∆Ek
widmo
ciągłe
Ek0
padający
elektron
hν = ∆Ek
długość fali (pm)
1. Padający elektron wybija elektron z
powłoki K (powłoki określonej główną
liczbą kwantową n=1)
2. Elektron z powłoki o wyŜszej energii
przeskakuje zapełniając lukę powstałą
na powłoce K emitując „nadmiar energii”
w postaci charakterystycznego fotonu
promieniowania rentgenowskiego
a) jeŜeli elektron przeskakuje z powłoki
n = 2 na powłokę n=1 to emitowane
promieniowanie tworzy linię Kα
b) jeŜeli elektron przeskakuje z powłoki
n = 3 na powłokę n=1 to emitowane
promieniowanie tworzy linię Kβ
granica krótkofalowa
Ek0 = hν = hc/λmin
niezaleŜnie od stosowanego materiału
Energia (keV)
Powłoka
n
Przykłady konfiguracji elektronowej c.d.
λmin= 35.5 pm dla Ek0= 35 keV
Doświadczenie Moseleya
(polegające na badaniu widm charakterystycznych promieniowania
rentgenowskiego róŜnych pierwiastków) wykazało, Ŝe podstawową wielkością
identyfikującą pierwiastek jest ładunek jego jądra (określony liczbą atomową Z).
Foton promieniowania Kα:
∆E = −
ν
13.6 eV
(Z − 1)2 − − 13.26 eV (Z − 1)2
22
1
∆E = hν
(109 Hz0.5)
ν=
10.2 eV
( Z − 1)
h
Liczba atomowa Z
4