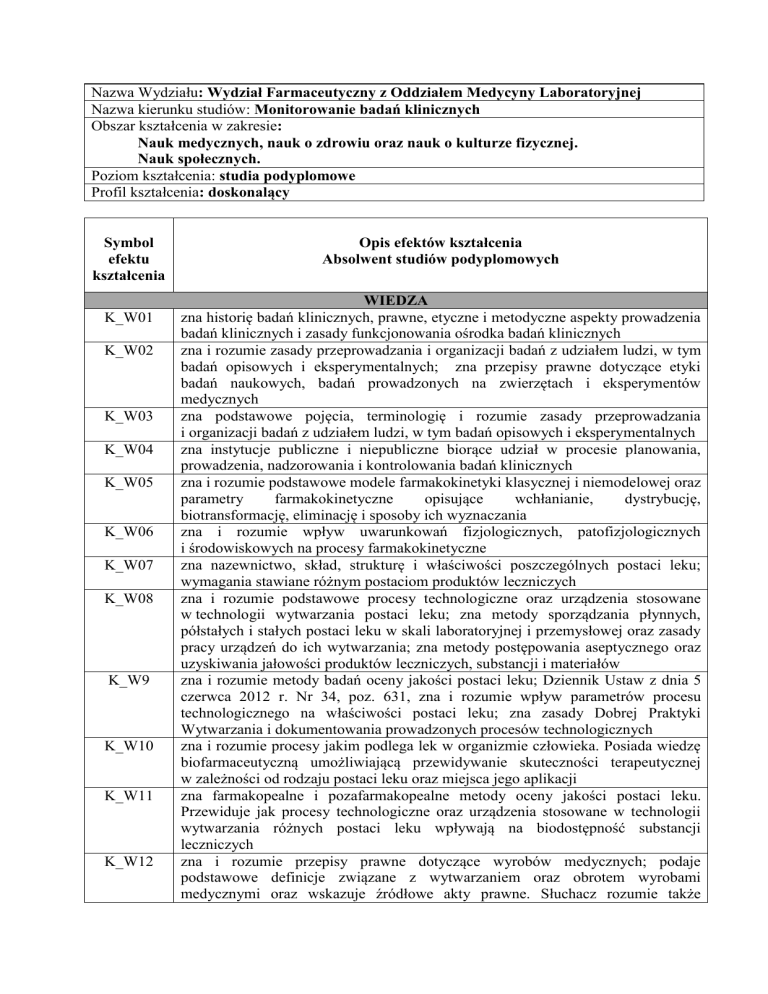
Nazwa Wydziału: Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej
Nazwa kierunku studiów: Monitorowanie badań klinicznych
Obszar kształcenia w zakresie:
Nauk medycznych, nauk o zdrowiu oraz nauk o kulturze fizycznej.
Nauk społecznych.
Poziom kształcenia: studia podyplomowe
Profil kształcenia: doskonalący
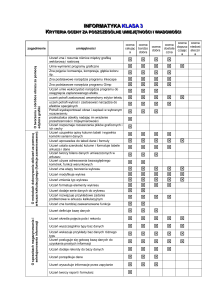
Symbol
efektu
kształcenia
K_W01
K_W02
K_W03
K_W04
K_W05
K_W06
K_W07
K_W08
K_W9
K_W10
K_W11
K_W12
Opis efektów kształcenia
Absolwent studiów podyplomowych
WIEDZA
zna historię badań klinicznych, prawne, etyczne i metodyczne aspekty prowadzenia
badań klinicznych i zasady funkcjonowania ośrodka badań klinicznych
zna i rozumie zasady przeprowadzania i organizacji badań z udziałem ludzi, w tym
badań opisowych i eksperymentalnych; zna przepisy prawne dotyczące etyki
badań naukowych, badań prowadzonych na zwierzętach i eksperymentów
medycznych
zna podstawowe pojęcia, terminologię i rozumie zasady przeprowadzania
i organizacji badań z udziałem ludzi, w tym badań opisowych i eksperymentalnych
zna instytucje publiczne i niepubliczne biorące udział w procesie planowania,
prowadzenia, nadzorowania i kontrolowania badań klinicznych
zna i rozumie podstawowe modele farmakokinetyki klasycznej i niemodelowej oraz
parametry
farmakokinetyczne
opisujące
wchłanianie,
dystrybucję,
biotransformację, eliminację i sposoby ich wyznaczania
zna i rozumie wpływ uwarunkowań fizjologicznych, patofizjologicznych
i środowiskowych na procesy farmakokinetyczne
zna nazewnictwo, skład, strukturę i właściwości poszczególnych postaci leku;
wymagania stawiane różnym postaciom produktów leczniczych
zna i rozumie podstawowe procesy technologiczne oraz urządzenia stosowane
w technologii wytwarzania postaci leku; zna metody sporządzania płynnych,
półstałych i stałych postaci leku w skali laboratoryjnej i przemysłowej oraz zasady
pracy urządzeń do ich wytwarzania; zna metody postępowania aseptycznego oraz
uzyskiwania jałowości produktów leczniczych, substancji i materiałów
zna i rozumie metody badań oceny jakości postaci leku; Dziennik Ustaw z dnia 5
czerwca 2012 r. Nr 34, poz. 631, zna i rozumie wpływ parametrów procesu
technologicznego na właściwości postaci leku; zna zasady Dobrej Praktyki
Wytwarzania i dokumentowania prowadzonych procesów technologicznych
zna i rozumie procesy jakim podlega lek w organizmie człowieka. Posiada wiedzę
biofarmaceutyczną umożliwiającą przewidywanie skuteczności terapeutycznej
w zależności od rodzaju postaci leku oraz miejsca jego aplikacji
zna farmakopealne i pozafarmakopealne metody oceny jakości postaci leku.
Przewiduje jak procesy technologiczne oraz urządzenia stosowane w technologii
wytwarzania różnych postaci leku wpływają na biodostępność substancji
leczniczych
zna i rozumie przepisy prawne dotyczące wyrobów medycznych; podaje
podstawowe definicje związane z wytwarzaniem oraz obrotem wyrobami
medycznymi oraz wskazuje źródłowe akty prawne. Słuchacz rozumie także
K_W13
K_W14
K_W15
K_W16
K_W17
K_W18
K_W19
K_W20
K_W21
K_W22
K_W23
K_W24
K_W25
K_W26
K_W27
K_W28
K_W29
K_W30
K_W31
K_W32
K_W33
K_W34
K_W35
K_W36
znaczenie charakterystyki wyrobu medycznego w optymalizacji terapii
zna podstawowe problemy przedlaboratoryjnej i polaboratoryjnej fazy
wykonywania badań
zna rodzaje i charakterystykę materiału biologicznego, zasady i technikę
pobierania, transportu, przechowywania i przygotowania do analizy
zna prawne, etyczne i metodyczne aspekty prowadzenia badań klinicznych i zasady
funkcjonowania ośrodka badań klinicznych
opisuje proces planowania w kontekście prowadzenia projektu medycznego
posiada podstawową wiedzą o narzędziach planowania w procesie zarządzania
opisuje proces zarządzania ryzykiem w kontekście prowadzenia projektu
medycznego
posiada podstawową wiedzą o narzędziach zarządzania ryzykiem w procesie
zarządzania
rozumie miejsce biotechnologii medycznej w ramach organizacji systemu ochrony
zdrowia jak i znaczenie biotechnologii medycznej w dziedzinie nauk medycznych
potrafi prawidłowo formułować, nazywać i objaśniać przepisy prawa
farmaceutycznego
zna prawne, etyczne i metodyczne aspekty prowadzenia badań klinicznych, zna
rolę farmaceuty w prowadzeniu badań klinicznych
zna zasady odpowiedzialności karnej, cywilnej i z tytułu ubezpieczeń badań
klinicznych
zna przepisy prawne dotyczące etyki badań naukowych, badań prowadzonych na
zwierzętach i eksperymentów medycznych
zna przepisy prawne dotyczące etyki badań naukowych, badań prowadzonych na
zwierzętach i eksperymentów medycznych; zna instytucje publiczne i niepubliczne
biorące udział w procesie planowania, prowadzenia, nadzorowania i kontrolowania
badań klinicznych
zna zasady nadzoru nad bezpieczeństwem farmakoterapii z uwzględnieniem
monitorowania niepożądanych działań leków (pharmacovigilance)
zna podstawowe definicje z zakresu ekonomiki zdrowia i farmakoekonomiki
zna zasady oceny, podziału i dyskontowania kosztów oraz ustalania wielkości
i wartości zużytych zasobów
zna rodzaje oraz etapy analiz farmakoekonomicznych
zna i rozumie wytyczne w zakresie przeprowadzania oceny technologii
medycznych, w szczególności w obszarze efektywności kosztowej i wpływu na
budżet, a także metodykę oceny skuteczności i bezpieczeństwa leków
zna objawy i przyczyny wybranych zaburzeń i zmian chorobowych, a także
dysfunkcji społecznych oraz metody ich oceny w zakresie niezbędnym dla dziedzin
nauki i dyscyplin naukowych, właściwych dla studiowanego kierunku studiów
zna zasady praktyki opartej na dowodach
potrafi przedstawić znaczenie badań dostępności biologicznej i równoważności
biologicznej decydujących o jakości produktu leczniczego oraz skuteczności
i bezpieczeństwie terapii.
zna i rozumie zasady wprowadzania leków generycznych na rynek farmaceutyczny.
Zna wymagania prawne kodyfikujące zasady Dobrej Praktyki Klinicznej
zna metody oceny równoważności farmaceutycznej i biologicznej (korelacja in
vitro–in vitro). Umie wskazać przyczyny odstąpienia od badań biorównoważności
zna zagadnienia dotyczące nowoczesnej farmakoterapii wybranych chorób
cywilizacyjnych oraz chorób wymagających przewlekłego leczenia, w oparciu
K_W37
K_W38
K_W39
K_W40
K_W41
K_W42
K_U01
K_U02
K_U03
K_U04
K_U05
K_U06
K_U07
K_U08
K_U09
K_U10
K_U11
K_U12
K_U13
K_U14
o zasady postępowania medycznego określanego jako medycyna oparta na
dowodach (evidencebasedmedicine), standardy terapeutyczne oraz wytyczne
polskich i europejskich towarzystw lekarskich
zna elementy rachunku prawdopodobieństwa i statystyki matematycznej (zdarzenia
i prawdopodobieństwo, zmienne losowe, dystrybuanta zmiennej losowej, wartość
przeciętna i wariancja), rozkładów zmiennych losowych, estymacji punktowej
i przedziałowej parametrów
zna metody testowania hipotez statystycznych
zna znaczenie korelacji i regresji w badaniach medycznych
tworzy bazy danych oraz korzysta z internetowych baz danych
aktywnie uczestniczy w badaniach klinicznych; zna prawne, etyczne i metodyczne
aspekty prowadzenia badań klinicznych i zasady funkcjonowania ośrodka badań
klinicznych
zna definicję i podział działań niepożądanych, potrafi wskazać czynniki sprzyjające
występowaniu działań niepożądanych
UMIEJĘTNOŚCI
oblicza i interpretuje obliczone z zastosowaniem odpowiednich modeli
farmakokinetycznych wartości parametrów charakteryzujących przejście leku przez
organizm
przewiduje, z uwzględnieniem interakcji farmakokinetycznych, skutki zmian
wartości
parametrów
farmakokinetycznych
uwarunkowane
czynnikami
fizjologicznymi i patologicznymi
dobiera schematy dawkowaniu leków zależne od wieku czy stanów patologicznych
u indywidualnego chorego
interpretuje wyniki uzyskane w zakresie oceny jakości substancji do celów
farmaceutycznych oraz potwierdza zgodność uzyskanych wyników
wylicza i interpretuje współczynniki kosztów i efektywności uzyskane w różnych
typach analiz farmakoekonomicznych i wskazuję procedurę efektywniejszą
kosztowo
określa wpływ nowej technologii medycznej na budżet systemu ochrony zdrowia
potrafi prezentować i wyjaśniać problemy z zakresu ochrony zdrowia w sposób
dostosowany do przygotowania osób oraz grup docelowych
zna i rozumie zasady dopuszczania do obrotu wyrobów medycznych, potrafi
zróżnicować kategorie dostępności wyrobów medycznych oraz potrafić omówić
podstawowe zasady gospodarki wyrobami medycznymi; wskazuje wyroby
medyczne wymagające specjalnych warunków przechowywania
potrafi wskazać instytucje publiczne odpowiedzialne za kontrolę i nadzorowanie
działalności jednostek w zakresie wytwarzania oraz prowadzenia obrotu hurtowego
i detalicznego wyrobami medycznymi; przygotowuje informację szczegółową
dotyczącą warunków przechowywania wyrobów medycznych
wskazuje na właściwy sposób postępowania z wyrobami medycznymi w czasie ich
używania, opisuje etapy postępowania z wyrobami medycznymi w kanele
dystrybucji
potrafi zaplanować właściwe pomiary i analizy w prowadzonej procedurze
badawczej
wykazuje pogłębione umiejętności prognozowania i wnioskowania na podstawie
danych uzyskanych z różnych źródeł oraz przeprowadzonych analiz
potrafi analizować uzyskiwane wyniki badań i formułować odpowiednie wnioski
wykorzystuje metody matematyczne w opracowaniu i interpretacji wyników analiz
K_U15
K_U16
K_U17
K_U18
K_U19
K_U20
K_U21
K_U22
K_U23
K_U24
K_K01
K_K02
K_K03
K_K04
K_U05
K_U06
K_U07
K_U08
i pomiarów
stosuje metody statystyczne do opracowania danych z badań, ocenia rozkład
zmiennych losowych, wyznacza średnią, medianę, przedział ufności, wariancje
i odchylenia standardowe, formułuje i testuje hipotezy statystyczne oraz dobiera
i stosuje metody statystyczne w opracowywaniu wyników obserwacji i pomiarów
stosuje techniki komputerowe do interpretacji wyników analizy i zebrania
informacji o leku
posiada umiejętność zastosowania narzędzi wspierających proces planowania
w projekcie medycznym
posiada umiejętność zastosowania narzędzi wspierających proces zarządzania
ryzkiem w projekcie medycznym
wykorzystuje narzędzia informatyczne do opracowywania i przedstawiania
wyników doświadczeń
interpretuje wyniki badań epidemiologicznych
potrafi pracować w grupie, jest kreatywny i otwarty w organizowaniu i podziale
pracy w grupie podczas wspólnych prac nad opracowaniem zagadnień
potrafi opracować pisemnie wyniki badań z użyciem poprawnej terminologii
stosowanej w naukach medycznych
posiada umiejętność wykorzystania literatury przedmiotu i nabytej w trakcie
studiów wiedzy w procesie planowania i realizacji działań badawczych
korzysta z różnych źródeł informacji o lekach, w tym w języku angielskim,
i krytycznie interpretuje te informacje
KOMPETENCJE SPOŁECZNE
potrafi przedstawić argumenty dotyczące konieczności stosowania zasad
planowania w projekcie medycznym
potrafi przedstawić argumenty dotyczące konieczności stosowania metod
zarządzania ryzykiem w projekcie medycznym
wyciąga i formułuje wnioski z własnych pomiarów i obserwacji
potrafi wykorzystywać znajomość prawa farmaceutycznego w zapobieganiu
występowania zdarzeń niepożądanych
ma świadomość potrzeby uzupełniania wiedzy specjalistycznej przez całe życie
oraz potrafi dobrać właściwe źródła wiedzy i metody uczenia dla siebie i innych
ma świadomość ważności postępowania profesjonalnego oraz przestrzegania zasad
etyki zawodowej
ma świadomość odpowiedzialności związanej z decyzjami podejmowanymi
w ramach działalności zawodowej, szczególności w kategoriach bezpieczeństwa
własnego i innych osób
potrafi formułować opinie dotyczące różnych aspektów działalności zawodowej