Chemiczne procesy biotechnologiczne
PODSTAWY BIOTECHNOLOGII
Sala 2.64 wtorek
godz. 10.30-12.00
Prof. dr hab. Marek Łaniecki
Zakład Kinetyki i Katalizy
www.kik.amu.edu.pl
krówka
1410 – ?
1605 – ?
Program wykładów
1. Komórka (bakterie, drożdże)
2. Enzymy – katalizatory biologiczne
3. Metabolizm komórkowy i sposoby pozyskiwania
energii
4. Wytwarzanie wina i piwa
5. Biologiczne oczyszczanie ścieków
6. Biopaliwa
7. Związki biologicznie czynne (aminokwasy,
antybiotyki)
BIOTECHNOLOGIA – dyscyplina nauk technicznych
wykorzystująca procesy biologiczne na skalę przemysłową
BIOTECHNOLOGIA – interdyscyplinarna dziedzina
nauki wykorzystująca systemy biologiczne, komórki
mikroorganizmów, części komórki lub ich molekularne
analogi dla uzyskania określonych produktów
BIOTECHNOLOGIA – zastosowanie technologiczne
systemów biologicznych, organizmów żywych lub ich
składników do wytwarzania lub modyfikowania
produktów lub procesów do określonego zastosowania
Podział
Biała biotechnologia – systemy biologiczne w produkcji przemysłowej i
ochronie środowiska (np. fermentacja, „bioleaching”, bioremediacja, broń
biologiczna)
Zielona biotechnologia – rolnictwo (transgeniczne rośliny i zwierzęta)
Czerwona biotechnologia – ochrona zdrowia (biofarmaceutyki, diagnostyka
genetyczna, genoterapia, transplantologia, GMO)
Fioletowa biotechnologia - ustawodawstwo
Biotechnologia zwierząt
Biotechnologia roślin
Biotechnologia żywności
Tradycyjna – naturalne enzymy i organizmy bez obcego materiału
genetycznego
Nowoczesna – organizmy, enzymy, białka zmodyfikowane genetycznie
EuropaBio
A. Chmiel, Biotechnologia. Podstawy mikrobiologiczne i biochemiczne, PWN, Warszawa, 1998.
Stanley Miller exp.1954
Nobel - 1989
„Prebiotyczna zupa”
4.5 mld –Ziemia
3.7 mld- sub.org.
3.0 mld-fotosyn-
CH4 CO2 NH3
teza
H2
H2O
UV
Q
CH3COOH
CH3CH2OHCOOH
NH2-CO-NH2
NH2CH2COOH
NH2CH2(CH3)COOH
NH2-CH2(CH2COOH)COOH
kwas octowy
kwas mlekowy
mocznik
glicyna
alanina
kwas asparaginowy
Panspermia
Komórka
„najprostsza” forma życia
Schemat komórki bakterii
Rozmiar - 0.2 do kilkudziesięciu mikrometrów
Rozpowszchnienie – 1g gleby= 40mln
1 ml H2O = 1mln
Ziemia – 5x1030 = pięć kwintylionów
P. Singleton, Bakterie w biologii, biotechnologii i medycynie, PWN, 2000, Warszawa.
Eukariota (jądro)
Prokariota (brak jądra)
Przybliżony skład chemiczny typowej komórki bakterii i
komórki ssaka
Procent całkowitej wagi komórki
Składnik
Bakteria
E. coli
Komórka ssaka
H 2O
Jony nieorganiczne (Na+, K+,
Mg2+, Ca2+, Cl- )
Małe metabolity
Białka
RNA
DNA
Fosfolipidy
Inne lipidy
Polisacharydy
70
1
70
1
3
15
6
1
2
2
3
18
1.1
0.25
3
2
2
Całkowita objętość komórki
Względna objętość komórki
2 x 10-12 cm3
1
4 x 10-9 cm3
2000
B. Alberts, D. Bray, J.Lewis, M. Raff, K. Roberts, J.D.Watson, Molecular Biology of the Cell,
Garland Publishing Inc. 1983, NY/London
1 nm = 0,001 μm
Gronkowiec złocisty (Staphylococcus aureus)
Formy bakterii
gronkowce
pakietowce
paciorkowce
dwoinki
pałeczki
laseczki
średnia wielkość :
0.75 - 2.0 µm
przecinkowce
śrubowce
krętki
srednia wielkość :
0.2(1.0) do 60-80 µm
Podział bakterii ze względu na źródła energii
i węgla
Chemoorganotrofy (heterotrofy)
źródło węgla i energii: substraty organiczne np. cukry, kwasy
tłuszczowe, alkohole
Chemolitotrofy (autotrofy)
źródło energii: substraty nieorganiczne np. S2-, So, H2, Fe2+,
NH3
źródło węgla: utlenione związki węgla np. CO2, węglany
Fototrofy (autotrofy lub heterotrofy)
źródło energii: światło
źródło węgla – CO2 lub substraty organiczne
Budowa komórki drożdży
CYTOLOGIA
Badania morfologii i
działania strukturalnych
składników komórki.
1. Błona komórkowa
2. Cytoplazma z organellami
3. Jądro
4. Membrana z
chromosomami
Drożdże
Saccharomyces – rodzaj z rodziny drożdżowatych - grzyby
jednokomórkowe o komórkach kulistych, jajowatych lub walcowatych.
Wielkość – od 1 do 10 mikrometrów
Rozmnażanie – przez pączkowanie ( w niesprzyjających warunkach
rozmnażanie płciowe)
Około 200 gatunków z dużą liczbą odmian.
Fermentacja dolna
Fermentacja górna
a. Piwowarskie
b. Winiarskie
c. Piekarnicze
d. Gorzelnicze
Spożywcze i paszowe
Królestwo – grzyby
Typ
- woreczniaki
Rodzaj
- drożdże
Elementy komórki
Cytoplazma - ciecz, w której zawieszone są wszystkie struktury komórki
oraz składniki pokarmowe, jony, enzymy, produkty przemiany materii.
Nukleoid (chromosom) - zwinięta w ścisłą strukturę nić DNA o długości
około 1mm, połączona z cząsteczkami RNA i białkami. Zawiera komplet
informacji genetycznej.
Plazmid – pozachromosomowy fragment DNA, zazwyczaj o kształcie
kolistym, zdolny do niezależnej replikacji. Koduje różne przydatne komórce
funkcje jak np. oporność na antybiotyki.
Rybosom – zbudowany jest z dwóch podjednostek: dużej (50S) i małej
(30S). Zawiera rRNA (70%) i białka (30%). Jego rolą jest odczytanie kodu
genetycznego i kontrola syntezy białek.
Substancje zapasowe – poli-β-hydroksymaślan (PHB), glikogen,
polifosforany. Synteza oraz magazynowanie PHB i glikogenu zachodzi, gdy
obecne jest źródło węgla przy jednoczesnym deficycie azotu, siarki. Synteza
polifosforanów ma miejsce w warunkach aerobowych przy nadmiarze
fosforanów w środowisku.
Chromatofory – organelle komórkowe zawierające chlorofil i karotenoidy.
U cyjanobakterii i bakterii fotosyntetyzujących zwane są tylakoidami. Mają
formę pęcherzyków lub spłaszczonych, warstwowo ułożonych błon i połączone
są z błoną cytoplazmatyczną. Biorą udział w fotosyntezie.
Wakuole gazowe – występują u niektórych prokariotów np. cyjanobakterii.
Składają się z drobnych, wypełnionych gazem pęcherzyków. Wpływają na
gęstość komórek i pozwalają zwiększyć dostęp światła.
Karboksysomy – wewnątrzkomórkowe struktury błonowe u bakterii
autotroficznych. Zawierają enzym RuBisCo biorący udział w wiązaniu
atmosferycznego CO2.
Osłony komórkowe - błona cytoplazmatyczna , ściana komórkowa,
błona zewnętrzna, warstwy zewnątrzkomórkowe (otoczki lub śluz).
Narządy ruchu - rzęski lub wici, umożliwiają poruszanie się w kierunku
substancji odżywczych i ucieczkę przed substancjami toksycznymi.
Autotrofy – bakterie samożywne
Heterotrofy – org. cudzożywne
Funkcje ściany komórkowej i błony
komórkowej
nadają kształt i zabezpieczają przed ciśnieniem osmotycznym,
są miejscem, w którym przebiega wiele reakcji,
uczestniczą w przekazywaniu sygnałów do wnętrza komórki,
są głównymi elementami systemu transportu i magazynowania
energii,
regulują przemieszczanie się substancji między komórką,
a środowiskiem zewnętrznym: są przepuszczalne dla cząstek
hydrofobowych ( N2 , O2 , węglowodorów) i małych cząstek
polarnych (H2O, CO2, gliceryny, mocznika), a nieprzepuszczalne
dla aminokwasów, HCO3-, Ca2+, K+, Cl-, Mg2+.
Budowa osłon komórkowych
15-50 nm
2-10 nm
E.P.Solomon, L.R.Berg, D.W.Martin,C.A.Villee, Biologia, Multico Oficyna Wydawnicza, 1996, Warszawa.
lipidy-tłuszcze
Poryny – kanały
( 2-3 nm średnicy)
Liposacharydy – G-ujemne
Metoda Grama –fiolet krystaliczny
Błona cytoplazmatyczna
B. Alberts, D. Bray, K. Hopkin, A. Johnson, J.Lewis, M. Raff , K. Roberts, P. Walter,
Podstawy biologii komórki, cz 1-2, PWN, 2007, Warszawa.
Rodzaje białek błonowych
Białka transportujące - przenoszą określone substancje odżywcze,
metabolity i jony przez dwuwarstwę lipidową.
Białka kotwiczące - łączą błonę komórkową z makrocząsteczkami po
obu stronach błony.
Receptory – wykrywają sygnały chemiczne w otoczeniu komórki
i przekazują informacje do wnętrza komórki.
Enzymy – katalizują określone reakcje biochemiczne.
Sposoby wiązania białek błonowych z
błoną cytoplazmatyczną
B. Alberts, D. Bray, K. Hopkin, A. Johnson, J.Lewis, M. Raff , K. Roberts, P. Walter,
Podstawy biologii komórki, cz 1-2, PWN, 2007, Warszawa.
Rodzaje transportu przez błony komórkowe
dyfuzja bierna –zachodzi zgodnie z gradientem stężenia, bez udziału
energii (transport CO2, O2),
dyfuzja ułatwiona - zachodzi zgodnie z gradientem stężenia, bez
zużycia energii, ale z udziałem swoistych białek błonowych, np.
transport wody przez akwaporyny,
transport aktywny – przebiega wbrew gradientowi stężeń;
prowadzony jest z nakładem energii z udziałem białek
transportowych,
pierwotny transport aktywny – wyrzucenie protonów na zewnątrz
błony cytoplazmatycznej przy użyciu energii uzyskanej z hydrolizy
ATP, absorpcji fotonu lub przepływu elektronów w procesach
oddechowych (wytworzenie siły protonomotorycznej),
wtórny transport czynny – siła protonomotoryczna napędza
transport różnych cząsteczek lub jonów przez błonę, przy udziale
białek (permeaz).
Sposoby transportu cząsteczek i jonów
B. Alberts, D. Bray, K. Hopkin, A. Johnson, J.Lewis, M. Raff , K. Roberts, P. Walter,
Podstawy biologii komórki, cz 1-2, PWN, 2007, Warszawa.
Klasy białek transportujących
Nośniki – wiążą rozpuszczoną substancję po jednej stronie błony i
przenoszą ją na drugą stronę– towarzyszy temu zmiana konformacji
nośnika. Są bardzo selektywne.
Pompy – białka transportujące daną substancję przez błonę z jednoczesnym
wykorzystaniem energii (pompa protonowa).
Kanały jonowe – małe hydrofilowe pory, przez które substancja może
przechodzić na drodze dyfuzji. Rozpoznanie cząsteczki transportowanej
następuje na podstawie jej wielkości i ładunku elektrycznego.
Przepływ jonów zmienia napięcie w po obu stronach błony (potencjał
błonowy).
Pompa protonowa
Energia
konformacji
białka
NASTĘPNY
CYKL
B. Alberts, D. Bray, K. Hopkin, A. Johnson, J.Lewis, M. Raff , K. Roberts, P. Walter,
Podstawy biologii komórki, cz 1-2, PWN, 2007, Warszawa.
Wzrost bakterii
Komórki bakterii mogą rosnąć i dzielić się, żyjąc pojedynczo lub w koloniach.
Czas podwojenia liczby komórek (generacji) - czas konieczny do przebiegu
pełnego cyklu komórkowego. Jego długość waha się od kilku minut do kilku
tygodni.
Podłoża (pożywki) do hodowli bakterii:
stałe (żel agarowy),
płynne.
Rodzaje hodowli:
okresowe – po pewnym czasie następuje wyczerpanie substancji
odżywczych i nagromadzenie toksycznych produktów,
ciągłe – systemy przepływowe, do których w sposób ciągły wprowadza się
świeże podłoże i usuwa jednocześnie jego nadmiar, utrzymując stały poziom
płynu hodowlanego. Po pewnym czasie układ osiąga homeostazę.
Typowa krzywa wzrostu okresowej hodowli bakterii
Warunki wzrostu bakterii
substraty odżywcze: CO2, NH3, alkohole, węglowodory,
węglowodany, sole nieorganiczne, ( źródło C, N, P, S, H, O ),
woda
energia
temperatura:
0 - 15oC psychrofile,
15 - 45oC mezofile,
45 - 105oC termofile
pH:
tlen:
0.8 - 4 acydofile,
ok. 7.0 większość bakterii,
8 - 9.5 alkalofile
- tlenowce – tlen jest niezbędny do ich wzrostu,
- beztlenowce – rosną tylko w warunkach, w których nie ma
tlenu
- względne beztlenowce - mogą rosnąć w obecności tlenu lub
w warunkach beztlenowych
Warunki wzrostu bakterii
substraty odżywcze: CO2, NH3, alkohole, węglowodory,
węglowodany, sole nieorganiczne, ( źródło C, N, P, S, H, O ),
woda
energia
temperatura:
0 - 15oC psychrofile,
15 - 45oC mezofile,
45 - 105oC termofile
pH:
tlen:
0.8 - 4 acydofile,
ok. 7.0 większość bakterii,
8 - 9.5 alkalofile
- tlenowce – tlen jest niezbędny do ich wzrostu,
- beztlenowce – rosną tylko w warunkach, w których nie ma
tlenu
- względne beztlenowce - mogą rosnąć w obecności tlenu lub
w warunkach beztlenowych
Enzymy
katalizatory biologiczne
Kataliza – zjawisko
polegające na obniżeniu energii aktywacji reakcji i
zwiększeniu szybkości reakcji chemicznej i/lub skierowaniu reakcji na
jedną z termodynamicznie możliwych dróg prowadzące do różnych
produktów, w obecności niewielkich ilości substancji zwanych
katalizatorami.
KATALIZA
heterogeniczna
homogeniczna
enzymatyczna
Katalizator – substancja obniżająca energię aktywacji reakcji,
oddziaływuje chemicznie z substratami reakcji, tworzy nietrwałe
połączenia przejściowe, nie jest zużywana w reakcji i nie występuje w
równaniu stechiometrycznym
Enzymy- wielkocząsteczkowe, w większości białkowe, biokatalizatory przyspieszające specyficzne reakcje
chemiczne
Enzymy nie zmieniają końcowego składu mieszaniny reagującej ani stałej równowagi
Jedynie przyspieszają osiągnięcie stałej równowagi w reakcjach termodynamicznie możliwych
H2O2 +H2O2
O2 + 2H2O
katalaza
ROLA ENZMÓW
•Zwiększenie lokalnego stężenia substratów
•Tworzenie kompleksów multienzymatycznych
•Zabezpieczenie odpowiedniej orientacji przestrzennej substratom
•Stabilizacja stanów przejściowych, czyli obniżenie energii swobodnej aktywacji
Rys. obniżenie energii aktywacji
Rys porównania szybkości zdarzeń
Budowa enzymu
jon metalu
białko
apoenzym
kofaktor
koenzym
Jony metali
Zn2+ - anhydraza węglanowa
Mg2+ - fosfatazy
Mn2+ - fosfotransferazy
Cu+/2+ , Mo2+ - oksydoreduktazy
Fe2+/3+, Ca2+ - amylazy
Koenzymy
alifatyczne - glutation
aromatyczne - ubichinony
heterocykliczne - pochodne witaminy B1
nukleotydy i nukleozydy - NAD+, NADP+
żelazowo-porfirynowe – cytochromy
Struktura enzymu
na przykładzie plastocyjaniny
Jon miedzi związany koordynacyjnie poprzez atomy azotu
lizozym
Zamek-klucz
Inhibicja emzymatyczna
Acetylocholinosteraza procesy w układach nerwowych
Rodzaje inhibicji enzymów
kompetycyjna – inhibitor reaguje z wolną formą enzymu, w wyniku czego
nie jest możliwe przyłączenie substratu do enzymu związanego
z inhibitorem (rys. a) ,
niekompetycyjna – inhibitor reaguje z kompleksem enzym-substrat (ES),
zmieniając jego aktywność, ale nie zmieniając powinowactwa enzymu
do substratu (rys. b),
mieszana – (połączona kompetycyjna i niekompetycyjna) inhibitor może
wiązać się zarówno z wolnym enzymem, jak i z kompleksem ES (rys. c).
a)
b)
c)
W.Bednarski, J.Fiedurek, Podstawy biotechnologii przemysłowej, WNT, Warszawa, 2007.
Klasyfikacja enzymów
1. OKSYDOREDUKTAZY - reakcje red-ox
2. TRANSFERAZY - przenoszenie grup funkcyjnych
3. HYDROLAZY - reakcje hydrolizy
4. LIAZY - przyłączanie do podwójnych wiązań
5. IZOMERAZY - reakcje izomeryzacji
6. LIGAZY (SYNTETAZY)- tworzenie wiązań z równoczesnym
oderwaniem grup fosforanowych z ATP
Oznaczanie enzymów
(na przykładzie dehydrogenazy alkoholowej: 1.1.1.1 i lipazy: 3.1.1.3.)
1.1.1.1.
(nazwa potoczna)
Oksydoreduktaza alkoholu:NAD+ (nazwa systematyczna)
Dehydrogenaza alkoholowa
1. (pierwsza cyfra) – oznacza oksydoreduktazę
1. (druga cyfra) – oznacza enzym działający na ugrupowanie
CH-OH
1. (trzecia cyfra) – oznacza, że przenośnikiem elektronów jest
NAD+:
1. (czwarta cyfra) – oznacza pierwszy enzym w tej grupie
CH3CH2OH + NAD+ CH3CHO + NADH +
H+
3.1.1.3.
Lipaza
3. (pierwsza cyfra) - oznacza hydrolazę
1. (druga cyfra) - oznacza, że enzym działa na wiązanie estrowe,
czyli katalizuje hydrolizę tłuszczów, podczas której tworzą
się kwasy tłuszczowe
1. (trzecia cyfra) - oznacza, że enzym działa na estry kwasów
karboksylowych
3. (czwarta cyfra) - oznacza trzeci enzym w tej grupie
Rola enzymu – obniżenie energii aktywacji
i przyspieszenie procesu biochemicznego
H2O + CO2 HCO3- + H+
105 cząsteczek CO2 / s
107 razy szybciej niż reakcja nie katalizowana)
(
Właściwości enzymu
Enzym obniża energię aktywacji reakcji i zwiększa jej prędkość:
np. reakcja
H2 O + CO2
HCO3- + H+ katalizowana przez
karboksylazę zachodzi z prędkością 105 cząsteczek / sek, czyli 107 razy
szybciej niż reakcja nie katalizowana.
Enzymy charakteryzują się wysoką specyficznością względem substratu
(czasami absolutną) i względem katalizowanej reakcji chemicznej.
Reakcja katalizowana zachodzi w miejscu zwanym miejscem aktywnym
enzymu – czyli w obszarze, który wiąże substrat. Oddziaływanie enzymu
i substratu sprzyja tworzeniu stanu przejściowego o obniżonej energii
swobodnej.
Ogólna charakterystyka miejsca aktywnego enzymu
miejsce aktywne to szczelina lub zagłębienie utworzone przez grupy
pochodzące z różnych części łańcucha aminokwasowego,
miejsce aktywne zajmuje stosunkowo małą część całkowitej objętości
cząsteczki enzymu,
wiązanie substratu z enzymem zachodzi dzięki wielu słabym
oddziaływaniom takim jak wiązanie elektrostatyczne, wodorowe, siły van
der Waalsa, interakcje hydrofobowe,
specyficzność wiązania zależy od precyzyjnego, określonego ułożenia
atomów w miejscu aktywnym - substrat musi mieć odpowiedni kształt,
pasujący do miejsca aktywnego:
• model klucza i zamka,
• model indukowanego dopasowania enzymu z substratem.
Wielopoziomowa regulacja działania enzymów
regulacja ekspresji genu kodującego dany enzym,
kontrola aktywności enzymatycznej poprzez umiejscowienie grup
współpracujących ze sobą enzymów w określonych miejscach
komórki,
regulacja zmiany aktywności enzymu przez pewne cząsteczki,
(cząsteczka inna niż substrat wiąże się w specjalnym miejscu
regulatorowym, odmiennym od miejsca aktywnego, zmieniając szybkość
przekształcania substratu w produkt).
: inhibicja pierwszego enzymu w szlaku
metabolicznym przez odwracalne wiązanie produktu końcowego
Sprzężenie zwrotne
Schemat allosterycznych oddziaływań między enzymem i substratem
Przyłączenie cząsteczki w jednym miejscu enzymu prowadzi do zmian
konformacyjnych przenoszonych w odległe miejsca cząsteczki enzymu.
Konformacje te różnią się aktywnością.
Funkcje enzymu
stwarzają odpowiednie warunki reakcji: wiążą w sposób specyficzny
substraty, zwiększają ich lokalne stężenie, zabezpieczają ich
odpowiednią orientację, tworzą kompleksy multienzymatyczne,
przyspieszają reakcje stabilizując stany przejściowe przez obniżenie
energii swobodnej aktywacji,
enzymy allosteryczne biorą udział w przekazywaniu informacji
i pełnią funkcje regulatorowe,
przekształcają jeden rodzaj energii w drugi (np.ATPaza).
Zastosowanie enzymów
syntezy antybiotyków, leków steroidowych, aminokwasów,
biotransformacje:
• przemysł spożywczy (procesy fermentacyjne),
• przemysł chemiczny,
• przemysł włókienniczy (półprodukty do produkcji tworzyw sztucznych),
• analityka medyczna,
• rolnictwo (pasze, środki ochrony roślin).
Kinetyka reakcji enzymatycznych
Równanie Michaelisa - Menten
k1
k3
E S ES E P
k2
V k3 ES
W stanie równowagi:
k1 E S k 2 k 3 ES
ES
k1
E S
k2 k3
k2 k3
KM
k1
ES E S 1
KM
Gdy
[E]<< [S]
to
[S]=[S]całk i [E]=[E]całk – [ES]
ES 1 S E calk ES
kM
ES E calk
V k3E calk
S
S K M
S
S K M
dla [S] << KM
S
V
V max
KM
dla [S] >> KM
V=Vmax
Zależność początkowej szybkości reakcji enzymatycznej
od stężenia substratu
Wyznaczanie stałych KM i V
Równanie
Lineweavera – Burke’a
Wartości KM niektórych enzymów
enzym
β-Galaktozydaza
anhydraza węglanowa
karboksylaza
pirogronianowa
syntetaza arginylo-tRNA
substrat
KM(μM)
laktoza
4000
CO2
8000
pirogronian
HCO3ATP
400
1000
60
arginina
tRNA
3
0.4
L.Streyer, Biochemia, PWN Warszawa, 2000.
Metabolizm komórkowy
i sposoby uzyskiwania energii
Metabolizm – całokształt reakcji chemicznych i związanych z
nimi przemian energii zachodzący w komórkach. Podstawa
wszelakich zjawisk biologicznych.
Metabolizm komórkowy
anabolizm
procesy biosyntezy złożonych
cząsteczek, wymagające
dostarczenia energii
katabolizm
procesy rozkładu dużych
cząsteczek organicznych,
dostarczające energię
Energia pozyskana z rozkładu tylko częściowo zamieniana jest w
pracę. Jest to tzw. energia swobodna (reszta rozpraszana jest w
postaci ciepła).
Energia swobodna wykorzystywana jest w syntezie, transporcie
czy ruchu cząsteczek.
Szlaki metaboliczne
Sposoby wykorzystywania
energii
Sposoby magazynowania
energii
aktywny transport substancji
przez błony
wzrost
rozmnażanie
ruch
odpowiedź na bodźce
utrzymanie homeostazy
ATP - adenozynotrifosforan
FAD - dinukleotyd flawinoadeninowy
NAD - dinukleotyd
nikotynoamidoadeninowy
NADP - fosforan dinukleotydu
nikotynamidoadeninowego
pompa protonowa
Podział bakterii ze względu na źródła energii
i węgla
Chemoorganotrofy (heterotrofy)
źródło węgla i energii: substraty organiczne np. cukry, kwasy
tłuszczowe, alkohole
Chemolitotrofy (autotrofy)
źródło energii: substraty nieorganiczne np. S2-, So, H2, Fe2+,
NH3
źródło węgla: utlenione związki węgla np. CO2, węglany
Fototrofy (autotrofy lub heterotrofy)
źródło energii: światło
źródło węgla – CO2 lub substraty organiczne
ATP – adenozynotrójfosforan
(adenosine triphosphate)
ADP – adenozynodwufosforan
(adenosine diphosphate)
NAD+ - dwunukleotyd nikotynoamidoadeninowy
(forma utleniona)
NADH – dwunukleotyd nikotynoamidoadeninowy
(forma zredukowana)
ADP - forma uniwersalnego komórkowego nośnika energii ATP w postaci
„rozładowanej”. Zawiera niewielką ilość energii do reakcji biochemicznych.
ATP- adenozynotrifosforan. Uniwersalny nośnik i przekaźnik energii w
komórkach. W typowej reakcji przekazania energii, krańcowa grupa
fosforanowa ATP przyłącza się do cząsteczki innej substancji, przenosząc z
sobą większość energii zawartej w wiązaniu chemicznym, którym była
pierwotnie połączona w cząsteczce ATP. W wyniku tej rakcji powstaje ADP, z
którego na ogół odtwarza się ATP.
NAD+ (NADH)- dinukleotyd amidoadeninowy. Koenzym wykorzystywany w
procesach metabolicznych w komórkach jako akceptor lub donor protonu.
NAD+ bierze udział w reakcjach katabolicznych, w tym w oddychaniu
komórkowym.
NADP+(NADPH) –fosforan dinukleotydu nikotynoamidoadeninowego.
Koenzym wykorzystywany w komórkach jako akceptor lub donor protonu.
Bierze udział w reakcjach anabolicznych , w tym w fotosyntezie.
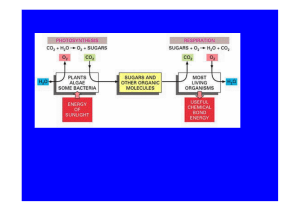
Sposoby uzyskiwania energii
fotosynteza - energia światła absorbowana przez barwniki
(bakteriochlorofile i karotenoidy) zostaje przetworzona w siłę
protonomotoryczną lub energię chemiczną,
fermentacja – substrat jest metabolizowany bez udziału
zewnętrznego (egzogennego) czynnika utleniającego.W wyniku
tego procesu powstają proste związki oraz energia,
oddychanie tlenowe (respiracja) – substrat organiczny jest
przekształcany z udziałem zewnętrznego czynnika utleniającego:
tlenu, do wody i dwutlenku węgla. Energia wiązań zostaje
przekształcona w ATP,
oddychanie beztlenowe – podobnie jak w oddychaniu tlenowym
następuje utlenienie substratu organicznego lecz rolę zewnętrznych
akceptorów elektronów pełnią azotany, siarczany lub fumarany.
Fotosynteza
Fotosynteza – seria złożonych reakcji przekształcających energię
świetlną w energię chemiczną. Process odbywa się w organellach
zwanych chloroplastami
Fotosystemy
Budowa - kompleks antenowy zbierający światło, zawierający setki
cząsteczek pigmentów absorbujących światło (karoteny, chlorofil lub
bakteriochlorofil) oraz centrum aktywne, w którym znajdują się dwie
specjalne cząsteczki chlorofilu.
Rola - zbieranie energii świetlnej i przekształcenie jej w energię
chemiczną.
LHC I i LHC II – light harvesting complex
Chloroplasty
Przestrzeń międzybłonowa w komórce
Stroma
Tylakoidy
Przemiany chemiczne węgla
•Białka zbierające swiatło
•Centra reakcji
•Łańcuch transportu elektronów
•Syntaza ATP
Centrum reakcji i kompleksy zbierające światło, widok prostopadły do
płaszczyzny błony komórkowej (góra) i z boku (dół). Kolor niebieski – LH2,
kolor zielony – LH1, kolor żółty – centrum reakcji.
Fotosynteza oksygenowa ( z wytworzeniem tlenu)
(w algach i cyjanobakteriach fotosystemy współdziałają ze sobą)
-600
h
P700*
e-
Ferredoksyna
Potencjał oksydacyjno-redukcyjny (mV)
h
e-
e-
P680*
NADP+
0
ePlastochinon
światło
2H+
(ze środowiska)
e-
Kompleks
cytochromów
ADP+Pi
Plastocyjanina
+400
ATP
eświatło
eP680
Fotosystem II
+1000
H2O
½ O2 + 2H+
P700
Fotosystem I
NADPH
Światło powoduje wyrzucenie z chlorofilu w fotosystemie PSII
elektronu o dużej energii, który przesuwa wzdłuż łańcucha
transportu elektronów. Powoduje to powstanie siły
protonomotorycznej po obu stronach błony. Energia ta następnie
zostaje wykorzystana do syntezy ATP (proces fotofosforylacji).
Elektrony z fotosystemu PSI redukują NADP. Utleniony chlorofil w
fotosystemie PSII pobiera elektrony pochodzące z rozkładu wody.
Towarzyszy temu wydzielenie się cząsteczki tlenu.
W reakcjach niezależnych od światła (reakcje ciemne) energia
pochodząca z fotosyntezy wykorzystana jest do syntezy związków
węgla z CO2.
Fotosynteza anoksygenowa (bez wytworzenia tlenu)
w bakteriach fotosyntetyzujących
Widmo błony bakterii R. sphaeroides z zaznaczonymi chromoforami: Car –
karotenoidy, LH1 – kompleks zbierający światło , RC – centrum reakcji,
Bpheo –bakteriofeofityna, Bchl – bakteriochlorofil..
Kim, E.-J., et al., International Journal of Hydrogen Energy, 2003. 31: p. 531-538
Bakteriochlorofil b
Schemat fotosyntezy z udziałem bakterii fotosyntetyzujących
-1000
(bakteriochlorofil)*
2
h
Potencjał oksydacyjno-redukcyjny (mV)
bakteriofeofityna
-500
Ubichinon
ADP+Pi
0
światło
Kompleks
cytochromu bc1
ATP
cyt c2
+500
Pul
a
UQ
(bakteriochlorofil)
2
atp
nikotynazmide
Budowa NAD+ i NADH
Fermentacja
Rodzaje fermentacji
etanolowa
mlekowa
propionowa
mrówczanowa
masłowa
metanowa
mieszana
Fermentacja alkoholowa
C6H12O6
ATP + H2O
2C2H5OH + 2CO2 + 40 kcal
ADP + Pi – 7.3 kcal
7.3 kcal
1ATP
14.6 kcal
2ATP
40 -14.6
25.4 kcal (ciepło)
Glikoli
za duza
Glikoliza gora
Glikolza dól
Glikoliza (szlak Embdena-Meyerhofa-Parnasa)
glukoza + 2ATP + 4ADP + 2NAD pirogronian + 2ADP + 4ATP + 2NADH
Bilans netto: 2 NADH i 2ATP
Fermentacja kwasów mieszanych
Oddychanie tlenowe
W obecności tlenu pirogronian uzyskany w procesie glikolizy jest
przekształcany w acetylo-CoA i CO2. Następnie grupa acetylowa
w acetylo-CoA ulega przekształceniu do CO2 i H2O w cyklu kwasu
cytrynowego (cykl kwasów trójkarboksylowych). Proces ten dostarcza
energii oraz prekursorów koniecznych do biosyntezy.
W wyniku jednego cyklu uwalniają się dwie cząsteczki CO2,
powstaje jedna cząsteczka ATP, trzy cząsteczki NADH lub NADPH
i jedna FADH (dinukleotyd flawino-adeninowy- akceptor i donor
wodoru w komórkowych reakcjach metabolicznych, także w procesie
fotosyntezy)
Cykl kwasu cytrynowego
Łańcuch transportu elektronów
(łańcuch oddechowy)
Powstający NADH (potencjał redoks –320 mV) przekazuje elektrony
do tlenu (potencjał redoks +820 mV) w kilku etapach, wykorzystując
nośniki elektronów o coraz wyższym potencjale redoks. Umożliwia to
stopniowe uwalnianie energii zmagazynowanej w elektronach NADH.
Ten łańcuch wyspecjalizowanych cząsteczek nazwano łańcuchem
transportu elektronów lub łańcuchem oddechowym. W bakteriach
zlokalizowany jest on w błonie cytoplazmatycznej.
Uwolniona energia jest wykorzystywana przez komórkę do
pompowania protonów poprzez błonę cytoplazmatyczną na zewnątrz.
Tendencja protonów do powrotu na wewnętrzną stronę błony
nazywana jest siłą protonomotoryczną (PMF). Siła ta może być
wykorzystana do syntezy ATP (fosforylacja oksydatywna).
Składniki łańcucha transportu elektronów
Flawoproteiny np. ferredoksyny - białka żelazowo-siarczkowe
przenoszące tylko jeden elektron, silne reduktory o bardzo niskim
potencjale redoks,
chinony - zwiazki aromatyczne ulegające odwracalnej redukcji,
mogą pobierać jeden lub dwa elektrony, a z każdym przenoszonym
elektronem pobierają ze środowiska jeden proton, potencjał redoks
około +30 mV,
cytochromy - białka zawierające jedną lub więcej grup hemowych,
pobierają elektrony i przekazują je dalej poprzez naprzemienną
redukcję i utlenianie jonu żelaza, potencjał redoks cytochromu c wynosi
+230 mV.
Duże stężenie tlenu
Małe stężenie tlenu
Oddychanie tlenowe E. coli
J.Nickielin, K.Graeme-Cook, T.Paged, R.Killington, Krótkie wykłady Mikrobiologia, PWN,
Warszawa, 2000.
Beztlenowe oddychanie E. Coli z wykorzystaniem azotanu
J.Nickielin, K.Graeme-Cook, T.Paged, R.Killington, Krótkie wykłady Mikrobiologia, PWN,
Warszawa, 2000.
Wydajność tworzenia ATP z glukozy
Droga kataboliczna
Oddychanie tlenowe
glikoliza
fermentacja
mole ATP/mol glukozy
34
2
2-3
Wydajność tworzenia ATP z glukozy
Droga kataboliczna
Oddychanie tlenowe
glikoliza
fermentacja
mole ATP/mol glukozy
34
2
2-3
Biopaliwa
XXXIX OKK
Rodzaje biopaliw
wodór
bioetanol
biogaz
estry kwasów rzepakowych (biodiesel)
Wodór
ważny nośnik energii
Zastosowanie wodoru
nośnik energetyczny,
w petrochemii - do uwodornienia olefin i związków aromatycznych,
izomeryzacji, krakingu, usuwania związków siarki i azotu,
w metalurgii i przemyśle jądrowym - do usuwania tlenu,
w przemyśle chemicznym - do produkcji amoniaku, metanolu, tworzyw
sztucznych,
w przemyśle elektronicznym - do produkcji włókien optycznych obwodów
scalonych, przy produkcji mikrochipów Si.
Przemysłowe metody produkcji wodoru
CH4 + 2H2O CO2 + 4H2
C + H2O CO + H2
CO + H2O CO2 + H2
CH4 C + H2
Elektroliza roztworów metali alkalicznych lub NaCl (elektrody
niklowe)
Biologiczne metody otrzymywania wodoru
biofotoliza wody przy użyciu alg i cyjanobakterii,
fotofermentacja w obecności bakterii fotosyntetyzujących,
fermentacja anaerobowa (ciemna) w obecności bakterii
fermentujących,
systemy hybrydowe wykorzystujące bakterie fermentujące
i fotosyntetyzujące.
Ciemna fermentacja
Mikroorganizmy
bakterie anaerobowe ( np. Clostridium pasteurianum, Enterobacter cloacae)
Enzym
Fe-hydrogenaza (dwukierunkowa hydrogenaza żelazowa) katalizująca
reakcję:
2H+ + 2 e- ↔ H2
Enzym podczas wytwarzania wodoru nie zużywa ATP, jednak jest bardzo
podatny na inhibicję tlenową.
Enzym zawiera pięć klastrów (centrów) żelazowo-siarkowych połączonych
kowalencyjnie z białkiem. Jeden jest typu Fe2S2, trzy Fe4S4, a piąty, tzw.
centrum ‘H’, składa się z dwóch subcentrów i zawiera sześć atomów żelaza.
Cztery atomy znajdują się w konwencjonalnym centrum [4Fe-4S], które
poprzez siarkę z reszt cysteiny połączone jest z biologicznie unikalnym
subcentrum zwierającym dwa atomy żelaza skoordynowane ligandami CO
i CN.
Centrum Fe2S2
Centrum Fe4S4
H – klaster w Fe-hydrogenazie z Clostridium pasteurianum
D.Das, T.Dutta, K.Nath, S.M. Kotay, A.K.Das, T.N. Veziroglu, 2006, Current Science, 90, 1627
Warunki prowadzenia biologicznego procesu
otrzymywania wodoru
mieszana kultura otrzymana z naturalnych źródeł (kompost, osad
z fermentacji anaerobowej, gleba),
źródło węgla – glukoza, odpadowa biomasa,
pH około 5,5,
niskie ciśnienie cząstkowe wodoru,
(S0/X0) ~ 4 (stosunek stężenia substratu w pożywce do biomasy w
inokulum),
odpowiednie stężenie jonów żelaza (zbyt niskie stężenie żelaza
faworyzuje produkcję etanolu kosztem wydzielania wodoru),
krótki hydrauliczny czasu zatrzymania ścieków (stosunek objętości
czynnej reaktora do natężenia przepływu ścieków).
W czasie fermentacji, w obecności mieszanej kultury bakterii, oprócz reakcji
prowadzących do utworzenia wodoru, zachodzi także wiele reakcji
konkurencyjnych. Podczas tych reakcji zużywany jest substrat organiczny i
mogą one prowadzić do zanieczyszczenia gazu dodatkowymi produktami np.
metanem. Dlatego też konieczne jest zahamowanie tych procesów.
glukoza → pirogronian
pirogronian + CoA + 2 Fd(ox) → acetylo-CoA +2 Fd(red) + CO2
2 Fd(red) + 2 H+ → 2 Fd(ox) + H2
C6H12O6 + 2H2O ↔ 2CH3COOH + 4H2 + 2CO2
C6H12O6 ↔ CH3CH2CH2COOH + 2H2 + 2CO2
C6H12O6 ↔ 3CH4 + 3CO2
CH3COOH + 2H2 ↔ CH3CH2OH +H2O
CH3COOH ↔ CH4 + CO2
Zalety procesu:
bardzo duża szybkość wydzielania wodoru,
możliwość wytwarzania wodoru w dzień i w nocy,
możliwość stosowania różnych odpadowych substratów
organicznych.
Wada:
w trakcie fermentacji powstają kwasy i alkohole. Obniża to
opłacalność procesu, ponieważ zmniejsza się wydajność
przekształcenia związku organicznego do wodoru. Konieczne jest
ponadto dalsze oczyszczanie ścieku powstającego w czasie procesu.
Fotobiologiczne otrzymywanie
wodoru
Mikroorganizmy :
Algi ( np. Chlamydomonas reinhardtii)
Cyjanobakterie (Anabaena, Nostoc)
Bakterie fotosyntetyzujące (Rhodobacter sphaeroides, Rhodospirillum
rubrum)
Enzymy:
kompleks nitrogenazy (nitrogenaza)
hydrogenaza NiFe
Kompleks nitrogenazy
Dwuskładnikowy system metaloprotein składający się z reduktazy i
dinitrogenazy:
reduktaza (białko Fe) - przenosi elektrony z ferrodoksyny na
dinitrogenazę,
dinitrogenaza (białko FeMo) katalizuje reakcję wiązania azotu
cząsteczkowego:
N2 + 8e- + 8H+ + 16 ATP +16 H2O → 2 NH3 + H2 + 16 ADP + 16Pi
gdy w środowisku brak jest azotu reakcja przebiega następująco:
2 H+ + 4ATP + 2 Fdrd H2 + 4 ADP + 4 Pi + 2 Fdox
Rodzaje nitrogenaz
molibdenowa – zawiera molibden i żelazo w centrum kofaktora, jest
najbardziej rozpowszechniona wśród mikroorganizmów,
wanadowa - syntetyzowana, gdy w układzie znajduje się wanad, a brak
jest molibdenu; charakteryzuje się największą szybkością wytwarzania
wodoru,
żelazowa - powstaje gdy w układzie brak jest molibdenu i wanadu.
Hydrogenaza NiFe (niklowo-żelazowa)
Katalizuje proces utleniania wodoru cząsteczkowego
(uzyskane elektrony użyte są do redukcji NAD+):
H2 → 2 H+
Hydrogenaza NiFe zbudowana jest z małej i dużej
podjednostki.
Mała podjednostka – to trzy centra żelazowo-siarkowe,
dwa typu [4Fe-4S] (patrz Fe hydrogenaza w ciemnej
fermentacji) i jedno [3Fe-4S]:
Biofotoliza wody z udziałem alg lub cyjanobakterii
Fotosynteza (warunki aerobowe)
O2
CO2
H2O → PSII → PSI → Fd → RUBISCO → [CHO]
Biofotoliza bezpośrednia (warunki anaerobowe)
2 H2 O 2 H2 + O2
O2
H2O → PSII → PSI → Fd → H2asa → H2
Proces nie zawiera etapu wiązania CO2 lub magazynowania energii w
postaci metabolitów komórkowych - powstają tylko wodór i tlen, który
jest jednakże silnym inhibitorem.
Próba rozwiązania problemu inhibicji tlenem: rozdział reakcji wydzielania tlenu i wodoru (algi Chlamydomonas
reinhardtii)
warunek konieczny – podłoże hodowlane pozbawione siarki
Hodowla w pożywce pozbawionej siarki powoduje obniżenie szybkości
fotosyntezy tlenowej natomiast nie zmienia szybkości respiracji. Po
pewnym czasie trwania procesu wytwarzają się warunki anaerobowe
bowiem cały tlen z fotosyntezy zostaje zużyty w respiracji.
Podczas naświetlania obserwuje się wydzielanie wodoru oraz zużycie
znacznych ilości wewnątrzkomórkowych substancji zapasowych:
skrobi i białek.
Czas wydzielania wodoru - około 100 godzin. Po tym okresie algi muszą
powrócić do normalnej fotosyntezy w celu uzupełnienia substratu
endogennego.
Fotofermentacja z udziałem bakterii
Rhodobacter sphaeroides
Enzymy:
nitrogenaza
hydrogenaza (NiFe hydrogenaza) - katalizuje proces utleniania
wodoru cząsteczkowego
Warunek konieczny wydzielania wodoru
: atmosfera anaerobowa i brak azotu:
2 H+ + 4 ATP + 2 e H2 + 4ADP + 4 Pi
W warunkach aerobowych natomiast zachodzi proces respiracji.
Obserwuje się wtedy wzrost biomasy, ale nie wytwarza się wodór.
Źródło energii
– światło
– związki organiczne (kwas jabłkowy, mleczan, ścieki z
produkcji kwasu mlekowego)
Źródło węgla
Schemat wytwarzania wodoru
przez bakterie Rhodobacter sphaeroides
światło
H+
na zewnątrz
membrany
H+, elektrony
H2
aparat
fotosyntetyczny
CO2
Hydrogenaza
ATP
synteza
ATP
substrat
cykl TCA
H+
Nitrogenaza
H
H
2
2
elektrony
Biosynteza ,
produkty wzrostu
Koku, H. et al.. Int. J. Hydrogen Energy 2002, 27, 1315-1329
Warunki procesu wydzielania wodoru przez bakterie
Rhodobacter sphaeroides O.U. 001
Podłoże
jabłczan lub ścieki,
makroelementy,
cytrynian żelaza,
witaminy lub ekstrakt drożdżowy,
mikroelementy
Warunki:
temperatura 28oC - 30 oC
pH 7
C/N: 15/2 [mmol/mmol]
natężenie oświetlenia: 5-13 klx
inokulum 5 – 30% obj.
konieczny jest etap aktywacji
Zalety procesu fotofermentacji
duża wydajność przekształcania związku organicznego w wodór,
brak tlenu - silnego inhibitora nitrogenazy,
zdolność do wykorzystania szerokiego spektrum światła,
możliwość wykorzystania związków organicznych pochodzących z
odpadów lub ścieków
Wady procesu
nitrogenaza wymaga dużych ilości energii (4 ATP/H2), co może
zmniejszać wydajność przekształcenia energii świetlnej,
niezbyt duża szybkość procesu.
Bioetanol
Roczna produkcja bioetanolu w USA (miliardy galonów)
Źródło: Renewable Fuels Association
Zastosowanie etanolu
napój alkoholowy
rozpuszczalnik
paliwo
substrat w wielu syntezach organicznych
substancja dezynfekująca
składnik antyzamrażaczy
Otrzymywanie etanolu
Proces fermentacji etanolowej, polegający na przemianie cukrów, w obecności mikroorganizmów, dostarczający
energii metabolicznej komórkom w warunkach beztlenowych (2 mole ATP/mol heksozy).
Mikroorganizmy
Produkcja etanolu z udziałem drożdży
Saccharomyces cerevisiae
Dekarboksylaza
pirogronianowa
Dehydrogenaza
dehydrogenaza
alkoholowa
alkoholowa
– jest ściśle powiązana ze wzrostem komórek
drożdży: ATP jest wykorzystane do biosyntezy masy drożdży
(biomasa jest ko-produktem).
Produkcja etanolu
Kontrola procesu:
wewnątrzkomórkowa akumulacja ATP inhibituje aktywność enzymu
fosfofruktokinazy, co w efekcie powoduje zahamowanie glikolizy.
Teoretycznie:
1 g glukozy 0.51 g etanolu + 0.49 g CO2
Praktycznie:
1 g glukozy około 0.46 g etanolu + 0.44 g CO2 (wydajność 91 – 93%)
Różnica:
glukoza wykorzystana jest dodatkowo do syntezy biomasy
i produktów ubocznych np. gliceryny i wyższych alkoholi.
Etanol ma negatywne działanie na błony komórkowe powodując ich
dezintegrację i lizę. Drożdże mogą wzrastać w podłożu zawierającym do
120 g/l etanolu, a prowadzą fermentację aż do 200 g/l etanolu.
Otrzymany w wyniku fermentacji etanol jest 15%.
Niezbędne są ślady tlenu (0.05%) – do syntezy NAD, steroli
i nienasyconych kwasów tłuszczowych.
Bakterie Zymomonas mobilis
Bakterie anaerobowe, gramujemne, wyizolowane w procesie
produkcji napoju alkoholowego (pulque) otrzymanego
z fermentującego soku agawy maguey (Meksyk).
Fermentacja heksoz:
1 mol heksozy 2 mole etanolu + 2 mole CO2 + 1 mol ATP
Maksymalna wydajność procesu (97%) jest wyższa niż przy
zastosowaniu drożdży (93%) bowiem w przypadku bakterii
produkowana jest mniejsza ilość biomasy, a więc więcej węgla
wykorzystywane jest do tworzenia etanolu.
Ograniczenia:
wąskie spektrum substratów: D-glukoza, D-fruktoza, sacharoza
(w tym ostatnim przypadku tworzy się jednocześnie sorbitol, który
powoduje zmniejszenie wydajności powstawania etanolu).
A.Chmiel, Biotechnologia. Podstawy mikrobiologiczne i biochemiczne, PWN,
Warszawa, 1998.
Surowce stosowane w procesie produkcji etanolu
cukry proste
skrobia
produkty uboczne z przemysłu rolno-spożywczego (serwatka, melasa)
surowce ligninocelulozowe (biomasa roślinna zawierająca celulozę
i ligninę)
Skrobia - źródło cukrów prostych
Źródło skrobi
ryż
pszenica
jęczmień
owies
żyto
kukurydza
ziemniaki
zawartość [%]
70-75
58-70
56-66
50-60
51-53
50-68
12-22
Przemysłowe metody otrzymywania etanolu
Surowce: ziemniaki, żyto, buraki cukrowe
Procesy:
hydroliza skrobi za pomocą - i -amylaz zawartych w słodzie
gorzelnianym, 60 0C, pH 4.5 – 5.5,
fermentacja (drożdże), 15 – 18 0C, pH 4.5, 3 doby,
destylacja – zawartość alkoholu 92%, (produkty uboczne:
aldehydy, wyższe alkohole, estry, kwasy organiczne),
rektyfikacja – zawartość alkoholu - 96%,
odwodnienie: 99.5 % - środki odwadniające: CaO, Na2SO4.
Wydajność: 100 kg skrobi → 63 litry 100% etanolu.
Biokonwersja surowców lignocelulozowych
Celuloza (C6H10O5)n gdzie n = 100-10000
Hemiceluloza (C5H8O4)n gdzie n = 100-30000
Lignina
Inaczej – drzewnik.
Polimer o złożonej budowie,
pochodna fenoli.
W przemyśle papierniczym
oddzielana od celulozy poprzez
rozpuszczanie w kwaśnym
siarczynie sodowym (NaHSO3).
Struktura ligniny w dębie francuskim
Porównanie udziału biomasy wykorzystywanych
źródłach energii
Produkcja etanolu z surowców lignocelulozowych
Metody hydrolitycznego rozkładu związków homopolisacharydów
(celulozy) i heteropolisacharydów (ligniny):
fizyczne – mielenie, napromieniowanie, temperatura,
chemiczne – działanie zasadami, kwasami, utleniaczami, reduktorami,
rozpuszczalnikami organicznymi,
biologiczne – stosowanie grzybów z rodzaju Pleurotus, Phlebia,
Trichoderma reesei oraz ich mutantów.
Enzymy hydrolizujące celulozę:
endoglukanaza – odcina końcowe elementy łańcucha
egzoglukanaza – rozcina wiązania wewnątrz łańcucha
struktura celulozy
Produkcja etanolu metodą pośrednią
biosynteza celulaz
przygotowanie substratu
hydroliza enzymatyczna (scukrzanie)
fermentacja hydrolizatu
destylacja alkoholu
Zalety: łatwe sterowanie procesem i jego optymalizacja
Wady: wolna hydroliza, zwiększone stężenie celobiozy i glukozy
hamuje aktywność celulaz
Ulepszenie procesu: przyspieszenie hydrolizy celobiozy
i celodekstryny dzięki zastosowaniu dodatkowo -glukozydazy
z Aspergillus niger.
Produkcja etanolu metodą bezpośrednią
Enzymatyczna hydroliza celulozy i fermentacja sacharydów
prowadzona jest w jednym bioreaktorze.
Mikroorganizmy:
bakterie Clostridium thermocellum,
1 mol glukozy ( z hydrolizy celulozy) 1 mol etanolu,
grzyby strzępkowe: Fusarium oxysporum (hydroliza heksoz i pentoz)
mieszane kultury: Clostridium thermocellum i Clostridium
termosaccharolyticum
Zalety:
Wydajność etanolu wyższa o 25 – 40% niż w metodzie pośredniej
Trudności:
Różnica między optymalną temperaturą hydrolizy celulozy (45-50OC)
i fermentacji cukrów (28-35OC)
Biogaz
Bakterie metanogenne
bezwzględne beztlenowce ( dopuszczalne stężenie tlenu < 0.01 mg/l),
mała szybkość wzrostu (czas generacji 10 h),
temperatura fermentacji 0 – 100 oC (optymalna 45 – 60 oC),
pH 6.5 – 8.5
Surowce stosowane w fermentacji metanowej
odpady roślinne, fekalia, osady z oczyszczalni,
odpady przemysłu rolno-spożywczego,
ścieki mleczarskie, browarnicze, gorzelniane,
cukrownicze, z przemysłu papierniczego i rzeźni
Schemat metanogenezy
biomasa
hydroliza
aminokwasy
cukry
kwasy tłuszczowe
gliceryna
acidogeneza
alkohole
kwas propionowy
kwas masłowy
acetogeneza
kwas octowy
biogaz
H2, CO2
metanogeneza
acetogeneza
Reakcje metanogenezy
Skład biogazu
Teoretycznie:
65% metanu + 35% dwutlenku węgla
W praktyce:
55-75% metanu, 25-45% CO2, 0-0.3% N2,
1-5% H2,
0-3% H2S
Doczyszczanie biogazu:
absorpcja CO2 w wodzie ( 25 razy lepiej rozpuszczalny niż metan),
adsorpcja chloru na węglu aktywnym,
utlenianie siarkowodoru:
Fe2O3 + 3 H2S Fe2S3 + 3 H2 O
2 Fe2S3 + 3 O2 2Fe2O3 + 6S
Zalety i wady energii z biogazu
Zalety:
energia czysta i odnawialna,
zdecentralizowana produkcja energii (bez strat podczas przesyłania),
koszty zbliżone do kosztów uzyskania energii ze źródeł konwencjonalnych,
możliwość stosowania w krajach rozwijających się,
poprawa stanu sanitarno-epidemiologicznego.
Wady:
konieczność przestrzegania wymagających warunków technologicznych,
nakłady inwestycyjne (budowa fermentatorów).
Biodiesel
Kwasy tłuszczowe stosowane jako biopaliwo
olej słonecznikowy
olej rzepakowy
olej sojowy
olej arachidowy
olej z nasion bawełny
Zalety kwasów tłuszczowych jako paliwa:
płynny stan skupienia,
wysoka energetyczność (80% paliwa diesla),
dostępność surowca,
odnawialność.
Wady kwasów tłuszczowych jako paliwa:
duża lepkość,
niska lotność,
tworzenie koksów,
tworzenie gum w czasie magazynowania (utlenianie i polimeryzacja),
zabrudzenie oleju smarnego.
Metody otrzymywania biodiesla
(mieszaniny estrów metylowych kwasów tłuszczowych)
- powstaje mieszanina nienasyconych estrów metylowych,
1-olefin, n-parafin
piroliza
(transestryfikacja) – w obecności alkoholu (metanol, etanol
butanol, propanol) tworzą się estry kwasów tłuszczowych i gliceryna
alkoholiza
katalizatory
• alkalia – NaOH, KOH, węglany, alkoholany sodu lub potasu,
• kwasy – kwas siarkowy, kwas sulfonowy, kwas solny,
• enzymy – lipazy
Schemat transestryfikacji
katalizator
tłuszcz + alkohol
ester + gliceryna
triglicerydy diglicerydy monoglicerydy
stosowana jest kataliza alkaliczna (najszybsza).
Proces zachodzi w trzech etapach, konieczny stosunek wagowy alkoholu do oleju
wynosi 6:1, a temperatura, zależnie od rodzaju surowca, 20- 60 oC.
Substraty muszą być bezwodne (0.06% w/w), o niskiej zawartości nasyconych
kwasów tłuszczowych.
W praktyce
zawiera mieszaninę estrów, gliceryny, alkoholu, katalizatora oraz
tri-, di- i monoglicerynianów.
Produkt
Optymalizacja procesu:
redukcja kosztów surowych materiałów (60 – 70%) i procesu,
zwiększenie dostępności surowców
Możliwości rozwiązań:
zastosowanie odpadowego, zużytego oleju po smażeniu,
zastosowanie procesu ciągłego,
zagospodarowanie produktu ubocznego - gliceryny.
Produkcja piwa
Napój produkowany z wody, słodu jęczmiennego, szyszek chmielowych i drożdży z rodzaju
Saccharomyces
Surowce
słód,
woda,
drożdże,
chmiel,
składniki podstawowe
preparaty enzymatyczne i stabilizujące,
dodatki 15-20 % (kukurydza, ryż, pszenica).
Schemat produkcji piwa
otrzymywanie
słodu
mielenie słodu
zacieranie słodu
brzeczka
gotowanie z chmielem
oddzielanie osadów
chłodzenie
fermentacja (dodanie
drożdży)
dojrzewanie (leżakowanie)
filtracja
stabilizacja
rozlewanie
Słód
Otrzymywanie:
moczenie ziarna jęczmienia browarnego – 40 godz,
kiełkowanie na plaskich paletach -5 dni,
suszenie wyskotemperaturowe
:
wytworzenie i uaktywnienie enzymów (głównie amylazy) obecnych
w ziarnie, niezbędnych do rozkładu skrobi i białek w czasie zacierania.
Cel słodowania
Rodzaje słodów:
jasne (pilzneńskie),
ciemne (monachijskie),
karmelowe,
barwiące.
Zacieranie
Cel procesu:
hydroliza skrobi, β-glukanu, białek (75 %) transformacja do cukrów
prostych – głownie maltozy czas trwania 1-2 godz.
Dekstryny – nie ulegają fermentacji
Enzymy:
hemicelulaza, α-amylaza, β-amylaza, endopeptydazy,
endo-β-glukanaza
pH
5.2 – 5.4
: stopniowe podgrzewanie od 37 oC do 76 oC czas trwania
1-2 godzin
Temperatura
Skład brzeczki po zacieraniu:
maltoza 44%, dekstryny 31%, maltotrioza 11%, glukoza 9%,
sacharoza 3%, fruktoza 2%, aminokwasy 170-190 mg/100 cm3.
Dodawanie do brzeczki:
Niesłodowany jęczmień - grys lub mąka
Ryż
Pszenica
Odtłuszczona kukurydza - płatki
Gotowanie brzeczki z chmielem warzenie
ekstrakcja i transformacja związków występujących w chmielu (αkwasy podlegają izomeryzacji do izo-α-kwasów; dłuższy czas
gotowania i wyższe pH brzeczki zwiększa ilość izo-α-kwasów i
goryczkę piwa),
sterylizacja,
wytrącenie osadów,
nadanie odpowiedniego smaku i zapachu,
ustalenie barwy,
zakwaszenie,
zagęszczenie,
inaktywacja enzymów.
Fermentacja brzeczki
i leżakowanie piwa
Fermentacja główna (5 -14 dni)
drożdże: Saccharomyces cerevisiae carslbergensis, (dolna) - pils
Saccharomyces cerevisiae cerevisiae (górna) – Ale, Weissbier
Rodzaje fermentacji
fermentacja górna - przebiega w temp. 15-25 oC, po niej następuje
kilkudniowe dojrzewanie przy 12-15 0C,
fermentacja dolna – odbywa się w temp. 5-10 oC, a dojrzewanie
około 0 oC.
Dojrzewanie piwa (leżakowanie)
fermentacja końcowa (wtórna); czas procesu 3-6 tygodni w zależności od
stosowanej metody
Sposoby prowadzenia procesów dolnej fermentacji
fermentacja główna przebiega w temp. do 10 oC, a fermentacja
końcowa poniżej -1 oC,
fermentacja główna przebiega w temp. 12-14 oC, a fermentacja
końcowa poniżej -1 oC,
fermentacja główna przebiega w temp. do 10 oC, z zastosowaniem
okresu ciepłego (12-14 oC) , a fermentacja końcowa poniżej -1 oC,
fermentacja pod ciśnieniem (0.7- 1 bar).
Woda w produkcji piwa
zużycie: 6-7 l wody/l wyprodukowanego piwa,
woda wykorzystywana jest głównie podczas przygotowania słodu,
w procesie zacierania i do mycia urządzeń,
miękka woda - piwo o łagodnym słodkawym posmaku (piwo jasne),
twarda woda np. bogata w węglan wapnia (piwo ale).
Błędy w produkcji piwa
1.
Zmętnienie – obecność szczepów dzikich drożdży , bakterii mlekowych lub octanowych
2.
Kwaśnienie piwa – bakterie mlekowe i octanowe
3.
Pleśnienie piwa (Mucor, Aspergillus, Penicilinum)
4.
Utlenianie – dodawanie antyoksydantów
Fermentacja mlekowa
Wytwarzanie produktów mlecznych
W czasie fermentacji laktozy powstaje kwas mlekowy, następuje
koagulacja białka i hydroliza kazeiny.
– odtłuszczone mleko zaszczepia się mieszaniną bakterii Streptococcus
thermophilus i Lactobacillus bulgaris (w równych ilościach) i poddaje
fermentacji przez parę godzin w temperaturze 43 oC.
Istotnym elementem procesu jest zwiększenie zawartości suchej substancji
mleka poprzez zagęszczenie lub dodanie odtłuszczonego mleka w proszku.
Jogurt
– pełne mleko zaszczepia się grzybkami kefirowymi (bakterie
Leuconostoc kefir, Streptococcus lactis, Lactobacillus brevis, L.
acidophilus, oraz drożdże Saccharomyces carlsbergensis) i fermentuje w
temperaturze 20-23 oC przez 14-18 godzin.
Kefir
– do mleka wprowadza się inoculum bakterii mlekowych. W czasie
fermentacji kazeina mleka jest hydrolizowana przez trypsynę,
podpuszczkę i pepsynę. Kolejne etapy procesu to gotowanie, prasowanie i
dojrzewanie tworzącego się sera.
Przy produkcji serów niebieskich (blue cheese) stosuje się ponadto
bielenie za pomocą nadtlenków i dodatek pleśni Penicilinum roqueforti.
Sery
Dojrzewanie sera polega na rozkładzie białek i tłuszczów oraz przemianie
sacharydów i kwasów organicznych. Rozkład białek i tłuszczów prowadzi
do wytworzenia odpowiedniego zapachu, smaku i konsystencji sera.
Przemiana cukrów i kwasów powoduje zmianę kwasowości oraz
oczkowanie sera. Sery dojrzewają w temp. 10-15 oC. Podczas produkcji
serów szwajcarskich po 3-5 tygodniach przenosi się je do temp. 15-20 oC,
aby zintensyfikować tworzenie oczek przez bakterie propionowe
(produktami fermentacji są kwas propionowy, woda i CO2).
Następnie ponownie umieszcza się sery w pomieszczeniach
chłodniejszych.
Wino
Wino – napój alkoholowy
otrzymywany w wyniku fermentacji
alkoholowej miazgi lub soku winogron
Ok.1000 składników
• 75-90 % woda
• do 14 % alkohol etylowy
• gliceryna
• węglowodany
• fenole
• kwasy organiczne
• sole mineralne
Wino – najbardziej udana próba
jaką podjął człowiek, by przełożyć coś łatwo psującego
się na coś bardzo trwałego
John Arlott (1914-1991)
Wino doustny środek imaginogenny.
Ś.O.Pogrobelski
Wstęp do imaginoskopii , str. 14
Wino- owoc winorośli i pracy człowieka- nie jest zwykłym dobrem konsumpcyjnym. Towarzysząc człowiekowi
od tysiącleci , wino czerpie zarówno z sacrum jak i profanum. Jest wartością cywilizacji i kryterium jakości
życia. Stanowi dobro kultury. Jest czynnikiem życia społecznego, a historia wina jest nierozłącznie związana z
dziejami ludzkości.
Związki biologicznie czynne
Aminokwasy
Antybiotyki
Aminokwasy egzogenne –
Aminokwasy endogenne-
Pobierane z środowiska zewnętrznegoorganizm nie potrafi ich zsyntetyzować
Syntetyzowane bezpośrednio
w organizmie ludzkim lub zwierząt
wyższych
fenyloalanina
histydyna
izoleucyna
leucyna
lizyna
metionina
treonina
tryptofan
walina
alanina
arginina
asparagina
kwas asparaginowy
cysteina
glicyna
glutamina
kwas glutaminowy
prolina
seryna
tyrozyna
Na skalę przemysłową - produkcja kwasu glutaminowego,
metioniny, lizyny.
Zastosowanie – preparaty paszowe oraz w przemyśle
spożywczym, farmaceutycznym, kosmetycznym.
Listownica japońska, jap. kombu
E 621
Glutaminian sodu
Lizyna to aminokwas egzogenny i należy go
pozyskiwać z pożywienia, albowiem organizm
człowieka nie potrafi go produkować. Jest ona
bardzo ważnym składnikiem potrzebnym do
wzrostu, naprawy tkanek i produkcji hormonów,
enzymów i przeciwciał.
Jest potrzebna do prawidłowej budowy kości u
dzieci. Pomaga wchłaniać wapń i utrzymuje
prawidłową równowagę azotową u osób dorosłych.
Lizyna przyspiesza tworzenie kalogenu i
regenerację tkanek. Jest wskazana dla osób po
zabiegach chirurgicznych i urazach sportowych,
ponieważ stymuluje budowę białek mięśniowych.
Aminokwas ten także zwalcza wirusa opryszczki.
L-lizyna może skutecznie zwalczać infekcje i
zapobiegać ich nawrotom. Suplementy zawierające
L-lizynę mogą także skutecznie łagodzić skutki
ostrego zatrucia alkoholem.
Lizyna
Metionina
wpływa na przemianę lipidową,
uczestniczy w procesie transmetylacji,
jest niezbędna w syntezie choliny, kreatyny,
adrenaliny,
jest ważnym regulatorem układu nerwowego
i mięśniowego – szczególnie istotnym dla
utrzymania prawidłowego wzrostu i stanu tych
tkanek,
neutralizuje wolne rodniki – dzięki czemu działa
stabilizująco na DNA i działa
przeciwnowotworowo,
jest potrzebna do biosyntezy cysteiny, karnityny,
tauryny, lecytyny,
spowalnia proces degradacji białek w stanach
chorobowych i oparzeniach,
przeciwdziała stłuszczeniu hepatocytów czyli
komórek wątrobowych,
reguluje pracę tarczycy,
działa detoksykacyjnie.
Mechanizmy negatywnej kontroli metabolicznej
Geny odpowiedzialne za biosyntezę danego aminokwasu kontrolują
aktywność enzymów biorących udział w tym procesie, aby nie dopuścić
do jego nadprodukcji:
w środowisku zawierającym określony aminokwas w ilości
wystarczającej do normalnego rozwoju komórki, zablokowana jest
synteza enzymów biorących udział w jego wytwarzaniu;
w warunkach nadmiaru aminokwasów hamowana jest aktywność
wszystkich kluczowych enzymów szlaku metabolicznego lub tylko
pierwszego enzymu w jego odgałęzieniu prowadzącym do wytworzenia
danego aminokwasu.
Przemysłową produkcję aminokwasów prowadzi się w warunkach rozregulowanego systemu kontroli, która prowadzi do
nadprodukcji.
Czynniki sprzyjające nadprodukcji aminokwasu
wzrost przepuszczalności przez błonę cytoplazmatyczną - zwiększony
transport aminokwasu na zewnątrz komórki spowodowany deficytem biotyny
(do 5g/dm3), dodatkiem nasyconych kwasów tłuszczowych C16 – C18, lub
detergentów,
odcinanie rozgałęzień szlaku metabolicznego przez wprowadzenie nadmiaru
produktu tego rozgałęzienia,
dodatek do podłoża prekursorów - substancji przeciwdziałających regulacji
metabolicznej szlaku,
mutageneza – wprowadzenie mutantów ze zwiększoną aktywnością enzymów
katalizujących biosyntezę danego aminokwasu.
Produkcja kwasu L-glutaminowego
Proces ten może przebiegać według dwóch różnych szlaków metabolicznych:
w warunkach dużego stężenia jonu NH4+ proces katalizuje dehydrogenaza
glutaminianowa:
NH4+ + 2-oksoglutaran2- + NADPH + H+ L-glutaminian- + NADP+ +H2O
gdy stężenie jonu NH4+ 2 mmole/dm3 – udział biorą syntetaza
glutaminowa i syntaza glutaminianowa.
NH4+ + 2-oksoglutaran2- + NADPH + H+ + ATP L-glutaminian- + NADP+
+ ADP + Pi
Warunki prowadzenia procesu
bakterie - Corynebacterium glutamicum, Brevibacterium flavum,
źródła węgla – glukoza, sacharoza, melasa, hydrolizaty skrobiowe,
metanol, etanol,
źródła azotu – sole amonowe, amoniak, mocznik,
makro- i mikroelementy,
temperatura 32 oC, a następnie 38 oC,
pH 8,
intensywne napowietrzanie (hamuje syntezę -ketoglutaranu powodującego
zmniejszenie ilości kwasu glutaminowego),
Wydajność procesu – 100g/dm3 po 30 –35 godzinach hodowli.
Produkcja L-lizyny
szczawiooctan
L-asparaginian
kinaza asparaginianowa
semialdehyd
asparaginianowy
dehydrogenaza
homoserynowa
dihydrodipikolinian
L-lizyna
L-homoseryna
L-metionina
L-treonina
Biosyntezę L-lizyny prowadzi się w warunkach wysycenia komórki L-treoniną
i L-metioniną, co powoduje zablokowanie syntezy tych aminokwasów.
Regulacja procesu
Kinaza asparaginianowa – hamowana jest przez jednoczesny nadmiar
L-lizyny i L-treoniny (1 mmol/dm3), a stymulowana przez L-izoleucynę
i L-walinę.
Aktywność dehydrogenazy homoserynowej – regulowana jest niezależnie
od aktywności kinazy asparaginianowej.
Warunki prowadzenia procesu
bakterie - Corynebacterium glutamicum, Brevibacterium flavum,
Brevibacterium lactofermentum,
podłoże zawiera 25-30 g/dm3 biotyny, L-homoserynę lub L-treoninę,
L-metioninę i L-izoleucynę,
źródło węgla –glukoza, etanol, kwas octowy,
pH 7,
temperatura 30 oC,
napowietrzanie,
czas trwania procesu 48 godzin.
Rola lizyny w organizmie
1.Niezbędna przy budowie białek, głównie w mięśniach i w kościach,
istotna w okresie rozwoju.
2.Wchłania wapń, poprawia koncentrację umysłową.
3.Łagodzi objawy przeziębienia, grypy oraz opryszczki.
4.Obecna przy wytwarzaniu hormonów, przeciwciał, enzymów i przy
budowie kolagenu.
5.Jej niedobór skutkuje objawami zmęczenia i rozdrażnienia,
powoduje anemię i wypadanie włosów.
6.Najprawdopodobniej jeden z czynników wpływających w dużej
mierze na procesy antykancerogenne w połączeniu z dużymi
dawkami antyoksydantów.
7.Uczestniczy w procesach odnowy tkanek, tworzenia się przeciwciał,
stymulacji wzrostu, a także wytwarzania hormonów i enzymów.
Antybiotyki
– specyficzny inhibitor procesów biologicznych.
(„antybioza”oznacza brak możliwości współżycia między dwoma
mikroorganizmami).
Antybiotyk
Penicylina
odkrycie - 1928 r. (Aleksander Fleming),
oczyszczenie – 1939 r. (Florey, Chain), Nobel - 1945
produkcja na skalę przemysłową – 1942 r.,
zwiększenie wydajności procesu - 1943 r. (zastosowanie grzyba
Penicillium chrysogenum, mutacja gazem musztardowym,
promieniowaniem UV i rentgenowskim – wydajność 7 g/l),
współczesne mutanty – wydajność 20 g/l.
Penicillinum roquefortii – sery pleśniowe
Penicylina
Penicylina G
Antybiotyki uzyskuje się na skalę przemysłową metodami syntezy chemicznej.
Wiele z nich jest produkowanych metodami biotechnologicznymi.
Pojemność fermentora (bioreaktora) ok. 50 do 300 m³.
W bioreaktorach przeprowadza się reakcje biosyntezy antybiotyków naturalnych
przez odpowiednie drobnoustroje oraz reakcje biotransformacji.
Biotransformacja (w syntezie antybiotyków) polega na przekształceniu
związków chemicznych w antybiotyki za pomocą enzymów formie czystej,
mikroorganizmów lub komórek organizmów wyższych.
Produkt jaki możemy otrzymać z danego substratu zależy od wielu czynników.
Najważniejsze z nich to:
*rasa drobnoustroju
*pH,
*stężenie substratu,
*użyte do hodowli składniki odżywcze i inne warunki hodowli,
*użyte dodatkowe substancje, np. inhibitory enzymów
Komórki Penicillinum wzrastają przy zastosowaniu techniki fed-batch, w której komórki podlegają stałemu stresowi.
Warunki:
Źródło węgla organicznego np. laktoza (dwucukier)
pH
Poziom stężeń azotu, fosforanów, lizyny i tlenu ściśle kontrolowany
Producenci antybiotyków
bakterie - Bacillus, Pseudomonas (500 różnych antybiotyków),
grzyby – Alternaria, Aspergillus, Penicillium, Fusarium,
Cephalosporium (1000 antybiotyków),
promieniowce – Streptomyces.
Charakterystyka
należą do różnych grup chemicznych: od prostych, małocząsteczkowych
związków (cykloseryna) do wielkocząsteczkowych polipeptydów
(erytromycyna),
zaburzają przyswajanie substancji niezbędnych do życia mikroorganizmów,
mają działanie bakteriobójcze (penicyliny, cefalosporyny, aminoglikozydy)
lub bakteriostatyczne (tetracykliny),
w małych dawkach hamują procesy przemiany materii mikroorganizmów
wytwarzane przez mikroorganizmy, rośliny, zwierzęta i człowieka
Zastosowanie antybiotyków
infekcje bakteryjne u ludzi i zwierząt,
terapie przeciwnowotworowe – cytostatyki,
stymulacja wzrostu,
zwiększenie produkcyjności zwierząt,
konserwacja żywności.
Rodzaje antybiotyków
-laktamowe (penicyliny, cefalosporyny),
aminoglikozydowe – połączenia glikozydów z aminocukrami
(streptomycyna, gentamycyna),
pochodne naftacenu – tetracykliny,
makrolidowe – duże cykliczne cząsteczki (erytromycyna),
polipeptydowe i glikopeptydowe (gramicydyna).
Mechanizm działania antybiotyków
uszkadzają strukturę i funkcje ściany komórkowej:
• hamują usieciowanie peptydoglikanu (penicyliny, cefalosporyny),
• hamują polimeryzację peptydoglikanu (wankomycyna),
• tworzą kanały w błonie, pozwalające na szybszy przepływ kationów
(107 /sek,) w stosunku do naturalnych przenośników
(np. gramicydyna < 103/sek),
hamują syntezę białek:
• hamują przemieszczanie się rybosomów (anybiotyki aminoglikozydowe,
np. gentamycyna),
• hamują wiązanie aminoacylo tRNA (tetracyklina),
hamują syntezę kwasów nukleinowych:
• hamują aktywność topoizomeraz np. gyrazy
(cyprofloksacyna, sparfluoksacyna, kumermycyna),
• powodują powstawanie przerw w szkieletach cukrowofosforanowych (nitrofurazon),
• hamują syntezę prekursorów kwasów nukleinowych
(azaseryna, showdomycyna),
• hamują replikację DNA (cytostatyki),
• blokują aktywność polimerazy RNA (ryfamycyn,
streptowarycyn).
Mechanizmy oporności na antybiotyki
inaktywacja antybiotyku w wyniku jego enzymatycznej hydrolizy
np. rozkład antybiotyków -laktamowych (penicyliny) przez -laktamazy,
które katalizują rozkład pierścienia -laktamowego,
modyfikacja antybiotyku przez wprowadzenie do jego cząsteczki różnych
podstawników zmieniających swoistość jego działania (np. acetylacja),
zmniejszenie przepuszczalności błony dla danego antybiotyku,
aktywne usuwanie antybiotyku z komórki na skutek działania specjalnych
pomp (oporność na tetracykliny),
zmiana w miejscu docelowego działania antybiotyku, np. zmiany w białku
wiążącym penicylinę lub zmiany w podjednostkach rybosomu,
wytworzenie alternatywnego szlaku metabolicznego zastępującego szlak
zablokowany w wyniku działania czynnika przeciwbakteryjnego (oporność na
sulfonamidy, trimetoprim - cytostatyki).
Nadprodukcja L-izoleucyny w komórce
represja
2-oksomaślan L-izoleucyna
L-treonina
NH4+
D-treonina
Dodatek D-treoniny powoduje ominięcie represji produktem pierwszego
etapu szlaku syntezy L-izoleucyny.