Agnieszka Anna Rawłuszko-Wieczorek
Uniwersytet Medyczny im. K. Marcinkowskiego w Poznaniu
Stypendystka projektu pt. „Wsparcie stypendialne dla doktorantów na kierunkach uznanych
za strategiczne z punktu widzenia rozwoju Wielkopolski”, Poddziałanie 8.2.2 Programu
Operacyjnego Kapitał Ludzki
Regulacja epigenetyczna wybranych genów zaangażowanych
w odpowiedź na hipoksję w raku jelita grubego
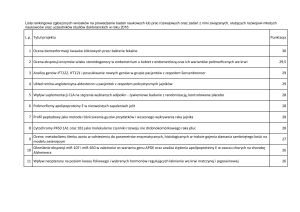
W Wielkopolsce, podobnie jak w całej Polsce, wysoka liczba zachorowań i zgonów
z powodu nowotworów złośliwych stanowi jedno z najpoważniejszych zagadnień
medycznych. W samym regionie Wielkopolski każdego roku odnotowuje się średnio 1,5 tys.
nowych przypadków zachorowań na raka jelita grubego (ang. colorectal cancer- CRC),
a około 60% pacjentów umiera w ciągu pięciu lat od postawienia diagnozy.
Do tej pory nie wyjaśniono do końca etiopatogenezy CRC, dlatego realizowane
w ramach rozprawy doktorskiej badania wpływu zmian epigenetycznych na ścieżkę
sygnałową
uruchamianą
w
hipoksji
oraz
możliwość
modulacji
ekspresji
genów
zaangażowanych w ten proces dzięki odwracalnemu charakterowi metylacji DNA może mieć
znaczący wpływ na rozwój wiedzy na temat karcynogenezy oraz na województwo
wielkopolskie w sektorze zdrowotnym i ekonomicznym.
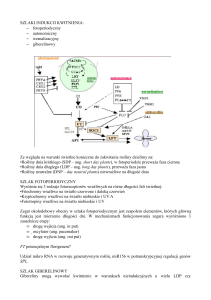
Komórki nowotworowe charakteryzują się odmiennym metabolizmem w porównaniu
z prawidłowymi. Obecność populacji komórek niedotlenionych, tj. w stanie hipoksji, jest
cechą charakterystyczną guzów litych, w tym CRC. W szybko dzielących się komórkach
nowotworowych słaby rozwój naczyń krwionośnych w stosunku do szybkości proliferacji
uniemożliwia prawidłowe dostarczenie tlenu do wszystkich komórek. Sprzyja to stabilizacji
białka HIF-α. HIF-α (ang. hypoxia inducible factor α) pobudza ekspresję wielu genów
zaangażowanych w utrzymanie homeostazy tlenowej, regulację metabolizmu glukozy oraz
aktywację angiogenezy (procesu powstawania nowych naczyń krwionośnych). Ponadto,
uruchomiony przez komórki nowotworowe program transkrypcji genów w odpowiedzi na
hipoksję przyczynia się do większej agresywności i przerzutowości, a także do większej
odporności na radio- i chemioterapię.
Praca doktorska współfinansowana ze środków Unii Europejskiej w ramach
Europejskiego Funduszu Społecznego
Poziom białka HIF-α podlega ścisłej kontroli w komórce. Obniżone ciśnienie tlenu
wywiera stabilizujące działanie na białko HIF-α, natomiast jego prawidłowe ciśnienie
wywołuje efekt przeciwny, czyli rozpad białka HIF-α. Jednym z pierwszych etapów degradacji
HIF-α jest hydroksylacja aminokwasów w obrębie N- lub C- końcowej domeny z udziałem
trzech
hydroksylaz
prolinowych
(ang.prolyl
hydroxylases
-PHDs)
i
hydroksylazy
asparaginianowej, zwanej czynnikiem hamującym HIF (FIH - ang. factor inhibiting HIF).
W pracy doktorskiej zwrócono szczególną uwagę na regulację epigenetyczną
powyższych genów w rozwoju raka jelita grubego. Modyfikacje epigenetyczne obejmują
między innymi odwracalną metylację cytozyn w obrębie dinukleotydów CpG w rejonach
promotorowych genów, której skutkiem może być zmiana struktury chromatyny z formy
aktywnej
transkrypcyjnie
(euchromatyny)
do
formy
nieaktywnej
transkrypcyjnie
(heterochromatyny).
W pracy doktorskiej po raz pierwszy wykazano odwrotną korelację pomiędzy ilością
transkryptów wybranych genów i stopniem metylacji DNA w obrębie wysp CpG u pacjentów
z rakiem jelita grubego. Wyniki te, stanowiące ważne uzupełnienie wiedzy na temat
mechanizmów molekularnych procesu karcynogenezy w stanie hipoksji. Są one uzupełnione
eksperymentami in vitro na ustalonych liniach komórkowych raka jelita grubego
z zastosowaniem związków chemicznych wpływających na przywrócenie ekspresji genów.
Analizy te pozwalają na dokładniejszą interpretację zmian zachodzących w badanej
tkance nowotworowej. Ponadto, metody prowadzące do zmniejszenia ilości białka HIF przez
jego
degradację komórkową,
zapoczątkowaną
przez
działanie
hydroksylaz,
mogą
w przyszłości stać się podstawą rozwoju nowych metod leczenia na poziomie molekularnym,
stanowiących uzupełnienie klasycznej chemioterapii. Czynniki kliniczne w wielu sytuacjach
są mało precyzyjne, dlatego też określenie wpływu zmian epigenetycznych na poziom białek
PHDs, FIH oraz HIFα może przyczynić się do opracowania skuteczniejszej metody leczenia
poprzez
wypracowanie
wiarygodnych
algorytmów
prognozowania
skuteczności
oraz zwiększenie bezpieczeństwa chemio- i radioterapii.
Praca doktorska współfinansowana ze środków Unii Europejskiej w ramach
Europejskiego Funduszu Społecznego