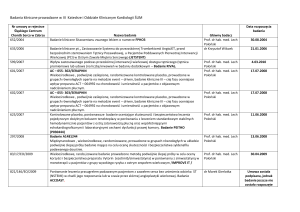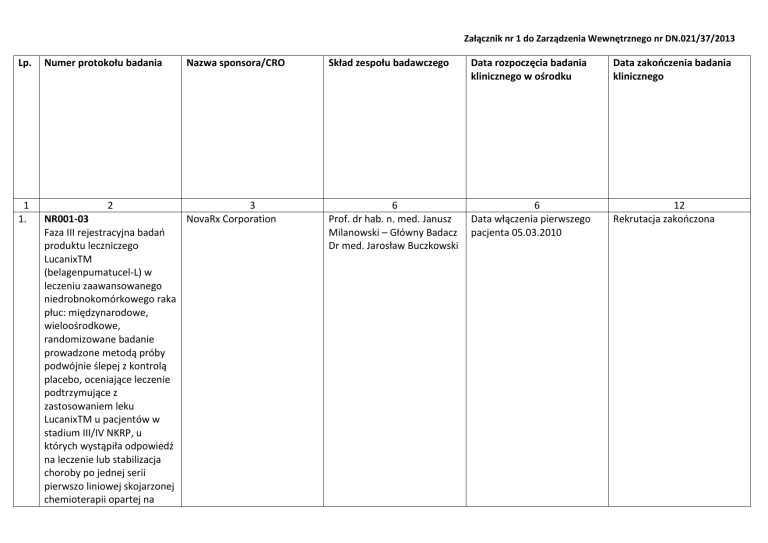
Załącznik nr 1 do Zarządzenia Wewnętrznego nr DN.021/37/2013
Lp.
1
1.
Numer protokołu badania
2
NR001-03
Faza III rejestracyjna badań
produktu leczniczego
LucanixTM
(belagenpumatucel-L) w
leczeniu zaawansowanego
niedrobnokomórkowego raka
płuc: międzynarodowe,
wieloośrodkowe,
randomizowane badanie
prowadzone metodą próby
podwójnie ślepej z kontrolą
placebo, oceniające leczenie
podtrzymujące z
zastosowaniem leku
LucanixTM u pacjentów w
stadium III/IV NKRP, u
których wystąpiła odpowiedź
na leczenie lub stabilizacja
choroby po jednej serii
pierwszo liniowej skojarzonej
chemioterapii opartej na
Nazwa sponsora/CRO
Skład zespołu badawczego
Data rozpoczęcia badania
klinicznego w ośrodku
Data zakończenia badania
klinicznego
3
NovaRx Corporation
6
Prof. dr hab. n. med. Janusz
Milanowski – Główny Badacz
Dr med. Jarosław Buczkowski
6
Data włączenia pierwszego
pacjenta 05.03.2010
12
Rekrutacja zakończona
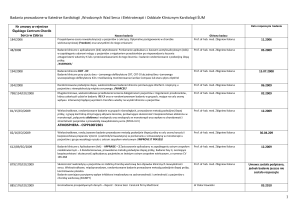
Załącznik nr 1 do Zarządzenia Wewnętrznego nr DN.021/37/2013
2.
3.
4.
związkach platyny.
OSI-774-302
Badanie III fazy,
wieloośrodkowe,
randomizowane, z
zastosowaniem podwójnie
ślepej próby, kontrolowane
placebo, polegające na
stosowaniu monoterapii
preparatem Tarceva
(erlotinib) po całkowitym
usunięcia guza i
zastosowaniu lub
niezastosowaniu
chemioterapii uzupełniającej
u pacjentów z
niedrobnokomórkowym
rakiem płuc stopnia IB-IIIA, z
nadekspresją naskórkowego
czynnika wzrostu EGFR
ARQ197-A-U302
Randomizowane, podwójnie
zaślepione, kontrolowane
placebo badanie fazy III
preparatu ARQ 197 plus
erlotinib u wcześniej
leczonych pacjentów z
miejscowo zaawansowanym
lub przerzutowym
niepłaskonabłonkowym,
niedrobnokomórkowym
rakiem płuc (NDRP)
BV-NSCLC-001
OSI Pharmaceuticals, Inc.
Prof. dr hab. n. med. Janusz
Milanowski – Główny Badacz
Lek. med. Michał Szczyrek
Dr med. Katarzyna SzmyginMilanowska
Data włączenia pierwszego
pacjenta: 24.04.2007
Rekrutacja zakończona
Daiichi Sankyo Development
Ltd.
Prof. dr hab. n. med. Janusz
Milanowski – Główny Badacz
Dr med. Magdalena WójcikSuperczyńska
Dr med. Robert Kieszko
Otwarcie ośrodka 29.07.2011
Rekrutacja zakończona
Bioven (Europe) Ltd.
Prof. dr hab. n. med. Janusz
Otwarcie ośrodka 27.07.12
Rekrutacja wstrzymana
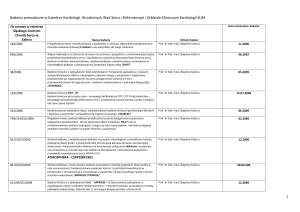
Załącznik nr 1 do Zarządzenia Wewnętrznego nr DN.021/37/2013
5.
6.
Wieloośrodkowe, otwarte,
randomizowane badanie III
fazy oceniające
bezpieczeństwo i skuteczność
szczepionki przeciwrakowej
EGF u pacjentów z
nieoperacyjnym, późnym
stadium (IIIB/IV)
niedrobnokomórkowego raka
płuc przyjmujacych
standardową terapię wraz z
leczeniem wspomagającym
TG4010.14
Transgene S.A.
Randomizowane,
prowadzone metodą
podwójnie ślepej próby,
kontrolowane placebo
badanie fazy IIB/III
porównujące terapię
pierwszego rzutu z
zastosowaniem lub bez
zastosowania produktu
immunoterapii TG4010 u
pacjentów z IV stadium
niedrobnokomórkowego raka
płuca (NSCLC)
CA184-156
Bristol-Myers Squibb
Randomizowane
wieloośrodkowe podwójnie
utajnione badanie fazy 3
porównujące skuteczność
ipilimumabu dodanego do
epozydu/platyny z
Milanowski – Główny Badacz
Dr Magdalena WójcikSuperczyńska
Dr Robert Kieszko
Dr Michał Szczyrek
Prof. dr hab. n. med. Janusz
Milanowski – Główny Badacz
Dr Magdalena WójcikSuperczyńska
Dr Michał Szczyrek
Otwarcie ośrodka 28.11.12
Rekrutacja zatrzymana
Prof. dr hab. n. med. Janusz
Milanowski – Główny Badacz
Dr Robert Kieszko
Dr Izabela Chmielewska
Dr Marta Adamczyk-Korbel
Otwarcie ośrodka 4.01.2013
Rekrutacja zakończona
Załącznik nr 1 do Zarządzenia Wewnętrznego nr DN.021/37/2013
7.
8.
epozydem/platyną u
pacjentów z nowo
rozpoznanym stadium
zaawansowanym
drobnokomórkowego raka
płuc (ED-SCLC)
EC-FV-07
Endocyte, Inc.
Otwarte badanie fazy II,
prowadzone z randomizacją,
oceniające stosowanie
preparatu EC145 w
schemacie jednolekowym
oraz schematu skojarzonego
z użyciem preparatu EC145
plus docetaksel w
porównaniu do samego
docetakselu u pacjentów z
pozytywną ekspresją
receptora kwasu foliowego
[FR(++)] ze zdiagnozowanym
niedrobnokomórkowym
rakiem płuca leczonych
chemioterapią drugiego rzutu
P903-25
Cerexa, Inc.
Wieloośrodkowe,
międzynarodowe,
randomizowane badanie
prowadzone metodą
podwójnie ślepej próby,
oceniające skuteczność i
bezpieczeństwo stosowania
fosamilu ceftaroliny w
porównaniu z ceftriaksonem
Prof. dr hab. n. med. Janusz
Milanowski – Główny Badacz
Dr Magdalena WójcikSuperczyńska
Dr Izabela Chmielewska
Dr Marta Adamczyk-Korbel
Otwarcie ośrodka 5.04.2013
Rekrutacja zakończona
Prof. dr hab. n. med. Janusz
Milanowski – Główny Badacz
Dr Izabela Chmielewska
Dr Magdalena WójcikSuperczyńska
Dr Michał Szczyrek
Dr Emilia Naróg
Otwarcie ośrodka 8.05.13
Zamknięcie ośrodka
12.02.2014
Załącznik nr 1 do Zarządzenia Wewnętrznego nr DN.021/37/2013
skojarzonym z wankomycyną
u dorosłych pacjentów z
pozaszpitalnym bakteryjnym
zapaleniem płuc przy
podejrzeniu zakażenia
Staphylococcus aureus
opornym na metycylinę