OPIS MODUŁU KSZTAŁCENIA
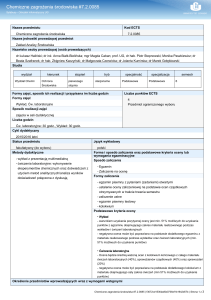
NAZWA PRZEDMIOTU/MODUŁU KSZTAŁCENIA: Chemia środowiska
Kod przedmiotu:……………………………………………………………………………….
Rodzaj przedmiotu: podstawowy; obowiązkowy
Wydział: Wydział Nauk o Materiałach i Środowisku
Kierunek: Inżynieria środowiska
Specjalność (specjalizacja): Inżynieria ochrony środowiska
Poziom studiów: drugiego stopnia
Profil studiów: ogólnoakademicki
Forma studiów: zaoczne
Rok: I
Semestr: 1I
Formy zajęć i liczba godzin: wykłady – 18; ćwiczenia laboratoryjne - 18
Język/i, w którym/ch realizowane są zajęcia: polski (możliwy angielski)
Liczba punktów ECTS: 5
Osoby prowadzące:
wykład: dr Wojciech Prus
inne formy zajęć: ćwiczenia laboratoryjne - dr Wojciech Prus
* – pozostawić właściwą nazwę
1. Założenia i cele przedmiotu: Poszerzenie wiedzy o substancjach występujących w
środowisku, ich właściwościach, przemianach, obiegu w przyrodzie oraz wybranych
metodach badania.
2. Określenie przedmiotów wprowadzających wraz z wymaganiami wstępnymi:
Matematyka
- definiuje funkcje i obrazy rekurencyjne
- interpretuje i wyjaśnia zależności funkcyjne, ujęte w postaci wzorów, tabel,
wykresów, schematów i stosuje je w zagadnieniach praktycznych
- zna właściwości funkcji logarytmicznej
- obrazuje dane zależne na wykresie
- wykonuje proste obliczenia dla funkcji modelowych (równanie funkcji jednej i
wielu zmiennych)
Statystyka
- szacuje błędy wielkości obliczanych na podstawie pomiarów metodą różniczki
zupełnej i pochodnej logarytmicznej
- oblicza parametry określające precyzję, poprawność i dokładność
- oblicza parametry modelu metodą najmniejszych kwadratów (regresja i korelacja)
- wykonuje obliczenia w arkuszu kalkulacyjnym
Fizyka
- interpretuje zjawiska oddziaływania promieniowania z materią substancjalną na
poziomie molekularnym
- przedstawia podstawowe właściwości elektryczne i magnetyczne materii
1
Chemia ogólna / fizyczna
- zna treść podstawowych praw chemicznych
- wykonuje obliczenia stechiometryczne na podstawie równania reakcji chemicznej
- określa jakościowo względne wartości parametrów atomowych, np. potencjał
jonizacji, powinowactwo do elektronu, elektroujemność, promień atomowy, na
podstawie położenia pierwiastka w układzie okresowym
- klasyfikuje rodzaje wiązań chemicznych i oddziaływań międzycząsteczkowych
- przedstawia modele wiązań chemicznych i oddziaływań międzycząsteczkowych na
poziomie molekularnym
- opisuje cechy substancji na poziomie molekularnym charakterystyczne dla
różnych stanów skupienia materii
- interpretuje zjawiska makroskopowe poprzez opis procesów i właściwości
substancji na poziomie molekularnym
- opisuje zjawiska powierzchniowe (przedstawia klasyczne modele)
- zapisuje równania dysocjacji elektrolitycznej
- wykonuje obliczenia dotyczące równowag jonowych w roztworach wodnych
- oblicza stężenia form elektrolitów słabych w roztworach wodnych
- posługuje się skalą pH
- definiuje termodynamiczne funkcje stanu
- oblicza wartości funkcji stanu układu i ich zmiany wynikające z przemian
chemicznych (prawo Hessa i reguła Lavoisiera-Laplace’a)
- rozróżnia pojęcia rzędu i cząsteczkowości reakcji
- formułuje równania kinetyczne reakcji chemicznej oraz równanie Arrheniusa na
podstawie funkcji rozkładu energii kinetycznej (Maxwella-Boltzmanna)
- wykonuje obliczenia na podstawie prawa działania mas (Guldberga i Waagego)
- przedstawia istotę procesów katalitycznych
- wiąże stałą równowagi chemicznej z entalpią swobodną reakcji, a także entalpią i
temperaturą (równanie van’t Hoffa)
- oblicza parametry gazów dla ich przemian fizycznych i chemicznych na podstawie
modelu gazu doskonałego (równanie Clapeyrona)
- określa granice stosowalności modelu gazu doskonałego
- bilansuje równania reakcji utleniania i redukcji
- przewiduje kierunek przebiegu samorzutnych procesów elektrochemicznych i
redox na podstawie szeregu napięciowego
- oblicza potencjał półogniwa I rodzaju w warunkach niestandardowych
- oblicza napięcie rozkładowe na podstawie danych tabelarycznych
- przedstawia schematy układów elektrochemicznych
- wykonuje obliczenia dotyczące elektrolizy
- oblicza wartości parametrów charakteryzujących przewodzenie prądu
elektrycznego przez roztwory elektrolitów
Chemia analityczna
- zna zasady bezpiecznej pracy w laboratorium
- przenosi ilościowo substancje stałe i roztwory
- posługuje się szkłem miarowym
- miareczkuje roztwory wobec wskaźników
- wykonuje obliczenia na podstawie wyników miareczkowania
- fotometruje kiuwety z próbkami
Chemia organiczna
- rysuje wzory grup funkcyjnych związków organicznych
- zna zasady nazewnictwa podstawowych grup związków organicznych
- zapisuje równania podstawowych typów reakcji związków organicznych
2
3. Opis form zajęć
a) Wykłady
Treści programowe (tematyka zajęć):
1. Charakterystyka geoekosystemów.
2. Budowa atmosfery, reakcje chemiczne zachodzące w różnych warstwach atmosfery
3. Rola atmosfery w bilansie cieplnym Ziemi
4. Rola wody w przyrodzie
5. Przemiany substancji w środowisku wodnym.
6. Formy występowania substancji organicznych i nieorganicznych w wodach naturalnych.
7. Budowa, rola i właściwości litosfery.
8. Chemia analityczna próbek środowiskowych
9. Podstawowe zanieczyszczenia nieorganiczne i organiczne w środowisku.
10. Krążenie pierwiastków chemicznych w środowisku, cykl węgla, azotu, siarki i fosforu.
11. Zanieczyszczenie środowiska chemikaliami – samooczyszczanie oraz usuwanie
zanieczyszczeń metodami chemicznymi.
12. Charakterystyka zjawisk powierzchniowych.
Metody dydaktyczne: wykład z prezentacją multimedialną i dyskusją
Forma i warunki zaliczenia: Egzamin pisemny – 10 pytań: 3 zadania rachunkowe, 3 pytania
dotyczące metod badania próbek środowiskowych, 3 pytania
dotyczące interpretacji i mechanizmów przemian chemicznych,
stanów równowagi, zjawisk transportu, 1 pytanie dodatkowe z
zakresu wybranej z wymienionych grup. Uzyskanie połowy lub
więcej maksymalnej liczby punktów.
Wykaz literatury podstawowej i uzupełniającej (maksymalnie 5 pozycji w każdej grupie):
Literatura podstawowa:
1. G.W. vanLoon, S.J.Duffy, Chemia środowiska, Wydawnictwo Naukowe PWN, Warszawa
2007
2. J.E. Andrews i in., Wpowadzenie do chemii środowiska, WN-T, Warszawa 1996
3. I. Williams, Environmental Chemistry, A Modular Approach, Wiley & Sons 2001
4. R.A. Bailey et al., Chemistry of the Environment, Academic Press, New York 2002
5. B.J. Alloway i in., Chemiczne podstawy zanieczyszczenia środowiska, Wydawnictwo
Naukowe PWN, Warszawa 1999
Literatura uzupełniająca:
1. Red. R. Buczkowski, Wybrane zagadnienia proekologiczne w chemii, UMK, Toruń 2002
2. J.R. Dojlido, Chemia wód powierzchniowych, Wydawnictwo Ekonomia i Środowisko,
Białystok 1995
3. S.F. Zakrzewski, Podstawy toksykologii środowiska, Wydawnictwo Naukowe PWN,
Warszawa 1995
4. J.E. Andrews i in., Wpowadzenie do chemii środowiska, WN-T, Warszawa 1996
5. Z. Kęcki, „Podstawy spektroskopii molekularnej”, PWN, Warszawa 1998
3
b) Ćwiczenia laboratoryjne
Treści programowe (tematyka zajęć):
1.
Zastosowanie
chelatów
spektrofotometrycznych
2.
Badanie utlenialności próbek wody (parametry sumaryczne)
3.
Badanie zasadowości wód naturalnych metodą acydymetryczną
4.
Badanie twardości wody metodą wersenianową
5.
Wykrywanie fenoli
cienkowarstwowej
6.
Oznaczanie chlorków metodą Mohra (precypitometria)
i
wewnętrznych
wybranych
w
składników
metodach
roślin
ekstrakcyjnych
metodą
i
chromatografii
Metody dydaktyczne: ćwiczenia laboratoryjne z rotacją stanowisk
Forma i warunki zaliczenia: kolokwium wstępne, sprawozdanie
Wykaz literatury podstawowej i uzupełniającej (maksymalnie 5 pozycji w każdej grupie):…
Literatura podstawowa:
1. Minczewski, Z. Marczenko, „Chemia Analityczna. T.3. Analiza Instrumentalna”, PWN,
Warszawa 1998.
2. Z.S. Szmal, T. Lipiec, „Chemia analityczna z elementami analizy instrumentalnej”,
Wydanie VII, Wydawnictwo Lekarskie PZWL, Warszawa 1996
3. W. Szczepaniak, „Metody instrumentalne w analizie chemicznej”, Wydawnictwo
Naukowe PWN, Warszawa 2008
4. Praca zbiorowa pod redakcją M. Kamińskiego i R. Kartanowicza, „Chromatografia
cieczowa”, Centrum Doskonałości Analityki i Monitoringu Środowiskowego, Gdańsk
2004.
5. J. Namieśnik, Z. Jamrógiewicz, M. Pilarczyk, L. Torres, „Przygotowanie próbek
środowiskowych do analizy”, WNT, Warszawa 2000.
Literatura uzupełniająca:
1. Praca zbiorowa pod redakcją P. Konieczki i J. Namieśnika, „Ocena i kontrola jakości
wyników pomiarów analitycznych”. WNT, Warszawa 2007
2. Praca zbiorowa pod redakcją M. Biziuka,
unieszkodliwianie”. WNT, Warszawa 2007
„Pestycydy,
występowanie
i
3. Praca zbiorowa pod redakcją R. Gadzała-Kopciuch i B. Buszewski, „Fizykochemiczne
metody analizy w chemii środowiska. Ćwiczenia laboratoryjne z analityki i kontroli w
ochronie środowiska. Część I, Wydawnictwo UMK, Toruń 2003
4. Praca zbiorowa pod redakcją B. Buszewski i P. Kosobucki, „Fizykochemiczne metody
analizy w chemii środowiska. Ćwiczenia laboratoryjne z ochrony wód i gleb. Część II,
Wydawnictwo UMK, Toruń 2003
4