Mykoplazma, czyli laboratoryjna
zmora wszystkich „komórkowców”
Bakterie z rodziny Mycoplasma potrafią „zatruć” (nie tylko w cudzysłowie)
życie wszystkim pracującym z hodowlami komórkowymi, czy tkankowymi w
warunkach in vitro. Te małe, pozbawione ściany komórkowej
drobnoustroje, w przeciwieństwie do innych typów bakterii są oporne na
rutynowo stosowane antybiotyki, takie jak penicylina, czy inne β-laktamy
(powodujące rozkład peptydoglikanu, będącego głównym składnikiem
bakteryjnej ściany komórkowej). Ich nieprzeciętne wymiary (0,3 – 0,8 µm
średnicy, czyli około 5 razy mniej niż pojedyncza komórka Escherichia
coli!) powodują kolejny problem — bakterie te przechodzą przez
powszechnie stosowane w sterylizacji celulozowe lub poliwinylowe filtry o
średnicy porów 0,45 µm. Nasze laboratoryjne hodowle komórkowe
stanowią dla nich idealne środowisko życia, gdyż do ich wzrostu konieczne
są takie katabolity, jak na przykład cholesterol, aminokwasy, kwasy
tłuszczowe, czy witaminy. Gdy dodamy do tego ich kolejną cechę, jaką jest
niestabilność osmotyczna (komórki osłonięte są jedynie prostą błoną
komórkową) — wyjaśnia się, dlaczego te drobnoustroje mogą być
laboratoryjną zmorą.
Brzmi nieciekawie? Niestety jest znaczniej gorzej. Nawet pracując w idealnie
sterylnych warunkach zakażamy hodowle komórkowe tymi bakteriami sami,
najczęściej poprzez zanieczyszczone składniki pożywek hodowlanych. Nie mamy
pojęcia, że doszło do zakażenia, gdyż drobnoustroje te przyczepiają się do
powierzchni komórek eukariotycznych (czerpiąc od nich składniki pokarmowe),
przez co nie obserwujemy charakterystycznego dla zakażenia bakteryjnego
zmętnienia pożywki. Niczego nie świadomi prowadzimy hodowlę, w której
zainfekowane komórki przechodzą szereg przemian, takich jak na przykład
zmiany w metabolizmie i wzroście, czy aberracje chromosomowe, przez co wyniki
naszych doświadczeń mogą znacząco odbiegać od rzeczywistych obserwacji.
Jak więc tego uniknąć? Po pierwsze, rutynowo testować wszystkie linie
komórkowe na obecność Mycoplasma sp. Istnieje kilka metod, które są
wykorzystywane w tym celu, z których godne polecenia są dwie poniższe.
Test genetyczny — PCR
Metodą łańcuchowej reakcji polimeryzacji możemy szybko i tanio wykryć
obecność tych niepożądanych drobnoustrojów. Zestaw specyficznych starterów
(które zapewnia np. Primagen), specyficznych względem sekwencji w operonie
rRNA (wysoko zmiennego regionu, pomiędzy genami podjednostek 16S i 23S)
wykrywa wszystkie szczepy Mycoplasma. Zalecane jest wykonanie dwóch reakcji:
PCR1, w której matrycą w reakcji jest DNA wyizolowane z hodowli komórkowej
oraz PCR2, gdzie matrycę stanowi produkt reakcji 1 (tak zwany zagnieżdżony
PCR, z ang. nested PCR). Wykonanie PCR2 zwiększa znacząco czułość testu,
umożliwiając wykrycie nawet bardzo słabej infekcji.
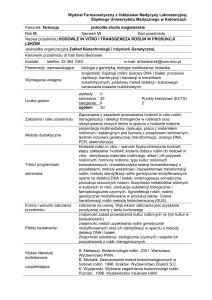
PCR na Mycoplasma sp.
Fotografia przedstawiająca wynik testu PCR na obecność mykoplazmy w
hodowlach komórkowych. Specyficzny produkt pojawił się we wszystkich
przetestowanych liniach (brak prążka jedynie w próbce będącej negatywną
kontrolą - ostatnia studzienka).
Uwagi (z życia wzięte): Główną zaletą tej metody jest jej prostota i szybkość
wykonania (wynik testu dostajemy jeszcze tego samego dnia). Za jej stosowaniem
przemawia także niski koszt wykonania eksperymentu. Jednakże, istnieje jedna
zasadnicza wada — test ten jest bardzo czuły i nie nadaje się do wykorzystania w
laboratoriach średniej czystości, gdyż specyficzne produkty reakcji 2 mogą
pojawiać się nawet w kontroli negatywnej.
Test fluorescencyjnego barwienia DNA
Inną metodą wykorzystywaną do identyfikacji zakażenia Mycoplasma sp. w
hodowlach in vitro jest barwienie DNA za pomocą takich substancji, jak Hoechst
(33258, 33324 lub 34580), czy DAPI. W tym celu konieczny jest pasaż komórek na
wcześniej wysterylizowane szkiełka mikroskopowe, a po kilku dniach hodowli
(zazwyczaj 3-4) utrwalenie i wybarwienie takich preparatów. Zalecanym
utrwalaczem jest mieszanina kwasu octowego i metanolu (w stosunku 1:3). Tak
przygotowane preparaty analizuje się za pomocą mikroskopu, wzbudzając
fluorescencję odpowiednią długością fali świetlej. Jeśli obserwujemy świecenie
jedynie jąder komórkowych to oznacza, że nasze hodowle są czyste. W
przeciwnym wypadku w polu widzenia dostrzec można także małe świecące
punkty (DNA bakteryjne), które znajdują się na obrzeżach pojedynczych komórek,
przyczepione do błony.
Uwagi: Test ten jest wiarygodny, tani i również szybki w wykonaniu (nie licząc
kilku dni hodowli komórek na szkiełkach, które są konieczne, aby umożliwić
wzrost ewentualnych bakterii). Samo barwienie zajmuje mniej czasu niż PCR, a
koszt pojedynczego eksperymentu jest porównywalny lub nawet niższy. Natomiast
niezaprzeczalnymi wadami są: posiadanie specjalistycznej aparatury (mikroskop
fluorescencyjny lub świetlny z możliwością fluorescencji) oraz znacznie mniejsza
czułość metody (słaba infekcja nie zostanie wykryta).
Mam w hodowli mykoplazmę — co robić?
Oczywiście leczyć! Większość linii komórkowych może być z powodzeniem
uwolniona od tych drobnoustrojów poprzez kurację antybiotykiem z grupy
fluorochinolonów (hamujących bakteryjną topoizomerazę — gyrazę DNA), jakim
jest ciprofloksacyna. Do takiej terapii polecam stężenie 5-10 ug/ml przez 2
tygodnie, po czym po około tygodniu od zaprzestania podawania antybiotyku
należy wykonać ponownie test. Jeśli bakterie są nadal obecne w hodowli można
powtórzyć kurację, przy czym należy regularnie obserwować komórki, gdyż
bardziej wrażliwe linie lub komórki pierwotne mogą obumierać.
Mykoplazma zniknęła! Co teraz?
Można uniknąć zakażeń tymi bakteriami poprzez utrzymywanie profilaktycznego
stężenia ciprofloksacyny, które wynosi 0,5 ug/ml. Ilość ta jest całkowicie
nieszkodliwa dla komórek eukariotycznych, natomiast nie pozwala za wzrost
mykoplazmy. Nadal jednak polecam wykonywanie testu w kierunku obecności
tych bakterii (na przykład raz na miesiąc), a w szczególności dla nowych linii
komórkowych!
Fotografie komórek zakażonych przed leczeniem (BEFORE) oraz po leczeniu
antybiotykiem (AFTER) można zobaczyć tutaj.
AM
Data publikacji: 02.05.2016r.