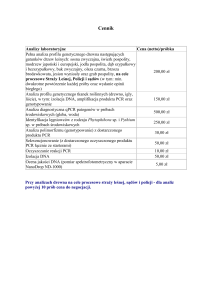
Analiza bioróżnorodności bez PCR
Na łamach ostatniego wydania Applied And Environmental Microbiology
zaprezentowano niezależną od PCR metodę detekcji mikroorganizmów w
próbach środowiskowych. Rozwiązanie opracowane przez grupę
naukowców z Berkeley Lab polega na bezpośredniej hybrydyzacji
materiału genetycznego na mikromacierzy o dużej gęstości o nazwie
PhyloChip.
Macierz PhyloChip, o rozdzielczości 8 471 taksonów z wyodrębnieniem podrodzin,
może zostać wykorzystana na dwa różne sposoby: do bezpośredniej hybrydyzacji
16S rRNA (dirRNA) lub dwuniciowego komplementarnego DNA (dscDNA). Oba
warianty bezpośredniej hybrydyzacji mają wyeliminować odchylenia wynikające z
wcześniejszej amplifikacji materiału genetycznego pochodzącego z wielu różnych
matryc. Małe podjednostki rRNA posiadają także przewagę nad DNA jako marker
molekularny komórek aktywnych metabolicznie — ponieważ stanowią integralny
element struktury rybosomu, a ilość rybosomów koreluje z aktywnością
metaboliczną organizmu. Liczba kopii genu 16S rRNA w sposób liniowy
odzwierciedla etap wegetatywnego wzrostu komórki — pozwala to uzyskać obraz
populacji aktywnej, mającej faktyczny wpływ na procesy zachodzące w
ekosystemie, takie jak wytwarzanie lub neutralizacja toksyn, cykle
biogeochemiczne, czy proliferacja patogenów, podczas gdy pula DNA
ekstrahowanego z prób środowiskowych zawiera również materiał genetyczny
komórek martwych lub form przetrwalnikowych. PhyloChip, dzięki wysokiej
czułości, daje także możliwość detekcji tych mikroorganizmów, których niewielka
ilość nie pozwala na wykrycie metodą klasycznej amplifikacji.
Metody bezpośredniej hybrydyzacji i amplifikację DNA z użyciem PCR porównano
w czterech doświadczeniach, badając grupę kontrolną zawierająca bakterie i
archeony należące do ośmiu różnych taksonów oraz społeczności pochodzące z
trzech środowisk: wód gruntowych z zanieczyszczonej chromem warstwy
wodonośnej, gleby lasu tropikalnego oraz wody morskiej zawierającej oczyszczone
ścieki. Metody dirRNA i dscDNA cechują pewne różnice: hybrydyzacja RNA
wymaga minimalnej ilości manipulacji materiałem środowiskowym, jednak
wprowadza pewne ograniczenia związane z krótkim okresem półtrwania RNA oraz
stosunkowo wysokim poziomem tła; dscDNA pomaga wyeliminować te
ograniczenia przy zastosowaniu dodatkowej, pojedynczej rundy amplifikacji. Obie
metody stanowią odpowiednio czułe, wiarygodne i ekonomiczne rozwiązania w
analizach środowiskowych, a każdą z nich można wykorzystać według
indywidualnych potrzeb i preferencji. W stosunku do wyników amplifikacji DNA
metodą PCR wykazują one wprawdzie mniejszą różnorodność mikrobiologiczną w
próbach, ale za to ukazują istotne różnice w ilości komórek aktywnych i
nieaktywnych. PhyloChip w 2008 roku został laureatem nagrody R&D 100 Award.
Monika Kossakowska
PhyloChip umożliwia niezależną od PCR analizę składu społeczności
mikroorganizmów
Data publikacji: 20.10.2011r.