Lekcja 5 – Zasady zapełniania poziomów orbitalnych.
1. Konfiguracje elektronowe pierwiastków
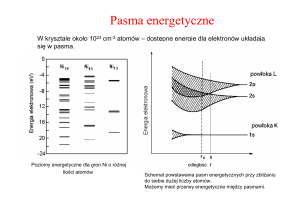
Wraz ze wzrostem liczby atomowej pierwiastka wzrasta liczba
elektronów. Zajmują one kolejne orbitale zaczynając od
najniższych poziomów energetycznych. Kolejność zajmowania
poszczególnych poziomów jest następująca: 1s, 2s, 2p, 3s, 3p, 4s,
3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, co przedstawiono na
rysunku poniżej:
Taka kolejność wynika z faktu, że na kolejnych powłokach jest coraz
więcej podpowłok, a dodatkowo odległości pomiędzy kolejnymi
powłokami są coraz mniejsze.
2. Przy zapełnianiu powłok należy pamiętać o następujących zasadach:
a. Reguła Hunda
- Na podpowłokach pary elektronów powstają dopiero po
zapełnieniu każdego poziomu orbitalnego przez jeden
elektron;
- Elektrony niesparowane na poziomach orbitalnych mają
jednakowy spin
b. Zakaz Pauliego - atom nie może zawierać dwóch elektronów dla
których wszystkie cztery liczby kwantowe miałyby tę samą
wartość. Ponieważ orbital (miejsce przebywania elektronu) jest
opisany przez trzy liczby kwantowe (n, l, i m), a czwarta –
magnetyczno-spinowa liczba kwantowa przyjmuje tylko dwie
wartości więc pojedynczy orbital może pomieścić maksymalnie 2
elektrony różniące się spinem.
3. Elektrony walencyjne – są to elektrony, które podczas reakcji
chemicznej biorą udział w tworzeniu wiązań chemicznych. Mają
najwyższe energie i są słabo związane z atomem. Mają wpływ na
właściwości chemiczne pierwiastka.
4. Rdzeń atomowy – jest to część atomu, która nie uczestniczy w reakcji
chemicznej
i zachowuje liczbę i rodzaj składników. Przy uproszczonym zapisie
konfiguracji elektronowej rdzeń atomowy można zastąpić zapisem [X]
gdzie X to symbol odpowiedniego helowca
5. Przykłady zapisu konfiguracji elektronowej:
K2L3 – zapis powłokowy
5B
1s22s22p1- zapis podpowłokowy
[He] 2s22p1 - zapis skrócony
12Mg
K2L8M2
1s22s22p6 3s2
rdzeń [Ne]
elektrony walencyjne
[Ne] 3s2
21Sc
K2L8M9N2
1s22s22p63s23p6 4s23d1
rdzeń [Ar]
elektrony walencyjne
[Ar] 4s23d1
W przypadku pierwiastków d-elektronowych okazuje sie, że korzystne dla
atomu jest, jeśli powłoka d ma konfiguracje d5 lub d10. Powoduje to zmianę
kolejności zapełnienia powłok dla niektórych pierwiastków np.:
Okres 4-ty:
[Cr] = [Ar]3d54s1
a nie [Ar]3d44s2
[Cu] = [Ar]3d104s1
a nie [Ar]3d94s2