Gabriela Czechura
III rok, OAM
• głównym azotowy produkt katabolizmu białek w ludzkim
organizmie,
• powstaje w przebiegu cyklu mocznikowego zachodzącego w
hepatocytach,
•wydalany głównie przez nerki (90%). Reszta (10%) usuwana
przez skórę (z potem) lub degradowana w przewodzie
pokarmowym przez bakterie jelitowe.
Wartości prawidłowe: 2,9- 6,4 mmol/l (niższe stężenie u dzieci)
•wydalanie mocznika z moczem jest wprost proporcjonalne do wielkości
przesączania kłębuszkowego (GFR),
•to proces ciągły i dlatego we krwi znajduje się zazwyczaj niewielka, stała
ilość azotu mocznikowego (BUN),
•większość chorób nerek lub wątroby może mieć wpływ na stężenie
mocznika we krwi. Jeżeli w wyniku znacznego uszkodzenia wątroby
zaburzeniu ulegają procesy syntezy mocznika, wówczas stężenie BUN
może się obniżyć.
Tzw. blood urea nitrogen (BUN)- określa ilość
azotu zawartą w moczniku krwi. Wartości są
używane zamiennie i można je prosto przeliczać:
mg azotu mocznika x 2,146= mg mocznika (60/28= 2,
146)
mg azotu mocznika x 0,0357= mmol mocznika
Stężenie mocznika w surowicy jest zależne od:
• perfuzji nerek i wielkości diurezy,
• wielkości GFR,
• szybkości syntezy mocznika związanej bezpośrednio z dzienną podażą
białka w diecie i katabolizmem białkowym.
!
Stężenie mocznika w surowicy nie może być bezkrytycznie
używane do oceny przesączania kłębuszkowego (-funkcji nerek).
Wskazania do oznaczania stężenie mocznika w surowicy:
•· różnicowanie przednerkowej i pozanerkowej azotemii (za pomocą
współczynnika mocznik/kreatynina),
•· ocena nasilenia toksemii mocznicowej u chorych z terminalną
niewydolnością nerek,
•· u chorych dializowanych do oceny stanu metabolicznego chorego i nasilenia
katabolizmu białkowego.
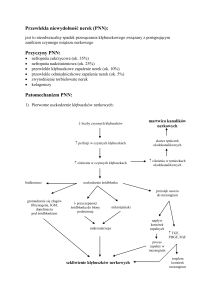
Azotemia
a) Przednerkowa:
•upośledzenie perfuzji nerkowej hipoproteinemie,
utrata ECF, zawał serca)
•łagodne odwodnienie,
•wzmożony katabolizm białkowy (zabieg
operacyjny, ekstremalne głodzenie),
•dieta wysokobiałkowa,
•terapia kortyzolem
b) Nerkowa:
•Ostra, przewlekła niewydolność nerek, gdy spada
filtracja kłębkowa
c) Ponerkowa:
•Dowolna przyczyna obstrukcji przepływu moczu
(np. obecność kamieni, przerost prostaty,
zwężenia nowotworowe).
Niskie stężenie mocznika:
•Obniżona synteza np. za mało aa do
deaminacjii (głodzenie, złe wchłanianie),
•Choroby wątroby (uszkodzona synteza),
•Zatrzymanie wody,
•Rozcieńczenie surowicy wlewami dożylnymi.
W diagnostyce chorób nerek znalazł zastosowanie
współczynnik będący stosunkiem stężenia mocznika
do stężenia kreatyniny w surowicy, za pomocą którego
można różnicować przyczyny azotemii.
Prawidłowa wartość tego współczynnika:
· dla stężeń mocznika i kreatyniny wyrażonych w mmol/l wynosi około 35
· dla wartości wyrażonych w mg/dl wynosi około 25
· dla zależności BUN/kreatynina w mg/dl około 12
Zastosowanie współczynnika mocznik/kreatynina do różnicowania przyczyn azotemii
Wartość współczynnika
mocznik/kreatynina
stężenie stężenie
w mmol/l w mg/dl
25-40
stosunek BUN/
kreatynina [mg/dl]
20-35
10-16
↓
↑
↑
Stężenie
kreatyniny w
surowicy
w normie
w normie
w normie
Przyczyny
Zdrowy pacjent na normalnej diecie i z
prawidłową wartością GFR
*niskie stężenie mocznika (obniżony
katabolizm białek)- dieta niskobiałkowa,
choroba głodowa, ciężkie schorzenia
wątroby, kacheksja;
*obniżony cewkowy wychwyt mocznika- ostra
martwica cewek nerkowych
przednerkowa azotemia:
*stany kataboliczne- dieta wysokobiałkowa
(>200 g/dobę), oparzenia, gorączka, zespół
zmiażdżenia, sterydoterapia, po krwawieniu
do przewodu pokarmowego;
*obniżona perfuzja nerkowa- hipowolemia
(krwawienia, wymioty, biegunki),
niewydolność krążenia
pozanerkowa azotemia: obstrukcja dróg
moczowych, przyczyny przednerkowe
podwyższone nałożona na wcześniej istniejącą chorobę
nerek
Ureaza- dehydrogenaza glutaminowa (GLDH)
spektrofotometryczna analiza mocznika:
ureaza
mocznik
NH4+ + α- ketoglutaran + NADH
•Używana najczęściej,
•Bardzo swoista,
•Szybka.
(NH4)2CO3
GLDH
NAD+ + glutaminian
•Jest cyklicznym bezwodnikiem kreatyny,
•produkowana i wydzielana w stałej ilości, synteza zachodzi w nerkach, wątrobie i
w trzustce, w 2 reakcjach enzymatycznych
•transportowana jest do różnych tkanek (np. do mięśni i mózgu) gdzie ulega
fosforylacji do fosfokreatyny,
•stężenie kreatyniny w surowicy zależy od:
-całkowitej masy mięśniowej
- płci (u mężczyzn jest wyższe niż u kobiet)
- od rodzaju diety (dieta bogatomięsna może podwyższyć stężenie kreatyniny w
surowicy nawet o 30%- w 1kg mięsa znajduje się 2-5g kreatyny).
Mimo tych zależności poziom kreatyniny w surowicy zdrowego człowieka jest
wartością stosunkowo niezmienną (wahania dobowe nie przekraczają 15%
wartości).
Wartości prawidłowe dla kreatyniny są zależne od
zastosowanej metody.
Typowy zakres:
80- 115 µmol/l (mężczyźni)
53- 97 µmol/l (kobiety)
Stężenie we krwi jest odwrotnie proporcjonalne do klirensu
nerkowego (GFR)
!
Kreatynina jest wydalana z organizmu tylko przez nerki. Do
znamiennego podwyższenia stężenia kreatyniny w osoczu
dochodzi dopiero wtedy, gdy znaczna część nefronów ulegnie
uszkodzeniu i GFR obniży się do około połowy wartości
prawidłowej.
Zastosowanie kreatyniny w diagnostyce
laboratoryjnej chorób nerek
1. Metoda enzymatyczna oznaczania kreatyniny przy pomocy
kreatyninazy i kreatynazy:
Kreatynina
Kreatyna
kreatyninaza
H2O
Kreatyna
kreatynaza
H2O → H2O2
sarkozyna + mocznik
+NAD+ + H2O
DF
Sarkozyna + O2 Oksydaza sarkozyny
H2O2 + pochodna fenolu + 4-aminofenazon
Kreatyninaza- amidohydrolaza kreatyniny
Kreatynaza- amidinohydrolaza kreatyny
formaldehyd + glicyna
peroksydaza
barwny związek
DF- dehydrogenaza formaldehydu
HCOOH
+
NADH
+
H+
kreatyninaza
Kreatynina
kreatyna
H2O
Kinaza kreatyny
Kreatyna + ATP
H2O
fosforan kreatyny + ADP
Kinaza pirogronianiowa
Pirogronian + ATP
H2O → H2O2
ADP + fosfoenolopirogronian
Pirogronian + NADH+ + H+
LDH
mleczan + NAD+
2. Sucha chemia. Metody oznaczania kreatyniny:
• Enzymatyczna z deminazą kreatyniny → amoniak + błękit
bromofenolowy (pomiar- 600nm)
• Enzymatyczna z kreatyninazą i kreatynazą
• Reakcja z kwasem 3,5- dinitrobenzoesowym
Wskaźniki do oznaczania stężenia kreatyniny w
surowicy:
– ostre i przewlekłe choroby nerek
– zaburzenia przemiany materii, choroby układowe:
cukrzyca, hiperurykemia, choroby tkanki łącznej
– nadciśnienie tętnicze
– niewydolność krążenia, stan wstrząsu, ostra utrata krwi lub
płynów ustrojowych
– terapia lekami nefrotoksycznymi lub wydalanymi głównie
przez nerki
– uszkodzenie nerek wywołane zatruciem egzogennym,
hemolizą, miolizą
Ograniczenia interpretacji wyników:
1)kreatynina ↑ w okresie dojrzewania, potem spada z
wiekiem (tak jak GFR)
2)Czynniki mające wpływ na poziom kreatyniny (wiek,
płeć, rasa, masa ciała, dieta, leki)
3)Przedział wartości referencyjnych nie koreluje dobrze z
wczesną chorobą nerek
Wzrost stężenia kreatyniny:
•Bez znaczenia fizjologicznego:
- dieta bogata w mięso
-intensywne ćwiczenia
- wpływ leków (np. salicylany)
- interferencje analityczne (np. antybiotyki, cefalosporyny)
•Patologia:
- choroby nerek (dowolna przyczyna obniżonego GFR)
Spadek stężenia kreatyniny:
•Fizjologicznie:
- poród
•Patologia:
- spadek masy mięśni (głodzenie, choroby wyniszczające,
terapia sterydowa)
Współczynnik przesączania kłębuszkowego
(GFR, z ang. glomerular filtration rate)
Ilość osocza przefiltrowana w jednostce czasu przez kłębuszki nerkowe do tzw.
moczu pierwotnego. Zwykle podawany jest w ml/min lub w ml/(min×1,72m²)
(czyli po przeliczeniu na standardową powierzchnię ciała). Współczynnik GFR
pozwala na ocenę stopnia wydolności nerek. Oceniany na podstawie klirensu
egzogennych lub endogennych substancji
Badanie GFR jest wykorzystywane do:
•Wykrycia przewlekłej choroby nerek CDK
• Oceny stopnia zaawansowania CDK
•Ustalenia dawkowania leków wydalanych drogą
przesączania kłębuszkowego
•Badania innych metod terapeutycznych lub wpływu leków
na funkcje nerek
Czynniki wpływające na wartość GFR:
•Zmienność dobowa GFR- najniższe w nocy, najwyższe
rano
•Długotrwała wyprostowana pozycja ciała
•Ciąża
•Cukrzyca
•Dożylna infuzja dopaminy
Jest wydalany wyłącznie drogą przesączania kłębuszkowego
Nie wiąże się z białkami osocza i nie wnika do erytrocytów
Nie podlega wchłanianiu zwrotnemu i sekrecji w kanalikach
Nie ulega przemianom metabolicznym w ustroju
Nie jest wychwytywany przez inne tkanki
Obojętny dla ustroju i środowiska
Tani i łatwo dostępny
Istnieje prosta i dokładna metoda oznaczania
Złoty standard:
klirens nerkowy inuliny (po przesączeniu do
pramoczu nie ulega reabsorpcji ani
wydzielaniu w kanalikach nerkowych)
Srebrne standardy:
klirens nerkowy lub osoczowy 51Cr-EDTA,
125 I- talaminianu jobeksolu
Metoda z wyboru:
- Klirens kreatyniny z 24h zbiórki moczu
Testy przesiewowe
- Obliczanie GFR na podstawie stężenia kreatyniny w surowicy
Stężenie cystatyny C
Klirens (współczynnik oczyszczania)
- objętość osocza całkowicie oczyszczonego z danej
substancji w jednostce czasu. Wyraża sprawność, z jaką
osocze zostaje oczyszczone z danej substancji.
Markery klirensu
nerkowego
Endogenne
•Kreatynina
•Cystatyna C
Egzogenne
•Inulina
•Joheksol
•Chromonowy EDTA
-niska czułość diagnostyczna
-stężenie zależne od masy mięśniowej, jest wyższe u mężczyzn,
osób młodych, rasy czarnej
-jest eliminowana drogą sekrecji kanalikowej, sekrecja nasila się
w miarę spadku GFR
- jest degradowana w jelitach, eliminacja pozanerkowa nasila się
wraz ze spadkiem GFR
-metabolizm i wydzielanie cewkowe są zmieniane przez wiele
leków.
-stosowana rutynowo metoda Jaffe’go ma niską swoistość
-duże zróżnicowanie metodyczne powoduje dużą zmienność
międzylaboratoryjną
1. Wzór Cockcrofta-Gaulta:
2. Wzór MDRD– wzór stworzony na podstawie danych dla pacjentów z
przewlekłą niewydolnością nerek (uczestników programu Modification
of Diet in Renal Disease ) dla zdrowych ludzi wyraźnie niedoszacowuje
GFR, natomiast znacznie lepiej od wzoru CG szacuje GFR dla bardziej
zaawansowanych stadiów PChN.
MDRD Sudy- 4- parametrowe oznaczenie GFR dla osób powyżej 18r.ż.
-kreatynina w surowicy
-wiek
-płeć
-rasa
GFR (ml/min/1.73m2 ) =
186* x kreatynina (surowica) -1,154 x wiek x 0,742 (jeżeli ♀)/ x 1,210 (Afroamerykanie)
***186- dla tradycyjnych kalibratorów
175- dla kalibratorów odnoszących się do IDMS
Ograniczenia:
• Wiek 18-70 lat, rasa biała i Afroamerykanie z GFR <90 mL/min/ 1,73m2
- dobrze wychodzi u cukrzyków
• Gorsza zgodność z mierzonym GFR dla:
- populacji szpialnej
- ostrej niewydolności nerek
- prawidłowej funkcji nerek
• Walidacja obecnie udoskonalana
Lizosomalna proteinaza cysteinowa, produkowana we wszystkich
komórkach ze stałą szybkością.
o Swobodnie filtrowana przez
kłębuszki, nie wydzielana przez
kanaliki proksymalne,
oJej stężenie w osoczu ↑ w
dysfunkcjach cewek nerkowych,
oNiezależna od masy mięśniowej i
diety,
marker dla GFR
•Na jej stężenie wpływa:
-dysfunkcja tarczycy,
- glikokortykoidy
- prawdopodobnie również inne czynniki
- wiek (↑ stężenia po 50 r.ż.),
- rasa,
- płeć
•Stosowana w:
- pediatrii,
- geriatrii,
- w przypadku łagodnego upośledzenia GFR,
- w warunkach braku możliwości zastosowania
kreatyniny
•Ograniczenia Cystatyny C jako markera GFR:
- małe zróżnicowanie metodyczne,
- brak międzynarodowego wzorca Cystatyny C,
- wysoka cena,
- wpływ różnych czynników na jej stężenie
•Inaczej 2,6,8-trioksypuryna
•Powstaje w wyniku degradacji (oksydacji) puryn (adeniny i guaniny) w
hepatocytach. Puryny z katabolizmu kwasów nukleinowych (dieta) są
zamieniane bezpośrednio do kwasu moczowego.
Katabolizm puryn u człowieka:
Adenozyna → inozyna → hipoksantyna→ ksantyna→ kwas moczowy
Guanozyna→ guanina→ ksantyna→ kwas moczowy
Wartości referencyjne:
•dzieci: 120- 320 µmol/l
•mężczyźni: 210- 420 µmol/l
•kobiety: 130-350 µmol/l
Przyczyny obniżonego poziomu :
- ciężki alkoholizm, połączony z chorobami wątroby
-niedobór oksydazy ksantyny
- wysokie dawki salicylanów i witaminy C
-Allopurinol
- kortykosterydy
- choroba Fanconi’ego
- galaktozemia
Przyczyny podwyższonego poziomu krwi:
- wzrost spożycia (dieta mięsna)- fizjologiczne
-wzrost produkcji moczanów: Dna moczanowa, leczenie
chorób mieloproliferacyjnych cytotoksycznymi lekami
-obniżone wydalania: kwasica mleczanowa, choroby
spichrzowania glikogenu typu, podawanie leków,
zatrucia np. ołów, alkohol
- defekty enzymatyczne: choroba Lesh- Nyhan
•Zdrowy człowiek wytwarza 0,4g nukleozydów purynowych i przyjmuje z
dietą dodatkowe 0,3g dziennie. Pacjenci z artretyzmem i zespołem odkładania
się moczanów w tkankach mogą mieć pulę nukleozydów purynowyh rzędu 1930g. Zasady purynowe mogą też wchodzić w reakcję odtwarzania nukleotydów
purynowych.
•Kwas moczowy jest eliminowany z organizmu przez:
przewód pokarmowy- 30%,
nerki-70% (filtracja, reabsorbcja, wydzielanie; w rezultacie cewka
wydziela 6- 12% przefiltrowanego kwasu moczowego)
Wydalanie z moczem: 250-270 mg/ dzień
Jego stężenie w surowicy zależy od wielkości filtracji kłębuszkowej, z tego względu
może służyć do monitorowania funkcji nerek.
pH moczu >5,57
Kwas moczowy zdysocjowany,
stosunkowo dobrze rozpuszczalny
↓ pH moczu
Kwas moczowy w formie
niezdysocjowanej o gorszej
rozpuszczalności.
↓ reabsorpcji moczanów w cewkach
moczowych → wytrącania się
kryształów i tworzenia kamieni
moczowych.
Hiperurykemia:
-niewydolność nerek,
-dna moczanowa,
-nadprodukcja puryn (zespoły mieloproliferacyjne, masywny
rozpad tkanki nowotworowej podczas chemioterapii),
-specyficzne defekty enzymatyczne (np. choroba LeschNyhana),
-leki (diuretyki, salicylany, etambutol, pirazynamid),
-zatrucie ołowiem i alkoholem,
-niedoczynność tarczycy,
-nadczynność przytarczyc,
-kwasica mleczanowa
Artretyzm (podagra, dna moczanowa)
krystalizacja kryształków moczanu sodowego w płynach z jam ciała
np. stawowych i depozyty kryszałków w tkankach otaczających staw.
W cięższych przypadkach następuje dalsze wytrącanie kryształków w
tkankach miękkich. Depozyty te mogą być powodem rozwijającego się
stanu zapalnego (nacieki leukocytarne).
Zaburzenia nerek:
-depozyty moczanów w parenchymie
- depozyty kryształków moczanowych w cewkach i moczowodach→
kamica moczanowa
Dna może być:
-pierwotna (zwykle związana z nadprodukcją kwasu moczowego)
-wtórna (niedostateczne wydalanie kwasu moczowego w chorobach
nerek, wpływ leków, kwasów organicznych itp.).
Wrodzony defekt- choroba Lesh- Nyhana
Jest spowodowana zablokowaniem drogi powrotnego
przekształcania zasad purynowych w nukleotydy
powoduje opóźnienia w rozwoju umysłowym,
dysfunkcję ruchową, zaburzenia neurologiczne
związane z wysokim poziomem kwasu moczowego we
krwi.
Hipourykemia:
- stosowanie niektórych leków (wysokie dawki
salicylanów, witaminy C),
- ciężki alkoholizm, schorzenia wątroby,
- zespół Fanconiego (upośledzenie reabsorpcji przez
komórki kanalików nerkowych),
-chemioterapia z użyciem inhibitorów syntezy puryn (6merkaptopuryna),
- allopurinol (hamuje oksydazę)
- kortykosterydy,
- galaktozemia.
•Z kwasem fosfomolibdenowym:
1. Etapem wstępnym jest odbiałczanie próbki (kwas fosfomolibdenowy
powodowałby wytrącenie się białka z roztworu). Odbiałczanie prowadzi się
mieszaniną siarczanu cynku- wodorotlenek baru.
2.
Do supernatantu dodaje się kwasu fosfomolibdenowego który ulega
redukcji do błękitu molibdenowego przez kwas moczowy w środowisku
zasadowym (odczyt 650- 700nm).
Z metodą interferują:
glukoza,
kwas askorbinowy,
glutation,
cysteina,
leki (acetaminofenon, kwas acetylosalicylowy i pochodne),
inne puryny (teobromina, kofeina, teofilina).
Kwas moczowy
urikaza
alantoina + H2O2 + CO2
(odczyt 293 nm)
•Oznaczanie powstałęgo nadtlenku wodoru:
H2O2+ DHBS + 4- aminofenazon → pochodna benzochinonoiminy (czerwona)
(520nm)
(DHBS= 3,5- dichloro-2-hydroksy- benzenosulfonian)
•Inne metody oznaczania powstałego nadtlenku wodoru:
peroksydaza
substrat + H2O2
barwny produkt
Zakresy wartości referencyjnych kwasu moczowego zależą od metody,
wartości te dla metod oznaczania kwasu moczowego z kwasem
fosforowolframowym są wyższe.
Amoniak syntetyzowany jest we wszystkich organach, głównie powstaje
w przewodzie pokarmowym:
•Degradacja aminokwasów
•Utlenianie aminokwasów
•Hydroliza glutaminy i asparaginy
W żyle wrotnej stężenie amoniaku jest 5- 10 razy wyższe niż w
krążeniu ogólnym. W normalnych warunkach amoniak ulega
przemianie do mocznika, bo jest toksyczny dla OUN (amoniak
pasywnie pokonuje barierę krew- mózg). W fizjologicznym pH
występuje jako NH4+.
Amoniak jest neurotoksyczny! → przechodzi przez
barierę krew-mózg
Wartości prawidłowe: 16-65 µmol/l,
(noworodki 100 µmol/l)
nieprawidłowy amoniak -> dysfunkcje metaboliczne
Znaczenie kliniczne:
Zaburzenie syntezy mocznika:
-nabyte (np.: ciężkie schorzenia wątroby, choroba
Reya-> podwyższony amoniak u noworodków (5001000 umol/l), marskość),
-genetyczne (defekt jednego z enzymów cyklu
mocznikowego)
Hiperamonemia:
•Wrodzone defekty metaboliczne enzymów z cyklu
mocznikowego
•Wrodzone defekty metabolizmu lizyny i ornityny
•Wrodzony defekt metabolizmu kwasów organicznychpropionowego, metylomalonowego, izowalerianowego itd.
•WZW
•Toksyczne zapalenie wątroby
•Marskość wątroby
•Encefalopatia przebiegu marskości (dodatkowo krwawienie
do przewodu pokarmowego powoduje degradację białek krwi z
wytworzeniem amoniaku lub dieta wysokobiałkowa)
Nefropatia powoduje ↑ poziomu mocznika we krwi, wydzielanie do
światła jelita, rozkład do amoniaku
1. Błędy przedlaboratoryjne:
•Palenie papierosów podnosi poziom amoniaku- 1 papieros wypalony 1h
przed pobranie materiału podwyższa o 100% poziom amoniaku
•Atmosfera laboratorium powinna być wolna od oparów amoniaku i dymu
papierosowego.
•Osocze krwi jest materiałem z wyboru (w surowicy poziom amoniaku jest
wyższy)
• Zahamowanie katabolizmu aminokwasów przez natychmiastowe
ochłodzenie próbki krwi w lodzie, szybkie wirowanie krwi.
•Pobieranie krwi na skrzep
•Pobieranie krwi na antykoagulant
2. Pobieranie materiału:
-EDTA (sól dipotasowa)→osocze (we krwi
wynaczynionej deaminacja)
-transport w lodzie
-zamknięta probówka (amoniak z powietrza zawyża
wynik)
a) enzymatyczna (pomiar amoniaku/ jonu amonowego we
krwi) Kwas szczawiobursztynowy + NH + + NAD(P)H + H+
4
Dehydrogenaza kwasu glutaminowego
Kwas glutaminowy + H2O + NAD(P)+
(pomiar 340nm)
Najpopularniejsza, stosowana w automatach, precyzyjna i dokładna.
Manualna lub półmanualna.
b) inne: Conway’a, Seligsona, wymieniacz jonowy, elektroda
jonoselektywna