Uploaded by
common.user1807
Podsumowanie właściwości pierwiastków bloku S i P – zadania chemiczne

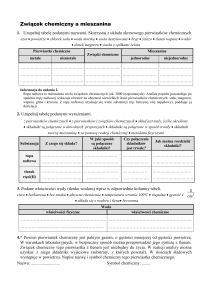
PODSUMOWANIE WŁAŚCIWOŚCI PIERWIASTKÓW BLOKU S I P. 1. Dokończ równania reakcji lub zaznacz, że nie zachodzą: Al2O3 + KOH + H2O → BeO + KOH → Al + HNO3 stęż. → Al + NaOH + H2O → Al(OH)3 + LiOH → Be(OH)2 + NaOH → 2. Zapisz równania reakcji: - tetrahydroksoglinianu sodu z kwasem solnym - ortoglinianu sodu z kwasem siarkowym (VI) - heksahydroksochromianu (VI) potasu z kwasem azotowym (V) - metaglinianu sodu z kwasem solnym - rozkładu temperaturowego wodorowęglanu sodu - węgliku wapnia z wodą - krzemionki z kwasem fluorowodorowym - kwasu azotowego (V) z węglem - kwasu azotowego (V) z fosforem - rozcieńczonego kwasu azotowego (V) ze srebrem - wodoroortofosforanu (V) potasu z kwasem ortofosforowym (V) - fluoru z wodą - jodu z bromkiem potasu - prażenie heksahydroksoglinianu sodu 3. Zaprojektuj doświadczenie w którym odróżnisz chlorek potasu od jodku potasu. W tym celu marysuj odpowiedni rysunek, zapisz obserwacje i wnioski. 4. Do spawania szyn używa się tak zwanej reakcji aluminotermii. Polega ona na tym, że sporządza się tzw. mieszaninę termitową (sproszkowany glin i tlenek żelaza (III)). Po wpływem temperatury wydziela się metaliczne żelazo kosztem utleniania glinu. Zapisz tę reakcję chemiczną. 5. Wartość iloczynów rozpuszczalności AgCl, AgBr, AgJ wynosi odpowiednio: 2·10-10, 8·10-13, 2·10-16. Do roztworu zawierającego jony Cl-, Br-, J- o identycznych stężeniach dodajemy kroplami roztwór azotanu (V) srebra. Jaka jest kolejność wytracania osadów? 6. Dokończ równanie reakcji: dichromianu (VI) potasu z jodkiem potasu i kwasem siarkowym (VI). Współczynniki dobierz metodą bilansu jonowo-elektronowego. 7. Ile gramów gipsu palonego otrzymano w wyniku prażenia 172g gipsu naturalnego? 8. Dwa pierwiastki chemiczne oznaczono literami X i Y. Wiadomo, że: • suma elektronów walencyjnych w atomach obu pierwiastków wynosi 12, • elektrony walencyjne pierwiastków X i Y rozmieszczone są w dwóch podpowłokach, przy czym w przypadku pierwiastka X należą do różnych powłok elektronowych, • pierwiastek Y tworzy z fluorem związek chemiczny, w którym występuje na II stopniu utlenienia, • promienie atomowe pierwiastków X i Y są najmniejsze w grupach, w których położone są te pierwiastki chemiczne. a) Napisz powłokową konfigurację elektronową atomu pierwiastka X i określ liczbę powłok elektronowych całkowicie zapełnionych elektronami w jego atomie. b) podaj informacje dotyczące położenia pierwiastka X w układzie okresowym: Numer grupy, Numer okresu, Symbol bloku konfiguracyjnego c) Napisz nazwę pierwiastka Y i narysuj wzór elektronowy kreskowy związku chemicznego pierwiastka Y z fluorem. 9. Przyporządkuj kryształom podanych substancji A–D opis ich właściwości 1–5. Jeden z opisów nie pasuje do żadnego z kryształów. A. zestalony argon B. fluorek wapnia C. krzem D. lód 1. W krysztale tym występuje gaz elektronowy, czyli chmura zdelokalizowanych elektronów, odpowiedzialna za przewodzenie prądu elektrycznego przez ten kryształ. 2. Kryształ ten jest kruchy i dopiero po stopieniu przewodzi prąd elektryczny. 3. Polarne cząsteczki tworzące ten kryształ silnie oddziałują ze sobą za pomocą oddziaływań międzycząsteczkowych typu dipol–dipol. 4. Kryształ tej substancji jest miękki, nie przewodzi prądu elektrycznego, topi się w niskiej temperaturze i dobrze rozpuszcza się w rozpuszczalnikach niepolarnych. 5. Silne wiązania kowalencyjne między drobinami budującymi ten kryształ sprawiają, że jest on twardy, trudno rozpuszczalny zarówno w rozpuszczalnikach polarnych, jak i niepolarnych oraz ma wysoką temperaturę topnienia. 10. Które ze zdań są prawdziwe? 1. Hybrydyzacja orbitali walencyjnych atomów węgla w graficie i diamencie jest jednakowa. 2. Grafit i diament są jedynymi znanymi odmianami alotropowymi węgla. 3. Grafit i diament mają różne właściwości fizyczne, ale takie same właściwości chemiczne. 4. Grafit jest dobrym przewodnikiem prądu elektrycznego ze względu na obecność w jego strukturze zdelokalizowanych orbitali p. 11. Pod wpływem kwasu chlorowodorowego (solnego) z 28,4 g mosiądzu (stopu miedzi z cynkiem) zebrano w warunkach normalnych 6,8 dm3 wodoru. Obliczyć skład procentowy stopu. 12. Wyprowadzić wzór uwodnionego siarczanu miedzi wiedząc, że 7,5 g tego związku podczas prażenia traci 2,7 g wody. 13. Obliczyć stężenie jonów wodorotlenowych w 0,1 M roztworze amoniaku, którego stała dysocjacji wynosi 1,75 · 10−5 (przyjąć, że α < 5%). 14. Do jakiej objętości należy rozcieńczyć 50 cm3 0,1 M roztworu HNO3, aby pH otrzymanego roztworu wynosiło 2. 15. Woda morska ma pH w granicach 7,8 - 8,3. Ile razy należy zwiększyć (lub zmniejszyć) stężenie jonów wodorowych, aby jej pH: a) wzrosło o 2 b) zmalało o 3.