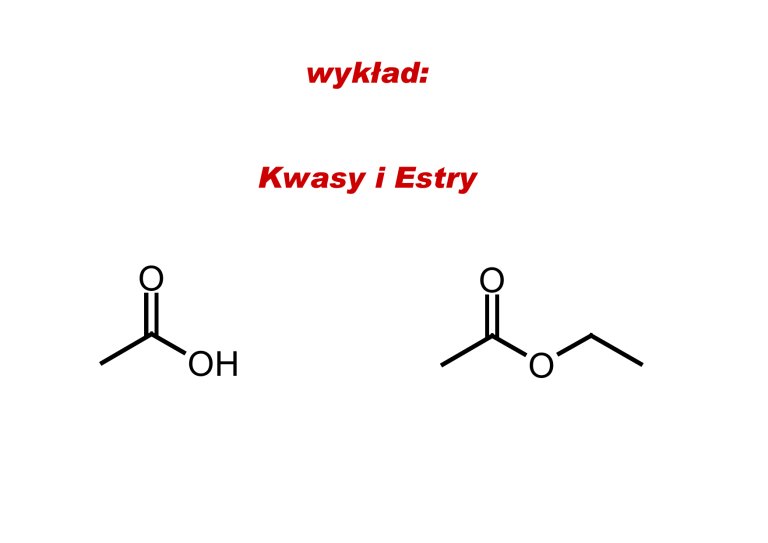
wykład:
Kwasy i Estry
O
O
OH
O
!
Grupa karbonylowa
Grupa karbonylowa - grupa funkcyjna występująca w wielu typach związków
organicznych, składająca się z atomu węgla połączonego wiązaniem podwójnym z atomem
tlenu.
O
O
H
R
aldehyd
R
R
keton
RCHO
RCOR
O
R
O
R
O
OH
kwas
karboksylowy
RCO2H
R
grupa
karbonylowa
z
O
OR'
R
O
O
Cl
ester kwasu
karboksylowego
chlorek
kwasowy
RCO2R'
RCOCl
R
O
R'
bezwodnik
kwasowy
!
Grupa karboksylowa
Grupa karboksylowa – grupa funkcyjna w kwasach karboksylowych, dzięki której wykazują
one właściwości kwasowe.
O
grupa
karboksylowa
R = alkil, aryl, H
OH
R
Grupa karboksylowa ulega dysocjacji elektrolitycznej w roztworze wodnym dając anion
karboksylanowy. KaŜdy kwas karboksylowy ma swoją charakterystyczną stałą kwasowości Ka,
która jest miarą jego mocy.
O
O
+ H2O
R
OH
R
O
_
+ H3O
+
_
Ka =
[RCOO ][H3O + ]
[RCOOH]
pKa = -logKa
HCl
-7
około 10-5 (~0.1% zdysocjowanych czą steczek)
im mniejsza wartoś ć tym silniejszy kwas
CH3CO2H
4.75
H2CO3
6.52
CH3CH2OH
16
!
!
Grupa karboksylowa
Moc kwasu karboksylowego zaleŜy od wpływu podstawników na efekt mezomeryczny
stabilizujący anion karboksylanowy.
_
O
R
O
O
O
_
R
R
O
_
O
Podstawniki elektronoakceptorowe stabilizują jon karboksylanowy i zwiększają moc kwasu.
Podstawniki elektronodonorowe zmniejszają moc kwasu.
Wpływ ma takŜe odległość podstawnika od grupy karboksylowej.
kwas
CH3CO2H CH2ClCO2H CHCl2CO2H CCl3CO2H CF3CO2H
pKa(H2O) ~4.8
2.9
1.3
0.8
0.0
CO2H
Cl
CO2H
kwas masłowy
pKa(H2O)
4.8
Cl
CO2H
kwas α-chloromasłowy
4.5
CO2H
kwas β-chloromasłowy
4.1
Cl
kwas γ-chloromasłowy
2.9
!
Kwasy karboksylowe: nazewnictwo
Znajdujemy najdłuŜszy łańcuch węglowy zawierający grupę karboksylową i numerujemy
atomy węgla przypisując grupie karboksylowej numer 1.
Nazywamy łańcuch główny i tworzymy nazwę przez dodanie słowa kwas i przyrostek –owy.
O
kwas metanowy
(kwas mrówkowy)
O
OH
OH
H
kwas heksanowy
(kwas kapronowy)
O
kwas etanowy
(kwas octowy)
O
kwas heptanowy
(kwas enantowy)
OH
OH
O
kwas propanowy
(kwas propionowy)
O
kwas oktanowy
(kwas kaprylowy)
OH
OH
O
kwas butanowy
(kwas masłowy)
O
OH
OH
O
kwas pentanowy
(kwas walerianowy)
OH
kwas nonanowy
(kwas pelargonowy)
O
kwas dekanowy
(kwas kaprynowy)
OH
!
Kwasy karboksylowe: nazewnictwo
Kwasy, w których grupa karboksylowa jest związana z układem pierścieniowym, zyskują
końcówkę – karboksylowy.
CO2H
kwas cykloheksanokarboksylowy
CO2H
kwas benzenokarboksylowy
(kwas benzoesowy)
Kwasy karboksylowe: nazewnictwo
Identyczną końcówkę zyskują kwasy łańcuchowe posiadające więcej niŜ dwie grupy
karboksylowe (atomy węgla w grupie karboksylowej nie są numerowane i nie biorą udziału w
tworzeniu nazw macierzystego węglowodoru).
CO2H
HO2C
4
8
1
CO2H
kwas oktano-1,4,8-trikarboksylowy
JeŜeli grupa hydroksylowa występuje jako układ podstawnika to zyskuje przedrostek –
karboksy.
CO2H
CO2H
kwas 3-(karboksymetylo)benzoesowy
Kwasy karboksylowe: właściwości fizyczne
Kwasy karboksylowe są mało lotne. Wraz ze wzrostem wielkości cząsteczki wzrastają
temperatury topnienia i wrzenia kwasów karboksylowych.
Kwasy zawierające od 1 do 4 atomów węgla w cząsteczce mieszają się z wodą w kaŜdym
stosunku, a zawierające do 12 atomów węgla w cząsteczce, rozpuszczają się dobrze w
alkoholu.
NiŜsze kwasy karboksylowe są cieczami o ostrym zapachu, kwasy o średniej wielkości są
oleistymi cieczami o przykrej woni, a kwasy długołańcuchowe ciałami stałymi lub cieczami w
zaleŜności od stopnia nienasycenia.
O
H
O
OH
O
OH
O
OH
O
OH
OH
kwas mrówkowy kwas octowy
kwas propionowy kwas masłowy kwas walerianowy
o
o
t.top. 8.3 C
t.top. 16.2 C t.top. 23.5 oC
t.top. -4.5 oC
t.top. -34.5 oC
t.wrz. 100.5 oC t.wrz. 117.5 oC t.wrz. 141.0 oC
t.wrz. 162.0 oC t.wrz. 186.5 oC
O H O
R
R
O H O
!
Dimery kwasów karboksylowych stabilizowane są wiązaniem wodorowym.
!
Kwasy karboksylowe: otrzymywanie
Aromatyczne kwasy karboksylowe otrzymuje się w wyniku utlenienia odpowiednich
alkilobenzenów.
CH3
1) KMnO4/NaOHaq
2) HClaq
CO2H
CO2H
1) KMnO4/NaOHaq
2) HClaq
kwas
benzoesowy
toluen
CH3
CH3
CO2H
kwas
tereftalowy
p-ksylen
Utlenianie alkoholi pierwszorzędowych i aldehydów.
OH
H3C
H
H
1o alkohol
etylowy
O
[O]
H3C
O
[O]
H
aldehyd
octowy
H3C
OH
kwas
octowy
!
Kwasy karboksylowe: otrzymywanie
Addycja ditlenku węgla do związków Grignarda jest generalną metodą otrzymywania kwasów
karboksylowych.
Br
MgBr
Mg/Et2Obezwodny
bromobenzen
Br
Mg/Et2Obezwodny
bromek tert-butylu
1) CO2
2) HClaq
bromek
fenylomagnezowy
1) CO2
MgBr 2) HClaq
bromek
tert-butylomagnezowy
CO2H
kwas
benzoesowy
CO2H
kwas
piwalowy
François Auguste Victor Grignard 1871-1935
chemik francuski, noblista
!
O
Reakcje kwasów karboksylowych
R
O H
Grupa karbonylowa nie ulega redukcji za pomocą wodoru w obecności katalizatora (Pd, Pt).
Do jej redukcji wymagane są polarne reduktory (LiAlH4, B2H6).
CO2H
1) BH3 w THF
2) H3O+
kwas
fenylooctowy
OH
2-fenyloetanol
CO2H C17H33CO2H
kwas oleinowy
kwas (Z)-oktadek-9-enowy
1) LiAlH4
2) H3O+
OH (Z)-oktadec-9-en-1-ol
O
!
Reakcje kwasów karboksylowych
R
O H
Kwasy karboksylowe tworzą sole z metalami, tlenkami metali, wodorotlenkami i węglanami.
Większość soli kwasów karboksylowych jest dobrze rozpuszczalna w wodzie. Wyjątek
stanowią sole wapnia i magnezu.
Nazwy soli kwasów karboksylowych tworzy się poprzez zamianę końcówki
-owy na -an lub -ian.
CO2H
CO2Na
+ H2O
+ NaOH
kwas
benzoesowy
CO2H
benzoesan sodu
+ KOH
kwas pentanowy
CO2K
+ H2O
pentanian potasu
kwas stearynowy + NaOH
CO2Na
stearynian sodu
+ H2O
!
O
Reakcje kwasów karboksylowych
Dekarboksylacja – usunięcie grupy karboksylowej z cząsteczki
O H
R
kwasu karboksylowego z wydzieleniem cząsteczki ditlenku węgla.
O
Cykl kwasu cytrynowego lub cykl
temp.
RH + CO2
Krebsa - końcowy etap metabolizmu
OH
R
organizmów oddychających tlenem.
kwas
alkan
O
O
CO2
O
150 oC
HO
OH
C
H2
kwas malonowy
O
HO
_
O2C
OH
H3C CH3
β-ketoester
H3C
+
_
-CO2
O
O
OH + NAD
CO2
kwas octowy
25 oC
H3C
CH3
+ CO2
_
H CH3 + CO2
C
CH3
keton
_
O 2C
O
CO2
+ NADH + H +
_
(zapis uproszczony)
Hans Adolf Krebs 1900-1981
biochemik i lekarz niemiecki, noblista
Dehydrogenaza izocytrynianowa
Reakcje kwasów karboksylowych
O
Grupę hydroksylową w RCO2H moŜna wymienić na inne grupy,
takie jak: X, OR, NH2.
JeŜeli w grupie karboksylowej dwa atomy tlenu i atom wodoru
zostaną zastąpione atomem azotu to otrzymamy nitryl.
O
O
O
O
O
R
OR'
R
O
R
ester
R
R
bezwodnik
kwasowy
O H
R
X
NR2
R
halogenek
kwasowy
N
amid
nitryl
Reszta cząsteczki kwasu karboksylowego bez grupy hydroksylowej to grupa acylowa (nazwa
ogólna).
O
O
O
+
O
R
R
H
grupa
acylowa
kation
grupa
acylowy formylowa
(formyl)
O
O
H3C
grupa
formylowa
(acetyl)
H3C
C
H2
grupa
propionylowa
(propionyl)
grupa
benzoilowa
(benzoil)
Kwasy
α-hydroksykarboksylowe (AHA)
Środki leczniczo-kosmetyczne słuŜące do regeneracji skóry, usuwania
przebarwień, leczenia trądziku, wygładzania zmarszczek i blizn, nawilŜania.
OH
2
1
R α CO2H
OH
OH
HO2C
CO2H
kwas hydroksyetanowy
(kwas glikolowy)
kwas 2-hydroksybutanodiowy
(kwas jabłkowy)
OH
CO2H
CO2H
OH
HO2C
CO2H
OH
kwas 2-hydroksy-2-fenyloetanowy kwas 2,3-dihydroksybutanodiowy
(kwas migdałowy)
(kwas winowy)
OH
HO2C
CO2H
kwas 2-hydroksypropanowy
kwas α-hydroksypropionowy
(kwas mlekowy)
CO2H
HO CO2H
kwas 2-hydroksy-1,3,5-propanotrikarboksylowy
(kwas cytrynowy)
Kwasy karboksylowe: kosmetyki
O
CO2H
O
OH
OH
O
HO
S S
kwas 6,8-ditiooktanowy
kwas liponowy
"zmiatacz wolnych rodników"
*
O HO
O
kwas fenylooctowy
utrwalacz zapachu oraz składnik kwiatowych
kompozycji z nutą słodyczy i miodu.
HO
OH
OH
O
O
HO
kwas ferulowy
dezaktywuje wolne rodniki
redukuje stres oksydacyjny
O
O
OH
NH
O
kwas hialurowy
wią Ŝe wodę w naskórku
n
*
HO
O
HO
OH
witamina C
kwas L-askorbinowy
antyuleniacz, regulator pH
Estry
Pochodne kwasów, w których atom wodoru z grupy hydroksylowej jest zastąpiony grupą alkilową
(R) lub arylowa (Ar).
O
O
OH
R
kwas karboksylowy
OR'
R
OEt
H3C
ester kwasu karboksylowego
(ester)
O
OH
HO
kwas wę glowy
O
octan etylu
O
O
OR'
R'O
ester kwasu wę glowego
(wę glan)
OEt
EtO
wę glan dietylu
O
O
O
HO S OH
R'O S OR'
MeO S OMe
O
O
O
kwas siarkowy
O
R S OH
O
kwas sulfonowy
ester kwasu siarkowego
(siarczan)
siarczan dimetylu
O
R S OR'
O
ester kwasu sulfonowego
(sulfonian)
O
H3C
S OMe
O
4-metylobenzenosulfonian metylu
(p-toluenosulfonian metylu)
Estry kwasu azotawego i azotowego
Sole lub estry kwasu azotowego (V) to azotany, kwasu azotawego to azotyny.
CH2ONO2
O2NO
H
CH2ONO2
O
N
O
azotyn izoamylu
(poppers)
triazotan glicerolu
Alfred Bernhard Nobel 1833-1896
wynalazca dynamitu, przemysłowiec i naukowiec szwedzki,
fundator Nagrody Nobla.
Ja niŜej podpisany, Alfred Nobel, oświadczam niniejszym, po długiej rozwadze, iŜ moja ostatnia wola
odnośnie majątku, jest następująca. Wszystkie pozostałe po mnie, moŜliwe do zrealizowania aktywa,
mają być rozdysponowane w sposób następujący: kapitał zostanie przez egzekutorów ulokowany
bezpiecznie w papierach, tworzących fundusz, którego procenty kaŜdego roku mają być rozdzielone w
formie nagród tym, którzy w roku poprzedzającym przynieśli ludzkości największe korzyści.[...]
!
Estry kwasu fosforowego
Sole lub estry kwasu ortofosforowego (V) to ortofosforany lub fosforany (nazwa zwyczajowa).
HO
O
O
OH P OH
O P O
O
O
HO
O
OH
kwas ortofosforowy (V)
O
NaO
fosforan tri-n-butylu
O P O
ONa
VCP-IS-2Na
pochodna witaminy C
stabilny, lipofilowy zwią zek
O
O
CH2OH
HO
H
R'
O
CH2O
O
CH2O P OH
H
kwas fosfatydowy
O
O
CH2O
O
H
H2N
OH
kwas glicerofosforowy
R'
Biosci. Biotechnol. Biochem. 2008, 72, 1015-1022
O
CH2O P OH
OH
O
R
_
R
O
CH2O P O
H2
C
OH
fosfatydylocholina
(fosfolipid)
O
O
O P O P O P O
O
_
O
_
O
N
N
_
O
N
N
+
C
H2
N(CH3)3
OH OH
Adenozyno-5'-trifosforan (ATP)
(noś nik energii chemicznej uŜywanej w metabolizmie komórki)
!
Estry kwasów karboksylowych
Pochodne kwasów, w których atom wodoru z grupy hydroksylowej jest zastąpiony grupą
alkilową (R) lub arylowa (Ar).
Reakcja estryfikacji wymaga obecności silnego kwasu jako katalizatora.
Reakcja estryfikacji jest reakcją odwracalną.
O
R
O
H
+ H
O
O
H+
R'
R
O
R'
+ H2O
Emil Herman Fischer 1852-1919
niemiecki chemik
pierwszy noblista z chemii
Estry są hydrofobowe i nie rozpuszczają się w wodzie.
Mają niŜsze temperaturywrzenia niŜ odpowiednie alkohole i kwasy karoksylowe poniewaŜ nie
tworzą wiązań wodorowych.
O
O
eter dietylowy
t.wrz. 35 oC
O
H
butanal
t.wrz. 75 oC
O
ester etylowy
t.wrz. 77 oC
O
O
OH
keton etylowometylowy
t.wrz. 79 oC
butanol
t.wrz. 117 oC
OH
kwas masłowy
t.wrz. 162 oC
!
Estry kwasów karboksylowych: nazewnictwo
Nazwy estrów tworzy się analogicznie do nazw soli kwasów karboksylowych. Miejsce nazwy
kationu zajmuje nazwa grupy alkilowej lub arylowej.
O
O
O
O
O
O
octan etylu
butanian propylu
(maś lan propylu)
benzoesan etylu
Nazewnictwo opisowe polega na uŜyciu następującej sekwencji słów:
ester + nazwa grupy + kwasu + nazwa kwasu
O
O
O
O
O
O
ester etylowy kwasu octowego
ester etylowy kwasu benzoesowego
ester propylowy kwasu butanowego
(ester propylowy kwasu masłowego)
!
Estry kwasów karboksylowych: reakcje
hydroliza estrów w środowisku kwaśnym jest reakcją odwracalną.
O
+ H2O
H
O
+
+ EtOH
O
OH
maś lan etylu
kwas masłowy
hydroliza estrów w środowisku zasadowym jest reakcją nieodwracalną i wymaga
stechiometrycznej ilości zasady.
O
O
O
maś lan etylu
+ NaOH
+ EtOH
ONa
maś lan sodu
Estry kwasów karboksylowych: reakcje
Transestryfikacja estrów – przekształcanie jednego estru w inny w obecności duŜego nadmiaru
alkoholu. Jest to reakcja odwracalna, katalizowana przez kwasy i zasady.
!
O
O
R
O
R' + H
R''
kwas
lub
zasada
O
R
O
R'' + R'OH
Biodiesel – przetworzony chemicznie olej roślinny do silników wysokopręŜnych (biopaliwo).
O
O
R
CH2O
O
R
+ 3MeOH
R
H
CH2O
O
KOH
O
CH2OH
HO
H
CH2OH
+ 3R
OMe
!
Estry kwasów karboksylowych: laktony
Laktony – wewnątrzcząsteczkowe estry kwasów hydroksykarboksylowych.
γ
HO
δ
O
NaOH
α
O
O + H2O
CO2H
β
γ
O
O
β
β
δ
O
O
O
O
O
α
γ-butyrolakton
O
O
O
α
OHC N
H
α-propiolakton
HO
β O
O
O
δ
O
OH
C11H23 C6H13
Orlistat - substancja aktywna
preparatu Alli R na nadwagę
OH
O
OH
D-δ-glukonolakton
- uję drnia , wygła dza
i na wilŜa s kórę
s-Butyrolakton został umieszczony na Liście I
substancji kontrolowanych (Federal Register, Vol. 65,
Nr 49, Monday March 13, 200 p. 13235).
Następny wykład:
Kwasy tłuszczowe,
Lipidy
CO2H
ω-6
C17H31CO2H
kwas linolowy
kwas (Z), (Z)-oktadeka-9,12-dienowy