Materiały pomocnicze do nauki chemii
w Prywatnym Liceum Ogólnokształcącym dla Dorosłych
Centrum Kształcenia Dorosłych Sp. z o.o.
Substancje chemiczne i ich przemiany
Pierwiastki i związki chemiczne
Obliczenia chemiczne
Centrum Kształcenia Dorosłych Sp. z o.o.
I.
Substancje chemiczne i ich przemiany.
1. Zjawiska fizyczne - procesy, w których substancje zmieniają
właściwości fizyczne, a rodzaj substancji nie ulega zmianie.
Na przykład: wrzenie wody, topnienie lodu.
2. Przemiany chemiczne, reakcje chemiczne - procesy, w których z jednych
substancji powstają nowe o odmiennych właściwościach.
Na przykład: spalanie żelaza w tlenie, reakcja cynku z kwasem solnym.
Substancje, które biorą udział w reakcjach chemicznych to reagenty.
Do reagentów należą:
substancje wyjściowe - substraty
substancje otrzymane w wyniku reakcji - produkty
substraty
reakcja chemiczna
produkty
Na przykład w reakcji spalania magnezu w tlenie substratami są
magnez i tlen, a produktem - tlenek magnezu.
Reakcję można przedstawić następująco:
magnez + tlen tlenek magnezu
substraty
produkt
Produkty reakcji mogą różnić się od substratów np. stanem skupienia,
barwą, zapachem, rozpuszczalnością, temperaturą wrzenia.
Zarówno substraty
jak
i produkty mają swoje charakterystyczne
właściwości fizyczne i chemiczne, które polegają na zdolności reagowania
z innymi substancjami.
Pytanie i polecenie:
1/ Które z podanych procesów należą do przemian chemicznych, a
które są zjawiskami fizycznymi:
a/ kiszenie kapusty
b/ tworzenie się mgły
c/ spalanie drewna
Odpowiedź uzasadnij.
3. Substancje proste i złożone.
Substancja prosta - pierwiastek w stanie wolnym.
Substancja złożona - związek chemiczny w skład, którego wchodzą
dwa lub więcej pierwiastki.
Substancje chemiczne można zatem podzielić na: substancje proste i
złożone.
2
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Pytanie i polecenie:
1/ Podaj 3 przykłady reakcji chemicznych i opisz je używając
terminów: pierwiastek, związek chemiczny.
4. Reakcje egzotermiczne i endotermiczne.
Energia aktywacji - minimalna ilość energii, jaką muszą posiadać substraty,
aby mogła zajść reakcja chemiczna.
Reakcje egzotermiczne - reakcje przebiegające z wydzielaniem energii z układu
do otoczenia.
Reakcje endotermiczne - reakcje przebiegające z przekazywaniem energii
z otoczenia do układu.
5. Atomy i cząsteczki.
Substancje zbudowane są z molekuł.
Pierwiastek w stanie wolnym to zbiór molekuł, które składają się z atomów
tego samego rodzaju.
Związek chemiczny to zbiór molekuł / cząsteczek /, które są zbudowane
z atomów różnych pierwiastków.
Przykładem pierwiastka może być: węgiel, żelazo, miedź, sód.
Przykładem związku chemicznego może być: woda, dwutlenek węgla, tlenek
węgla, kwas solny.
Atomy różnych pierwiastków różnią się między sobą masą, objętością,
promieniem atomu i zdolnością łączenia się z innymi pierwiastkami.
Pierwiastek miedź składa się tylko z atomów miedzi, a pierwiastek węgiel
tylko z atomów węgla.
A zatem mogą istnieć:
molekuły jednoatomowe - np. molekuła / atom / magnezu, atom sodu,
atom potasu,
molekuły - cząsteczki pierwiastka - zbudowane z atomów tego samego
rodzaju, np. dwuatomowe cząsteczki azotu, tlenu, wodoru,
molekuły - cząsteczki związku chemicznego - zbudowane z atomów
różnych pierwiastków, np. cząsteczka wody.
6. Czynniki wpływające na szybkość reakcji.
Reakcja chemiczna może zajść wtedy kiedy dochodzi do zderzeń molekuł
substratów.
3
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Nie wszystkie zderzenia prowadzą do otrzymania produktów, nie wszystkie są
efektywne.
Aby zderzenie było efektywne molekuły muszą mieć dużą energię kinetyczną,
czyli muszą mieć energię równą energii aktywacji.
Czynnikami wpływającymi na szybkość reakcji są:
temperatura
stężenie substratów
stopień rozdrobnienia substratów
katalizator
- substancja obniżająca energię aktywacji, która po
zakończeniu reakcji zachowuje swoje właściwości.
Reakcje przebiegające z udziałem katalizatora to reakcje katalizy.
7. Prawo zachowania masy - prawo Łomonosowa.
Suma mas substratów biorących udział w reakcji chemicznej jest zawsze równa
sumie mas produktów powstałych w wyniku tej reakcji.
Przykład:
Podczas rozkładu 30 g tlenku rtęci (II) powstało 27,8 g rtęci oraz
tlen. Obliczyć, ile powstało tlenu.
Opisaną przemianę można zapisać:
tlenek rtęci (II) rtęć + tlen
30 g
27,8 g
x
Korzystając
równanie:
z
prawa zachowania
masy należy
ułożyć
30 = 27,8 + x
x = 30 - 27,8
x = 2,2 g
Pytanie i polecenie:
Podczas ogrzewania 2,4 g magnezu powstały 3 g tlenku magnezu.
Obliczyć, ile gramów tlenu przyłączył magnez.
4
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
II.
Pierwiastki i związki chemiczne
1. Podział pierwiastków:
Metale
Niemetale
Półmetale
Metale charakteryzują się: połyskiem metalicznym, kowalnością,
ciągliwością, dobrym przewodnictwem ciepła i elektryczności.
Niemetale - nie mają połysku metalicznego,
przewodnictwo ciepła i elektryczności.
Półmetale - wykazują
niemetali.
częściowo
cechy metali,
wykazują
złe
a częściowo
Mają niezbyt duże przewodnictwo elektryczne, które gwałtownie,
wzrasta w miarę ogrzewania, a także pod wpływem niewielkich
domieszek specjalnych substancji.
Każdy z pierwiastków zarówno metal, niemetal jak i półmetal ma swoje
określone
właściwości, które
pozwalają
go odróżnić od innych
pierwiastków.
2. Symbole pierwiastków i wzory chemiczne związków chemicznych.
W 1814 r. J. Berzelius - szwedzki chemik wprowadził symbolikę
pierwiastków.
Symbolem chemicznym pierwiastka jest pierwsza litera jego międzynarodowej
nazwy w połączeniu z literą następną / dla pierwiastków naturalnych nazwy
łacińskiej /.
Przykłady nazw i symboli pierwiastków naturalnych.
Nazwa
pierwiastka
Łacińska nazwa
pierwiastka
Symbol
WAPŃ
TLEN
WODÓR
CALCIUM
OXYGENIUM
HYDROGENIUM
C
O
H
Symbole chemiczne określają nie tylko konkretny pierwiastek ale również
jego ilość.
5
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Na przykład:
C
- oznacza 1 atom węgla
5 C - oznacza 5 atomów węgla
7 Mg - oznacza 7 atomów magnezu
Za pomocą symboli można podać także skład cząsteczek.
Na przykład:
O2
- oznacza 1 dwuatomową cząsteczkę tlenu
2 H2 - oznacza 2 dwuatomowe cząsteczki wodoru
MgO - oznacza 1 cząsteczkę tlenku magnezu w skład, której
wchodzi 1 atom magnezu i 1 atom tlenu.
Wzór sumaryczny wykazuje łączną liczbę atomów poszczególnych
pierwiastków wchodzących w skład cząsteczki danego związku.
Atomy pierwiastków mogą się ze sobą łączyć za pomocą jednego, dwu lub
kilku wiązań chemicznych.
Liczba wiązań, za pomocą których atom danego pierwiastka łączy się z
atomami innych pierwiastków to wartościowość pierwiastka.
Wodór jest w związkach jednowartościowy - atom wodoru tworzy jedno
pojedyncze wiązanie.
Tlen jest w związkach dwuwartościowy - atom tlenu łączy się z atomami
innych pierwiastków za pomocą dwóch wiązań.
Wartościowość innych pierwiastków można określić na podstawie wzorów ich
związków z wodorem lub z tlenem, np.:
glin w związku o wzorze Al2O3 jest trójwartościowy
fosfor w związku o wzorze P2O5 jest pięciowartościowy
siarka w związku o wzorze SO3 jest sześciowartościowa
Te same pierwiastki mogą tworzyć między sobą więcej niż jeden związek, a
ich wartościowość może być różna, np.:
żelazo w związku o wzorze FeO jest dwuwartościowe
żelazo w związku o wzorze Fe2O3 jest trójwartościowe
Wzór strukturalny przedstawia sposób w jaki atomy wchodzące w skład
cząsteczki łączą się ze sobą.
6
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Na przykład:
O
/ \
H H
O
\\
O
/ \
Al
O
//
Al
Przykłady wzorów sumarycznych i strukturalnych wybranych związków
chemicznych.
Wzór sumaryczny
Wzór strukturalny
H–N–H
|
H
NH3
CO2
O= C =O
CO
C=O
O
||
S
// \\
O O
SO3
Fe2O3
O
\\
O
/ \
Fe
O
//
Fe
Pytania i polecenia:
1/ Napisz co oznaczają symbole i wzory:
a/ 5 Mg, 7 Cu, 2 Fe, 4 Cu
b/ O2, 3N2, 5 Cl2, 2H2O, 5HCl
2/ Oznacz za pomocą symboli:
7 atomów żelaza, 5 atomów tlenu, 3 atomy potasu
3/ Określ skład cząsteczek związków o wzorach:
P2O5, FeCl2, K2SO4,
4/ Określ wartościowość pierwiastków na podstawie wzorów ich
Związków:
K2O, CaO, Al2O3
7
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
3. Prawo stałości składu związku chemicznego.
W 1799 r. J. Proust - uczony francuski sformułował prawo stałości składu
związku chemicznego.
Wynika z niego, że pierwiastki łączą się ze sobą w ściśle określonych
stosunkach wagowych.
Na przykład:
Z rozkładu pewnej próbki wody otrzymano 1 g wodoru i 8 g tlenu.
Oblicz, ile wodoru i ile tlenu otrzymamy z rozkładu 36 g wody.
Z prawa stałości składu wynika, że w wodzie stosunek wagowy
wodoru do tlenu jest stały. Zatem:
H ‗ 1
O
8
Próbka o masie 36 g zawiera x gramów wodoru i y tlenu.
x + y = 36
x
1
y
8
Rozwiązując układ równań z dwiema niewiadomymi otrzymamy
x = 4,
y = 32
A zatem z rozkładu 36 g wody otrzymamy 4 g wodoru i 32 tlenu.
Pytania i polecenia:
1/ Miedź łączy się tlenem w stosunku wagowym 4 : 1. Oblicz ile
gramów miedzi połączy się z 8 g tlenu.
2/ Stosunek wagowy żelaza do tlenu w tlenku żelaza (II) wynosi
7 : 2, a stosunek żelaza do tlenu w tlenku żelaza (III) wynosi
7 : 3. Czy fakty te stanowią wyjątek od prawa stałości składu?
Odpowiedź uzasadnij.
8
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
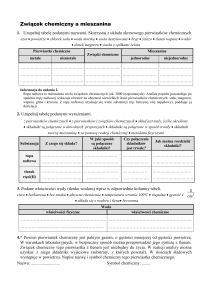
4. Mieszanina a związek chemiczny.
Mieszanina
np. sól kuchenna z piaskiem
Związek chemiczny
np. siarczek żelaza (II)
- stosunek mas składników
mieszaniny może być dowolny
- stosunek mas pierwiastków,
składniki
mieszaniny
zachowują
swoje właściwości chemiczne
- związek chemiczny ma swoje
charakterystyczne właściwości
odmienne od właściwości
substancji,
z których pochodzi
- składniki mieszaniny można
wyodrębnić metodami
fizycznymi.
- składniki związku chemicznego
można wyodrębnić tylko
poprzez
reakcję chemiczną.
składników związku chemicznego,
jest ściśle określony
5. Typy reakcji chemicznych.
Równanie chemiczne - zapis reakcji chemicznej za pomocą
symboli i wzorów chemicznych.
Reakcja syntezy /łączenia/-z dwu lub większej liczby substratów powstaje
jeden produkt.
Ogólnie:
A + B AB
np. 2 Na + Cl2 2NaCl
2 Mg + O2 2MgO
4 P + 5 O2 2P2O5
Reakcja analizy / rozkładu / - z jednej substancji powstaje dwie lub więcej
nowych substancji.
Ogólnie:
AB A + B
np. 2 HgO 2 Hg + O2
2 H2O 2H2 + O2
Reakcja wymiany pojedynczej - wymiana składników między
substratami, jeden ze składników jest substancją prostą.
Ogólnie:
A + BC AC + B
np. 2 K + 2 HCl 2 KCl + H2↑
Mg + H2CO3 MgCO3 + H2↑
2 Na + H2SO4 Na2SO4 + H2↑
9
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Reakcja wymiany podwójnej - reakcja pomiędzy substancjami złożonymi,
która polega na wzajemnej wymianie składników.
Ogólnie:
AB + CD AD + CB
Np. 3 MgO + 2 H3PO4 Mg3 (PO4)2 + 3 H2O
Ca (OH)2 + H2CO3 CaCO3 + 2 H2O
KOH + HNO3 KNO3 + H2O
Pytania i polecenia:
1/ Ułóż równania reakcji:
K2O + HNO3
MgO + H3PO4
Fe (OH)2 + H2SO4
MgO + SO2
CaO + CO2
6. Klasyfikacja substancji nieorganicznych.
Substancje
nieorganiczne można podzielić na następujące grupy:
tlenki
wodorki
wodorotlenki
kwasy
sole
Tlenki to połączenia różnych pierwiastków z tlenem.
Można je podzielić na:
- tlenki metali i niemetali
- tlenki zasadowe, tlenki kwasowe i tlenki obojętne
Tlenki metali to produkty reakcji metali z tlenem.
np. 2 Mg + O2 2 MgO,
4 K + O2 2 K2O
Ogólny wzór tlenków ma postać:
a/ dla metali jednowartościowych
M2O
b/ dla metali dwuwartościowych
MO
c/ dla metali trójwartościowych
M2O3
d/ dla metali czterowartościowych
MO2
gdzie M oznacza symbol metalu
10
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Wzór tlenku
Wybrane tlenki metali
Nazwa tlenku
Wartościowość
K2O
MgO
CaO
Al2O3
ZnO
tlenek potasu
tlenek magnezu
tlenek wapnia
tlenek glinu
tlenek cynku
Metale tworzące te tlenki
mają we wszystkich
związkach tę samą
wartościowość
FeO
Fe2O3
Cu2O
CuO
tlenek żelaza (II)
tlenek żelaza (III)
tlenek miedzi (I)
tlenek miedzi (II)
Metale tworzące te tlenki
przyjmują w różnych
związkach różną
wartościowość
PbO
Cl2O3
SnO2
tlenek ołowiu (II)
tlenek chromu (III)
tlenek cyny (IV)
Najbardziej trwałe tlenki
metali, które przyjmują
w związkach różną
wartościowość
Tlenki niemetali to produkty reakcji niemetali z tlenem.
Np.
S + O2 SO2,
C + O2 CO2
Wybrane tlenki niemetali
Wzór tlenku
Nazwa tlenku
Wartościowość tlenku
CO
CO2
NO
NO2
SO2
SO3
tlenek węgla
dwutlenek węgla
- tlenek węgla (IV)
tlenek azotu
dwutlenek azotu
- tlenek azotu (IV)
dwutlenek siarki
tlenek siarki (IV)
trójtlenek siarki
tlenek siarki (VI)
II)
IV
II
IV
IV
VI
Tlenki zasadowe - tlenki metali np. K2O, Na2O, CaO, MgO,
Które w reakcji z wodą dają nowe substancje chemiczne zwane
zasadami.
Reakcja tlenku wapnia z wodą może być zapisana równaniem:
CaO + H2O Ca (OH)2
A reakcja tlenku potasu z wodą przebiega następująco:
K2O + H2O 2 KOH
11
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Tlenki kwasowe - tlenki niemetali, które w reakcji z wodą
tworzą kwasy lub które uzyskuje się przez odwodnienie kwasów.
Do tlenków kwasowych należą m.in. CO2, P2O5, SO2 SO3.
Reakcja dwutlenku węgla z wodą przebiega wg równania:
CO2 + H2O H2CO3
a w przypadku innych tlenków:
P2O5 + 3 H2O 2 H3PO4
SO3 + H2O H2SO4
Tlenki obojętne - NO, CO
Wodorki to dwuskładnikowe związki pierwiastków z wodorem.
Można je podzielić na:
- wodorki metali np. LiH, BeH2, B2H6, NaH, CaH2
- wodorki niemetali np. NH3, H2O, HF, PH3, H2S, HCl
Wodorotlenki
Wodorotlenki to związki, we wzorach których wyróżnia się
symbol metalu i grupę wodorotlenową OH.
Wzór ogólny - Me (OH)n
gdzie Me - metal
OH - grupa wodorotlenowa
n - liczba grup wodorotlenowych, jednowartościowych,
która jest równa wartościowości metalu
Wodorotlenki można podzielić na:
- zasadowe
- amfoteryczne
Wybrane wodorotlenki
Wzór wodorotlenku
Nazwa wodorotlenku
NaOH
KOH
Ca(OH)2
Ba(OH)2
Al(OH)3
CuOH
Cu(OH)2
Fe(OH)2
Fe(OH)3
wodorotlenek sodu - zasada sodowa
wodorotlenek potasu - zasada potasowa
wodorotlenek wapnia - zasada wapniowa
wodorotlenek baru - zasada barowa
wodorotlenek glinu
wodorotlenek miedzi (I)
wodorotlenek miedzi (II)
wodorotlenek żelaza (II)
wodorotlenek żelaza (III)
12
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Wodne
Zasady
-
roztwory wodorotlenków to zasady.
powodują zmianę barwy wskaźników:
lakmus na niebiesko
fenoloftaleina na malinowo
- błękit bromotymolowy na żółto
Należy pamiętać, że:
Każda zasada jest wodorotlenkiem, a nie każdy wodorotlenek
jest zasadą.
np. NaOH
- wodorotlenek sodu, zasada sodowa
Fe(OH)3 - wodorotlenek żelaza (III)
Zasady można otrzymać w reakcjach:
2 K + 2 H2O 2 KOH + H2
2 Na + 2 H2O 2 NaOH + H2
K2O + H2O 2 KOH
Na2O + H2O 2 NaOH
Wodorotlenki np. Fe(OH)3, Cu(OH)2 można otrzymać nie w
reakcjach metali z wodą ale w reakcjach rozpuszczalnych soli
tych metali z mocnymi zasadami.
Otrzymywanie Cu(OH)2 przebiega wg reakcji:
CuSO4 + 2 NaOH Cu(OH)2↓ + Na2SO4
Cu(OH)2↓ - związek nierozpuszczalny w wodzie.
Wodorotlenki amfoteryczne.
Są to związki, które reagują z kwasami i zasadami w odróżnieniu
od wodorotlenków zasadowych reagujących tylko z kwasami.
np. 2 Al(OH)3 + 3 H2SO4 Al2(SO4)3 + 6 H2O
Al(OH)3 + NaOH NaAlO2 + 2 H2O
Pytania i polecenia:
1/ Określ wartościowość metali w związkach:
Al(OH)3, Mg(OH)2, Ba(OH)2, NaOH
2/ Napisz równanie reakcji tlenków zasadowych z wodą,
w wyniku których powstają wodorotlenki sodu, potasu, baru
Kwasy
Kwasy są zbudowane z wodoru i z reszty kwasowej.
Wzór ogólny kwasów:
HnR
gdzie: H - wodór
R - reszta kwasowa
n - liczba atomów wodoru równa wartościowości
reszty kwasowej
Reszty kwasowe poszczególnych kwasów mają stałą wartościowość
równą liczbie atomów wodoru w cząsteczce.
13
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Kwasy można podzielić na:
- kwasy tlenowe
- kwasy beztlenowe
Do kwasów tlenowych należą m.in.:
H2SO3 - kwas siarkowy (IV)
H2SO4 - kwas siarkowy (VI)
H2CO3 - kwas węglowy
H3PO4 - kwas fosforowy (V)
HNO2 - kwas azotowy (III)
HNO3 kwas azotowy (V)
Do kwasów beztlenowych należą m.in.:
HCl - kwas chlorowodorowy
HBr - kwas bromowodorowy
H2S - kwas siarkowodorowy
Kwasy można otrzymać w reakcjach:
SO3 + H2O H2SO4
CO2 + H2O H2CO3
P2O5 + 3 H2O 2 H3PO4
H2 + Cl2 2 HCl
H2 + S H2S
Wodne roztwory kwasów barwią wskaźniki:
lakmus - na czerwono
oranż metylowy - na czerwono
Pytania i polecenia:
1/ Napisz równanie reakcji tlenków niemetali z wodą, w wyniku
których powstają kwasy: azotowy (V), fosforowy (V)
2/ Podaj wartościowości reszt kwasowych kwasów:
H3BO3, HCl, HNO3.
Sole.
Sole są związkami chemicznymi o wzorze ogólnym MnRm
gdzie: M - metal
R - reszta kwasowa
n - liczba atomów metalu równa wartościowości reszty
kwasowej
m - liczba reszt kwasowych równa wartościowości metalu
Sole można otrzymać w wyniku reakcji:
14
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
+
+
KWAS
METAL
NIEMETAL
METAL
TLENEK
METALU
SÓL
+
WODOROTLENEK
METALU
WODOROTLENEK
METALU
Nazwy soli pochodzą od
wodorotlenku metalu.
Nazwy soli podstawowych kwasów
Wzór kwasu Nazwa kwasu
HCl
H2S
HNO2
HNO3
H2SO3
H2SO4
H2CO3
chlorowodorowy
siarkowodorowy
azotowy (III)
azotowy (V)
siarkowy (IV)
siarkowy (VI)
węglowy
TLENEK
NIEMETALU
kwasów i metalu a dokładniej
Przykłady soli Mg
Wzór
Nazwa
Reszta
kwasowa
- Cl
>S
- NO2
- NO3
> SO3
> SO4
> CO3
MgCl2
MgS
Mg(NO2)2
Mg(NO3)2
MgSO3
MgSO4
MgCO3
chlorek magnezu
siarczek magnezu
azotan (III) magnezu
azotan (V) magnezu
siarczan (IV) magnezu
siarczan (VI) magnezu
węglan magnezu
Przykłady reakcji otrzymywania soli:
Ca + H2SO4 CaSO4 + H2
CaO + H2SO4 CaSO4 + H2O
Ca(OH)2 + CaSO4 + 2 H2O
CaO + SO3 CaSO4
Ca(OH)2 + SO3 CaSO4 + H2O
2 Na + 2 HCl 2 NaCl + H2
Na2O + 2 HCl 2 NaCl + H2O
2 Na + Cl2 2 NaCl
Na2CO3 + CaCl2 2 NaCl + CaCO3
15
Zakaz kopiowania. Wszelkie prawa zastrzeżone.
Centrum Kształcenia Dorosłych Sp. z o.o.
Pytania i polecenia:
1/ Ułożyć równania reakcji:
K2O + HNO3
MgO + H3PO4
CaO + HNO2
KOH + HCl
Mg(OH)2 + P2O5
MgO + SO2
2/ Ułożyć równania reakcji otrzymywania NaNO3 pięcioma
metodami.
3/ Podać wzory następujących soli:
siarczan (VI) miedzi (II),
azotan (III) wapnia,
fosforan (V) potasu,
chlorek żelaza (II),
bromek sodu.
16
Zakaz kopiowania. Wszelkie prawa zastrzeżone.