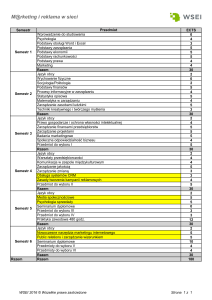
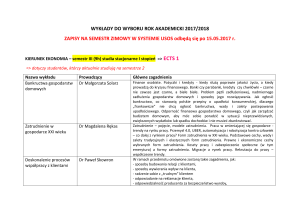
Instytut Chemii
Wydział Matematyki, Fizyki i Chemii
Uniwersytet Śląski
ul. Szkolna 9
40-006 Katowice
tel. (0048) 32-359-1545
e-mail: [email protected]
www: http://www.chemia.us.edu.pl
Kierunek: Technologia chemiczna
studia inŜynierskie I stopnia - stacjonarne
Specjalności:
Zielona chemia i czyste technologie
Technologia nieorganiczna i organiczna
Katowice, 2010 r.
Spis treści:
1. Siatka studiów: specjalność Zielona chemia i czyste technologie ......................................... 4
2. Siatka studiów: specjalność Technologia nieorganiczna i organiczna................................... 7
3. Przedmioty z grupy treści podstawowych............................................................................ 10
Podstawy chemii .................................................................................................................. 11
Chemia analityczna .............................................................................................................. 12
Analiza instrumentalna......................................................................................................... 13
Chemia nieorganiczna .......................................................................................................... 14
Chemia organiczna ............................................................................................................... 15
Chemia fizyczna ................................................................................................................... 16
Chemia materiałów .............................................................................................................. 17
Podstawy spektroskopii molekularnej.................................................................................. 18
Matematyka (część I) ........................................................................................................... 19
Matematyka (część II) .......................................................................................................... 20
Fizyka (część I) .................................................................................................................... 21
Fizyka (część II) ................................................................................................................... 22
Podstawy elektrotechniki i elektroniki ................................................................................. 23
Grafika inŜynierska .............................................................................................................. 24
4. Przedmioty z grupy treści kierunkowych............................................................................. 25
Podstawy technologii chemicznej ........................................................................................ 26
Termodynamika techniczna i chemiczna ............................................................................. 27
Podstawy inŜynierii chemicznej i procesowej ..................................................................... 28
Maszynoznawstwo i aparatura przemysłu chemicznego...................................................... 29
Technologia chemiczna - surowce i procesy........................................................................ 30
Automatyka i pomiar wielkości fizykochemicznych ........................................................... 31
Zarządzanie jakością i produktami chemicznymi ................................................................ 32
Kataliza i procesy katalityczne............................................................................................. 33
Projektowanie procesów technologicznych ......................................................................... 34
Bezpieczeństwo techniczne.................................................................................................. 35
Zielona chemia ..................................................................................................................... 36
Współczesna synteza organiczna i nieorganiczna................................................................ 37
Technologie utylizacji i recyklingu odpadów ...................................................................... 38
Materiały dla optoelektroniki ............................................................................................... 39
5. Przedmioty z grupy innych wymagań .................................................................................. 40
Przedmiot interdyscyplinarny .............................................................................................. 41
Technologia informacyjna.................................................................................................... 42
Informacja naukowa ............................................................................................................. 43
Metody obliczeniowe w chemii ........................................................................................... 44
Planowanie i optymalizacja eksperymentu .......................................................................... 45
Chemometria w kontroli procesów technologicznych ......................................................... 46
Projekt technologiczny......................................................................................................... 47
Projekt inŜynierski................................................................................................................ 48
Seminarium inŜynierskie...................................................................................................... 49
6. Pula proponowanych przedmiotów obieralnych wspólnych dla dwóch specjalności.......... 50
Ratownictwo techniczne i chemiczne .................................................................................. 51
Zarządzanie środowiskiem ................................................................................................... 52
Ochrona środowiska w technologii chemicznej................................................................... 53
7. Przedmioty obieralne dla poszczególnych specjalności....................................................... 54
Biomateriały i biotechnologie .............................................................................................. 55
2
Laboratorium na chipie ........................................................................................................ 56
Technologie zgazowania węgla ........................................................................................... 57
Transport materiałów niebezpiecznych................................................................................ 58
Analiza chemiczna procesów ............................................................................................... 59
Otrzymywanie odczynników o wysokiej czystości ............................................................. 60
8. Wykłady specjalizacyjne dla specjalności: Zielona chemia i czyste technologie................ 61
Chemia środowiska .............................................................................................................. 62
Przemysłowe źródła zanieczyszczenia środowiska.............................................................. 63
Budowa i eksploatacja składowisk odpadów ....................................................................... 64
Czyste technologie węglowe ................................................................................................ 65
Technologia i przetwórstwo polimerów............................................................................... 66
9. Wykłady specjalizacyjne dla specjalności: Technologia nieorganiczna i organiczna ......... 67
Nanomateriały i nanotechnologie......................................................................................... 68
Materiały dla medycyny....................................................................................................... 69
Materiały i technologie ceramiczne ..................................................................................... 70
Technologie wytwarzania kryształów i materiałów krystalicznych..................................... 71
Katalityczne procesy heterogeniczne ................................................................................... 72
3
1. Siatka studiów: specjalność Zielona chemia i czyste technologie
Wydział Matematyki, Fizyki i Chemii
Kierunek "Technologia chemiczna"
Specjalność: "Zielona chemia i czyste technologie"
studia I stopnia
studia stacjonarne inŜynierskie
od roku akademickiego 2011/2012
15 tyg.
15 tyg.
15 tyg.
15 tyg.
45
4 Chemia nieorganiczna
E
105
30
60
5 Chemia organiczna
E
150
45
6 Chemia fizyczna
E
135
7 Chemia materiałów
E
8 Podstawy spektroskopii molekularnej
wykł.
ćwicz.
ECTS
7
45
45
7
15
8
30
75
8
90
15
13
45
105
13
30
60
45
10
60
15
45
Z
15
15
9 Matematyka
E
210
105
10 Fizyka
E
120
60
30
11 Podstawy elektrotechniki i elektroniki
Z
45
15
30
Z
15
12 Grafika inŜynierska
RAZEM A:
1200
0
510
15
45
4
1
15
24
60
60
15
45
45
9
30
13
30
45
7
30
15
6
15
30
3
3
15
405
4
105
255 30
1
98
15
30
105
10
ECTS
45
7
ćwicz.
90
105
wykł.
E
15
ECTS
3 Analiza instrumentalna
7
15 tyg.
ćwicz.
15
ECTS
90
ćwicz.
15
IV rok
semestr 7
15 tyg.
wykł.
120
7
ECTS
E
105
ćwicz.
2 Chemia analityczna
7
30
III rok
semestr 5
semestr 6
15 tyg.
wykł.
30
ECTS
15
ćwicz.
semin.
60
wykł.
konwer.
30
Razem
ECTS
laborat.
135
Nazwa przedmiotu
ćwicz.
E
wykłady
Razem
1 Podstawy chemii
Lp
ECTS
semestr 4
ćwicz.
semestr 3
wykł.
semestr 2
w tym
E/Z
II rok
semestr 1
wykł.
I rok
A GRUPA TREŚCI PODSTAWOWYCH
0
0
0
0
0
0
1
1
120 225 30 105 195 25 120 225 28
30 105 10
30
45
5
15 tyg.
15 tyg.
15 tyg.
E
75
30
16 Maszynoznawstwo i aparatura przemysłu chem.
Z
45
30
17 Technologia chemiczna - surowce i procesy
E
90
45
45
8
45
45
8
18 Automatyka i pomiar wielkości fizykochem.
Z
45
15
30
4
15
30
4
19 Zarządzanie jakością i produktami chemicznymi
Z
30
20 Kataliza i procesy katalityczne
E
75
30
45
6
21 Projektowanie procesów technologicznych
Z
45
15
30
3
15
22 Bezpieczeństwo techniczne
Z
15
1
15
23 Zielona chemia
E
90
30
24 Technologie utylizacji i recyklingu odpadów
E
30
30
630
285
RAZEM B:
15
15
60
ćwicz.
ECTS
30
ECTS
6
wykł.
45
ECTS
30
wykł.
6
ECTS
6
wykł.
30
ECTS
30
wykł.
6
3
30
15 tyg.
wykł.
45
ćwicz.
15 Podstawy inŜynierii chemicznej i procesowej
30
30
ćwicz.
30
2
ćwicz.
60
ćwicz.
E
Razem
ECTS
14 Termodynamika techniczna i chemiczna
semin.
30
konwer.
30
laborat.
E
ćwicz.
13 Podstawy technologii chemicznej
Nazwa przedmiotu
wykłady
Razem
15 tyg.
E/Z
Lp
15 tyg.
30
2
60
8
2
15
3
2
30
45
6
30
3
1
8
30
2
0
255
45
45
51
IV rok
semestr 7
30
0
0
0
60
ECTS
15 tyg.
w tym
III rok
semestr 5
semestr 6
ćwicz.
semestr 4
wykł.
semestr 3
ECTS
semestr 2
ćwicz.
II rok
semestr 1
wykł.
I rok
B GRUPA TREŚCI KIERUNKOWYCH
15
5
0
0
0
90 120 18
90 105 16
30
90
10
30
2
0
2
15 tyg.
15 tyg.
15 tyg.
29 Informacja naukowa
Z
15
30 Metody obliczeniowe w chemii
E
45
15
30
5
31 Planowanie i optymalizacja eksperymentu
Z
30
15
15
2
32 Chemometria w kontroli procesów technolog.
Z
60
30
30
4
30
33 Przedmiot obieralny
Z
90
90
7
30
34 Projekt technologiczny
Z
45
15
35 Wykład specjalizacyjny
E
150
150
36 Projekt inŜynierski
Z
120
37 Seminarium inŜynierskie
Z
30
wykł.
45
2
15 tyg.
ECTS
Z
60
wykł.
28 Technologia informacyjna
ECTS
60
2
ćwicz.
Z
60
wykł.
27 Przedmiot interdyscyplinarny
ECTS
2
0
ćwicz.
60
30
wykł.
60
ECTS
Z
0
ćwicz.
b Specjalistyczny j. angielski
30
wykł.
4
ECTS
120
ćwicz.
120
wykł.
Z
Razem
ECTS
a Język angielski
semin.
0
konwer.
60
laborat.
60
25 Wychowanie fizyczne
ćwicz.
Z
Nazwa przedmiotu
wykłady
Razem
15 tyg.
E/Z
Lp
IV rok
semestr 7
15 tyg.
60
2
ECTS
15 tyg.
w tym
III rok
semestr 5
semestr 6
ćwicz.
semestr 4
wykł.
semestr 3
ECTS
semestr 2
ćwicz.
II rok
semestr 1
ćwicz.
I rok
C INNE WYMAGANIA
15
15
2
26 Język obcy w tym :
RAZEM C:
RAZEM SEMESTRY (A+B+C)
930
60
4
45
2
15
45
30
240
45
30
2
2
15
30
2
1
30
5
30
15
30
15
4
5
10
240
2
1
120
375
30
2
2
30
30
30
3
90
6
5
2
10
120
10
30
5
30
5
30
61
2 760 1 065 240 1 005 345 105
210
0
75
420
2
0
32
RAZEM ROCZNIE
OGÓŁEM
PRAKTYKI
825
30
405
0
30
0
60
405
2
0
30
60
405
2
120 30
30
420
810
31
795
2 760
Praktyka - 6 tygodni po II roku
Studia kończą się nadaniem tytułu zawodowego inŜyniera na kierunku "Technologia chemiczna" w zakresie "Zielona chemia i czyste technologie".
Plan studiów zatwierdzony przez Radę Wydziału Matematyki, Fizyki i Chemii w dniu 27 kwietnia 2010 r.
10 120 135 19 135 165 26
375
29
330
330
28
2. Siatka studiów: specjalność Technologia nieorganiczna i organiczna
Wydział Matematyki, Fizyki i Chemii
Kierunek "Technologia chemiczna"
Specjalność: "Technologia nieorganiczna i organiczna"
studia I stopnia
studia stacjonarne inŜynierskie
od roku akademickiego 2011/2012
15 tyg.
15 tyg.
15 tyg.
15 tyg.
45
4 Chemia nieorganiczna
E
105
30
60
5 Chemia organiczna
E
150
45
6 Chemia fizyczna
E
135
7 Chemia materiałów
E
8 Podstawy spektroskopii molekularnej
wykł.
ćwicz.
ECTS
7
45
45
7
15
8
30
75
8
90
15
13
45
105
13
30
60
45
10
60
15
45
Z
15
15
9 Matematyka
E
210
105
10 Fizyka
E
120
60
30
11 Podstawy elektrotechniki i elektroniki
Z
45
15
30
Z
15
12 Grafika inŜynierska
RAZEM A:
1200
0
510
15
45
4
1
15
24
60
60
15
45
45
9
30
13
30
45
7
30
15
6
15
30
3
3
15
405
4
105
255 30
1
98
15
30
105
10
ECTS
45
7
ćwicz.
90
105
wykł.
E
15
ECTS
3 Analiza instrumentalna
7
15 tyg.
ćwicz.
15
ECTS
90
ćwicz.
15
IV rok
semestr 7
15 tyg.
wykł.
120
7
ECTS
E
105
ćwicz.
2 Chemia analityczna
7
30
III rok
semestr 5
semestr 6
15 tyg.
wykł.
30
ECTS
15
ćwicz.
semin.
60
wykł.
konwer.
30
Razem
ECTS
laborat.
135
Nazwa przedmiotu
ćwicz.
E
wykłady
Razem
1 Podstawy chemii
Lp
ECTS
semestr 4
ćwicz.
semestr 3
wykł.
semestr 2
w tym
E/Z
II rok
semestr 1
wykł.
I rok
A GRUPA TREŚCI PODSTAWOWYCH
0
0
0
0
0
0
1
1
120 225 30 105 195 25 120 225 28
30 105 10
30
45
5
15 tyg.
15 tyg.
15 tyg.
E
75
30
16 Maszynoznawstwo i aparatura przemysłu chem.
Z
45
30
17 Technologia chemiczna - surowce i procesy
E
90
45
45
8
45
45
8
18 Automatyka i pomiar wielkości fizykochem.
Z
45
15
30
4
15
30
4
19 Zarządzanie jakością i produktami chemicznymi
Z
30
20 Kataliza i procesy katalityczne
E
75
30
45
6
21 Projektowanie procesów technologicznych
Z
45
15
30
3
15
22 Bezpieczeństwo techniczne
Z
15
1
15
23 Współczesna synteza nieorganiczna i organiczna
E
90
30
24 Materiały dla optoelektroniki
E
30
30
630
285
RAZEM B:
15
15
60
ćwicz.
ECTS
30
ECTS
6
wykł.
45
ECTS
30
wykł.
6
ECTS
6
wykł.
30
ECTS
30
wykł.
6
3
30
15 tyg.
wykł.
45
ćwicz.
15 Podstawy inŜynierii chemicznej i procesowej
30
30
ćwicz.
30
2
ćwicz.
60
ćwicz.
E
Razem
ECTS
14 Termodynamika techniczna i chemiczna
semin.
30
konwer.
30
laborat.
E
ćwicz.
13 Podstawy technologii chemicznej
Nazwa przedmiotu
wykłady
Razem
15 tyg.
E/Z
Lp
15 tyg.
30
2
60
8
2
15
3
2
30
45
6
30
3
1
8
30
2
0
255
45
45
51
IV rok
semestr 7
30
0
0
0
60
ECTS
15 tyg.
w tym
III rok
semestr 5
semestr 6
ćwicz.
semestr 4
wykł.
semestr 3
ECTS
semestr 2
ćwicz.
II rok
semestr 1
wykł.
I rok
B GRUPA TREŚCI KIERUNKOWYCH
15
5
0
0
0
90 120 18
90 105 16
30
90
10
30
2
0
2
15 tyg.
15 tyg.
15 tyg.
29 Informacja naukowa
Z
15
30 Metody obliczeniowe w chemii
E
45
15
30
5
31 Planowanie i optymalizacja eksperymentu
Z
30
15
15
2
32 Chemometria w kontroli procesów technolog.
Z
60
30
30
4
30
33 Przedmiot obieralny
Z
90
90
7
30
34 Projekt technologiczny
Z
45
15
35 Wykład specjalizacyjny
E
150
150
36 Projekt inŜynierski
Z
120
37 Seminarium inŜynierskie
Z
30
wykł.
45
2
15 tyg.
ECTS
Z
60
wykł.
28 Technologia informacyjna
ECTS
60
2
ćwicz.
Z
60
wykł.
27 Przedmiot interdyscyplinarny
ECTS
2
0
ćwicz.
60
30
wykł.
60
ECTS
Z
0
ćwicz.
b Specjalistyczny j. angielski
30
wykł.
4
ECTS
120
ćwicz.
120
wykł.
Z
Razem
ECTS
a Język angielski
semin.
0
konwer.
60
laborat.
60
25 Wychowanie fizyczne
ćwicz.
Z
Nazwa przedmiotu
wykłady
Razem
15 tyg.
E/Z
Lp
IV rok
semestr 7
15 tyg.
60
2
ECTS
15 tyg.
w tym
III rok
semestr 5
semestr 6
ćwicz.
semestr 4
wykł.
semestr 3
ECTS
semestr 2
ćwicz.
II rok
semestr 1
ćwicz.
I rok
C INNE WYMAGANIA
15
15
2
26 Język obcy w tym :
RAZEM C:
RAZEM SEMESTRY (A+B+C)
930
60
4
45
2
15
45
30
240
45
30
2
2
15
30
2
1
30
5
30
15
30
15
4
5
10
240
2
1
120
375
30
2
2
30
30
30
3
90
6
5
2
10
120
10
30
5
30
5
30
61
2 760 1 065 240 1 005 345 105
210
0
75
420
2
0
32
RAZEM ROCZNIE
OGÓŁEM
PRAKTYKI
825
30
405
0
30
0
60
405
2
0
30
60
405
2
120 30
30
420
810
31
795
2 760
Praktyka - 6 tygodni po II roku
Studia kończą się nadaniem tytułu zawodowego inŜyniera na kierunku "Technologia chemiczna" w zakresie "Technologia nieorganiczna i organiczna".
Plan studiów zatwierdzony przez Radę Wydziału Matematyki, Fizyki i Chemii w dniu 27 kwietnia 2010 r.
10 120 135 19 135 165 26
375
29
330
330
28
3. Przedmioty z grupy treści podstawowych
Podstawy chemii
Chemia analityczna
Analiza instrumentalna
Chemia nieorganiczna
Chemia organiczna
Chemia fizyczna
Chemia materiałów
Podstawy spektroskopii molekularnej
Matematyka (część I)
Matematyka (część II)
Fizyka (część I)
Fizyka (część II)
Podstawy elektrotechniki i elektroniki
Grafika inŜynierska
Numer kursu: 0310-3.08.1.001
Numer w siatce studiów: 1
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 7
Rok studiów: 1
Semestr: 1
Podstawy chemii
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
prof. zw. dr hab. Teresa Kowalska
wykład, seminarium, laboratorium, konwersatorium
30, 15, 60, 15
obowiązkowy
brak
Treści kształcenia: Pierwiastki, związki, roztwory i fazy. Symbole i wzory. Reakcje
chemiczne i równania chemiczne. Energia, ciepło i temperatura. Jednostki miar. Precyzja
i dokładność. Wewnętrzna budowa atomu. Badania doświadczalne nad elektryczną naturą
atomu. Ładunek i masa elektronu. Spektroskopia atomowa. Odkrycie jądra atomowego.
Odkrycie liczby atomowej. Izotopy. Trwałość jądra atomowego. Promieniotwórczość
naturalna i sztuczna. Model atomu Bohra. Budowa atomów a model Bohra. Falowa natura
elektronu. Spin elektronowy. Liczby kwantowe. Elektrony w cząsteczkach. Wiązania jonowe.
Wiązania kowalencyjne. Wiązania koordynacyjne. Polarność wiązań. Elektroujemność.
Energia wiązań i skala elektroujemności. Nasycenie wartościowości. Rezonans. Kształty
cząsteczek i orbitale zhybrydyzowane. Powłoka wartościowości i odpychanie par elektronów.
Stan gazowy. Objętość, temperatura i ciśnienie. Ciśnienia cząstkowe. Zasada Avogadra.
Równanie stanu. Dyfuzja. Teoria kinetyczna gazów. Odchylenia gazów rzeczywistych od
zachowania się gazu doskonałego. Temperatura krytyczna. Chłodzenie przez rozpręŜanie.
Właściwości cieczy. Ciśnienie pary nasyconej. Temperatura wrzenia. Właściwości ciał
stałych. Sieć przestrzenna kryształów. Ciekłe kryształy. Upakowanie atomów w sieci
krystalicznej. Defekty sieci krystalicznej. Wiązania w ciałach stałych. Energie spójności
kryształów. Krzywe ogrzewania i krzywe chłodzenia. Przegrzanie i przechłodzenie cieczy.
Wykresy fazowe.
Cele przedmiotu: Rekapitulacja wiedzy chemicznej, wyniesionej z wcześniejszych etapów
nauczania i rozbudowanie tej wiedzy. Szczególny nacisk jest kładziony na zagadnienia
dotyczące budowy materii, typów reakcji chemicznych, podstawowych praw chemicznych, na
znajomość nomenklatury chemicznej i na sprawne wykorzystywanie podstawowych praw
chemicznych w rachunku chemicznym i przy układaniu równań stechiometrycznych.
Efekty kształcenia: Po ukończeniu kursu student powinien mieć wiedzę z zakresu
podstawowych pojęć i praw chemicznych, posiadać jej zrozumienie i umiejętność czynnego
wykorzystania do przeprowadzenia podstawowych obliczeń chemicznych, a takŜe posiadać
wystarczającą orientację, co do istoty prostych reakcji chemicznych i elementarnych zjawisk
fizycznych, jednocześnie umiejąc rozróŜniać pomiędzy nimi.
Zalecana literatura:
[1] M.J. Sienko, R.A. Plane, Chemia – podstawy i zastosowania, PWN, Warszawa, 1999.
[2] G. Grygierczyk, M. Podgórna, Materiały pomocnicze do zajęć dydaktycznych z podstaw chemii, Wyd.
Uniwersytetu Śląskiego, Katowice, 2007.
[3] Obliczenia chemiczne – zbiór zadań z chemii nieorganicznej i analitycznej wraz z podstawami
teoretycznymi, pod red. A. Śliwy, PWN, Warszawa, 1979.
11
Numer kursu: 0310-3.08.1.007
Numer w siatce studiów: 2
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 7
Rok studiów: 1
Semestr: 2
Chemia analityczna
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Rafał Sitko
wykład, laboratorium, konwersatorium
15, 90, 15
obowiązkowy
podstawy chemii
Treści kształcenia: Rola i zadania współczesnej chemii analitycznej. Analiza jakościowa
kationów i anionów. Podstawy analizy ilościowej. Analiza grawimetryczna, podstawy
teoretyczne: warunki strącania osadów, iloczyn rozpuszczalności, mechanizmy towarzyszące
tworzeniu osadów. Analiza miareczkowa – podział metod wg typu reakcji zachodzących
podczas miareczkowania. Równowagi kwasowo – zasadowe, jonowe i redoksowe. Krzywe
miareczkowania i detekcja punktu końcowego. Alkacymetria, redoksometria,
kompleksometria, precypitometria – podstawy teoretyczne i przykłady oznaczeń. Analiza
próbek złoŜonych rzeczywistych. Pobór i przygotowanie próbek do analizy oraz opracowanie
wyników analizy. Rozdzielanie i zatęŜanie analitów. Zastosowanie wybranych metod
instrumentalnych do oznaczania makro- i mikroskładników: spektrometria UV-VIS,
Potencjometria, konduktometria, elektroliza, kulometria. Walidacja metod analitycznych.
Warunki akredytacji laboratoriów analitycznych.
Cele przedmiotu: Absolwent studiów powinien posiąść podstawową wiedzę i umiejętności
praktyczne w zakresie chemii analitycznej i podstawowych technik instrumentalnych.
Powinien swobodnie wykonywać podstawowe obliczenia analityczne i poprawnie
interpretować wyniki przeprowadzonych analiz.
Efekty kształcenia: Po ukończeniu kursu student powinien opanować podstawową wiedzę
i umiejętności praktyczne z zakresu chemii analitycznej, co umoŜliwi mu wykonanie
określonego zadania analitycznego.
Zalecana literatura:
[1] J. Minczewski, Z. Marczenko, Chemia analityczna t. 1 i 2, PWN, Warszawa, 2007.
[2] D.A. Skoog, D.M. West, F.J. Holler, S.P. Crouch, Podstawy chemii analitycznej, PWN, Warszawa, 2006.
[3] A. Hulanicki, Współczesna chemia analityczna. Wybrane zagadnienia, PWN, Warszawa, 2001.
12
Numer kursu: 0310-3.08.1.014
Numer w siatce studiów: 3
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 7
Rok studiów: 2
Semestr: 3
Analiza instrumentalna
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Rafał Sitko
wykład, laboratorium
45, 45
obowiązkowy
chemia analityczna
Treści kształcenia: Charakterystyka metod instrumentalnych i ich podział. Metody
spektroskopowe, podstawy teoretyczne: widma absorpcyjne i emisyjne, prawa absorpcji.
Monochromatyzacja, detekcja i rejestracja widm. Spektrofotometria cząsteczkowa,
turbidymetria, nefelometria, polarymetria, refraktometria – podstawy teoretyczne, aparatura
i przykłady oznaczeń. Spektroskopia atomowa: emisyjna i absorpcyjna – podstawy
teoretyczne, techniki pomiarowe i zastosowania analityczne. Spektrometria rentgenowskiej
fluorescencji i spektrometria mas. Metody elektroanalityczne – podstawy fizykochemiczne
i zastosowania. Potencjometria, elektrograwimetria, polarografia, woltamperometria
i konduktometria, elektroforeza oraz metody radiometryczne. Precyzja i dokładność pomiaru
w technikach instrumentalnych. Efekty interferencyjne, kalibracje. Czułość, selektywność
i specyficzność metod instrumentalnych. Analiza specjacyjna i wieloskładnikowa. Podstawy
chromatografii. Techniki łączone.
Cele przedmiotu: Opanowanie najwaŜniejszych technik instrumentalnych: podstawy
teoretyczne, aparatura, zastosowania analityczne.
Efekty kształcenia: Po ukończeniu kursu student powinien posiąść umiejętność wyboru
metod i aparatury do wykonania określonego zadania analitycznego, posługiwania się
wybranym sprzętem, poprawnego wykonania analizy i interpretacji otrzymanych wyników.
Powinien takŜe umieć uzasadnić wybór metody pod względem wymogów analitycznych
i ekonomicznych.
Zalecana literatura:
[1] W. Szczepaniak, Metody instrumentalne w analizie chemicznej, PWN, Warszawa, 2002.
[2] A. Cygański, Metody spektroskopowe w chemii analitycznej, WNT, Warszawa 2002.
[3] A. Cygański, Podstawy metod elektroanalitycznych, WNT, Warszawa 1999.
13
Numer kursu: 0310-3.08.1.015
Numer w siatce studiów: 4
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 8
Rok studiów: 2
Semestr: 3
Chemia nieorganiczna
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
prof. dr hab. Stanisław Krompiec
wykład, laboratorium, konwersatorium
30, 60, 15
obowiązkowy
podstawy chemii
Treści kształcenia: Klasyfikacja, budowa, nazewnictwo, właściwości, reaktywność
i zastosowania związków nieorganicznych w róŜnych działach nauki, techniki i w medycynie.
Wiązania chemiczne w związkach i substancjach nieorganicznych, w tym w związkach
koordynacyjnych i metaloorganicznych. Klasy związków i substancji nieorganicznych,
budowa, wiązania, charakterystyka. Okresowość właściwości pierwiastków i związków
nieorganicznych. Kwasy i zasady w chemii nieorganicznej, teorie kwasów i zasad. Elementy
chemii koordynacyjnej i metaloorganicznej, wiązanie metal ligand, izomeria i nazewnictwo
wybranych połączeń. Szczegółowa chemia pierwiastków bloków s i p; budowa i właściwości
pierwiastków i ich związków. Ogólna charakterystyka pierwiastków bloków d i f; specyfika
pierwiastków przejściowych, wybrane klasy związków pierwiastków przejściowych. Typy
reakcji związków nieorganicznych i kompleksowych. Równowagi chemiczne w chemii
związków nieorganicznych i kompleksowych. Otrzymywanie pierwiastków, metody
laboratoryjne i przemysłowe, wybrane przykłady, metody ogólne. Preparatyka wybranych
związków nieorganicznych i koordynacyjnych; metody laboratoryjne i przemysłowe,
elementy technologii nieorganicznej. Wybrane przykłady zastosowań pierwiastków i ich
związków nieorganicznych, koordynacyjnych i metaloorganicznych w róŜnych działach
chemii i technologii chemicznej, w elektronice, medycynie, metalurgii i innych dziedzinach
nauki i techniki.
Cele przedmiotu: Przedstawienie właściwości fizykochemicznych pierwiastków
chemicznych i ich związków nieorganicznych, koordynacyjnych i metaloorganicznych
w świetle prawa okresowości. Przedstawienie budowy, nazewnictwa i metod otrzymywania
wybranych klas związków i substancji nieorganicznych. Pokazanie znaczenia chemii
nieorganicznej w róŜnych działach nauki i techniki.
Efekty kształcenia: Po ukończeniu kursu student powinien znać właściwości pierwiastków
i wybranych klas związków nieorganicznych, umieć je analizować w kontekście prawa
okresowości. Powinien umieć zastosować tę wiedzę do rozwiązywania problemów
związanych z budową, reaktywnością oraz otrzymywaniem związków i substancji
nieorganicznych a takŜe interpretacją prostych mechanizmów reakcji.
Zalecana literatura:
[1] F.A. Cotton, G. Wilkinson, P.L. Gaus, Chemia nieorganiczna, PWN, Warszawa, 1995.
[2] L. Kolditz, Chemia nieorganiczna, PWN, Warszawa, 1994.
[3] A. Bielański, Chemia Nieorganiczna, PWN, Warszawa, 1999.
14
Numer kursu: 0310-3.08.1.016
Numer w siatce studiów: 5
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 13
Rok studiów: 2
Semestr: 3
Chemia organiczna
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
prof. zw. dr hab. inŜ. Jarosław Polański
wykład, laboratorium, konwersatorium
45, 90, 15
obowiązkowy
podstawy chemii
Treści kształcenia: Nomenklatura, grupy funkcyjne. Izomeria. Wiązania chemiczne.
Struktury elektronowe. Karbokationy, karboaniony, wolne rodniki, karbeny. Stereochemia.
Analiza konformacyjna. Konfiguracja absolutna i względna. Chiralność a czynność optyczna.
Efekty elektronowe i steryczne. Pojecie rezonansu. Hiperkoniugacja. Spektroskopia IR,
1
H NMR, MS, UV-VIS. Typy reakcji organicznych. Homolityczny/heterolityczny rozpad
wiązania. Energia aktywacji i stan przejściowy. Alkany, cykloalkany, halogenowanie związki
Grignarda, kwasowość zasadowość, nukleofilowość, elektrofilowość. Alkeny. Reakcja
dehydrohalogenacji, reakcja dehydratacji alkoholi, mechanizmy eliminacji E1 i E2, reguła
Zajcewa i Hofmanna. Reakcje alkenów. Addycja elektrofilowa, reguła Markownikowa, efekt
nadtlenkowy. Pojęcia stereospecyficzności, stereoselektywności reakcji. Halogenki alkilu.
Reakcje substytucji nukleofilowej SN1 SN2. Konkurencyjność substytucji i eliminacji.
Alkiny. Dieny. Addycja 1,2 i 1,4. Związki aromatyczne. Reguła Hückla. Alotropowe odmiany
węgla, fulereny. Aromatyczne związki heterocykliczne. Aromatyczna substytucja
elektrofilowa. Aromatyczna substytucja nukleofilowa (chlorobenzen, pirydyna). Alkohole
fenole i etery. Aldehydy i ketony. Reakcje addycji nukleofilowej do wiązania karbonylowego.
Kwasy karboksylowe i pochodne, reakcje pochodnych kwasów karboksylowych, kondensacja
Claisena. Amidy. Aminy, Sole diazoniowe. Barwniki azowe. Alkaloidy. Związki nitrowe.
Analiza retrosyntetyczna, Dioksyny. Mono-, disacharydy, aminokwasy, polipeptydy, kwasy
nukleinowe.
Cele przedmiotu: Przedstawienie podstawowych pojęć chemii organicznej: grupy funkcyjne,
klasyfikacja, nomenklatura, budowa związków organicznych ich właściwości, otrzymywanie
i reaktywność, podstawowe mechanizmy reakcji organicznych oraz metody identyfikacji
związków organicznych.
Efekty kształcenia: Po ukończeniu kursu student powinien opanować wiedzę z zakresu
podstawowych pojęć chemii organicznej oraz posiadać jej zrozumienie i umiejętność
wykorzystania do rozwiązywania problemów związanych z budową, reaktywnością oraz
otrzymywaniem związków organicznych a takŜe interpretacją prostych mechanizmów reakcji.
Zalecana literatura:
[1] J. McMurry, Chemia organiczna, Wyd. Naukowe PWN, tomy 1-5, Warszawa, 2005.
[2] R.T. Morrison i R.N. Boyd, Chemia organiczna, Wyd. Naukowe PWN, Warszawa, 1985.
15
Numer kursu: 0310-3.08.1.018
Numer w siatce studiów: 6
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 10
Rok studiów: 2
Semestr: 4
Chemia fizyczna
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Wojciech Marczak, prof. UŚ
wykład, laboratorium, konwersatorium
30, 60, 45
obowiązkowy
matematyka, fizyka
Treści kształcenia: Zasady termodynamiki. Potencjały termodynamiczne. Układy
wieloskładnikowe jednofazowe – roztwory. Wielkości intensywne i ekstensywne. Wielkości
cząstkowe molowe. Potencjał chemiczny. Aktywność i współczynnik aktywności. Reguła faz
Gibbsa. Układy wieloskładnikowe wielofazowe. Równowagi fazowe w układach binarnych
ciecz – gaz i ciecz – ciało stałe. Prawo podziału Nernsta, ekstrakcja. Efekt cieplny reakcji
chemicznej, prawo Hessa. Pojemność cieplna. Prawo Kirchhoffa. Warunki samorzutności
reakcji chemicznej. Powinowactwo chemiczne. Stan równowagi, prawo działania mas.
Podstawy elektrochemii: wzór Nernsta. Procesy potencjałotwórcze na granicy faz. Korozja.
Układy koloidalne. Zjawiska powierzchniowe. Napięcie powierzchniowe. ZwilŜanie
powierzchni ciała stałego, adhezja, kohezja. Adsorpcja. Kinetyka chemiczna. Rzędowość,
cząsteczkowość i mechanizm reakcji. Równanie Arrheniusa, energia aktywacji. Teoria
kompleksu aktywnego. Kataliza. Procesy foto- radio- i sonochemiczne. Właściwości
elektryczne substancji. Elektryczny moment dipolowy. Polaryzowalność. Dielektryk
w zmiennym polu elektrycznym. Podstawy spektroskopii rezonansowej. Ładunek elektryczny
w polu magnetycznym. Spektrometr mas. Efekt Zeemana. Związek właściwości
magnetycznych ze strukturą elektronową atomów, jonów i cząsteczek. Klasyfikacja substancji
ze względu na podatność magnetyczną. Histereza namagnesowania. Stan krystaliczny.
Elementy krystalografii geometrycznej. Pojęcie siły termodynamicznej (bodźca) i przepływu
– lepkość, dyfuzja, przepływ ciepła.
Cele przedmiotu: Przedstawienie chemii fizycznej jako dyscypliny opisującej podstawowe
prawa przyrody oraz związki i zaleŜności wykorzystywane w innych dziedzinach chemii.
Zwrócenie uwagi na relacje pomiędzy rzeczywistością fizykochemiczną a opisem
matematycznym zjawisk. Zapoznanie z charakterystycznym dla chemii fizycznej
rygorystycznym wnioskowaniem opartym fundamencie empirycznym i modelach fizycznych.
Efekty kształcenia: Znajomość podstawowych pojęć i praw fizykochemicznych,
wynikających zarówno z termodynamiki jak i podejścia nietermodynamicznego. Dostrzega
fundamenty fizykochemiczne w innych gałęziach chemii. Umie rozwiązywać problemy
i zadania korzystając z pojęć z zakresu chemii fizycznej. Posługuje się sprzętem
laboratoryjnym do wyznaczania wybranych wielkości fizykochemicznych. Opanował
podstawy rachunku błędów i statystyki matematycznej.
Zalecana literatura:
[1] P.W. Atkins, Chemia fizyczna, Wyd. Naukowe PWN, Warszawa, 2007.
[2] H. Buchowski i W. Ufnalski, Podstawy termodynamiki, WNT, Warszawa, 1998.
[3] L. Sobczyk, A. Kisza, K. Gatner, A. Koll, Eksperymentalna chemia fizyczna, PWN, Warszawa 1982.
16
Numer kursu: 0310-3.08.1.023
Numer w siatce studiów: 7
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 4
Rok studiów: 3
Semestr: 5
Chemia materiałów
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Wojciech Pisarski, prof. UŚ
wykład, laboratorium
15, 45
obowiązkowy
podstawy chemii
Treści kształcenia: Korelacja między składem chemicznym, strukturą, technologią
i właściwościami materiałów. Wiązania chemiczne. Struktura materiałów, defekty struktury.
Materiały metaliczne. Metale i ich stopy. śelazo i jego stopy. Stale, staliwa, Ŝeliwa. Wpływ
pierwiastków stopowych i zanieczyszczeń na właściwości stali. Metale nieŜelazne i ich stopy.
Obróbka cieplna. Korozja. Właściwości i zastosowania metali. Materiały polimerowe.
Polimery naturalne i syntetyczne. Polimery termoplastyczne, termoutwardzalne, elastomery.
Budowa, izomeria i konformacja polimerów. Kopolimery. śywice fenolowe, epoksydowe
i poliestrowe, polimery biodegradowalne, polimery przewodzące. Właściwości i zastosowania
polimerów. Materiały ceramiczne. Podział ceramiki. Ceramika szlachetna. Ceramika
inŜynieryjna. Materiały ogniotrwałe. Materiały spiekane. Proszki ceramiczne. Szkła i układy
szklano-ceramiczne. Materiały dla medycyny. Materiały dla optyki. Kompozyty. Właściwości
mechaniczne, cieplne, elektryczne, magnetyczne i optyczne materiałów. Zastosowania.
Cele przedmiotu: Celem przedmiotu jest zapoznanie studentów z zagadnieniami szeroko
rozumianej chemii materiałów. W szczególności zakres przedmiotu obejmuje poznanie
budowy i właściwości materiałów metalicznych, polimerowych i ceramicznych, kompozytów
oraz ich zastosowań w medycynie i optoelektronice.
Efekty kształcenia: Po ukończeniu kursu student powinien znać róŜne rodzaje
współczesnych materiałów technicznych, podstawowe właściwości tych materiałów oraz
najwaŜniejsze aspekty technologiczne. W szczególności istotna jest relacja pomiędzy
metodami wytwarzania materiałów, ich budową i właściwościami.
Zalecana literatura:
[1] L. Kolditz, Chemia nieorganiczna, PWN, Warszawa, 1994.
[2] M. Blicharski, Wstęp do inŜynierii materiałowej, WNT, Warszawa, 2006.
[3] L.A. Dobrzański, „Materiały inŜynierskie i projektowanie materiałowe. Podstawy nauki o materiałach
i metaloznawstwo”, WNT, Warszawa, 2006.
[4] H. Bala, Wstęp do chemii materiałów, WNT, 2003.
17
Numer kursu: 0310-3.08.1.024
Numer w siatce studiów: 8
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 1
Rok studiów: 3
Semestr: 5
Podstawy spektroskopii molekularnej
Wykładowca:
dr hab. Henryk Flakus, prof. UŚ
Typ zajęć:
wykład
Liczba godzin:
15
Przedmiot:
obowiązkowy
Wymagania wstępne: podstawy chemii
Treści kształcenia: podstawy spektroskopii oscylacyjnej w podczerwieni, spektroskopii
Ramana,
spektroskopii
rotacyjnej
w
zakresie
mikrofalowym,
spektroskopii
elektronowo-oscylacyjnej w zakresie światła widzialnego i w nadfiolecie, spektroskopii
magnetycznego rezonansu jądrowego protonowego, węgla 13C oraz kilku innych jąder
atomowych, spektroskopii paramagnetycznego rezonansu spinu elektronowego EPR,
spektroskopii Mössbauera, spektroskopii fotoelektronowych. Interpretacja standardowych
widm i na zastosowanie omawianych spektroskopii w badaniach naukowych w zakresie
chemii organicznej oraz fizykochemii.
Cele przedmiotu: Celem wykładu jest wprowadzenie podstawowych pojęć i metod
spektroskopowych, mających zastosowanie w badaniach chemicznych, w tym głównie
badaniach strukturalnych. Nabycie umiejętności interpretacji widm molekularnych
i samodzielnego rozwiązywania standardowych problemów chemicznych wspierając się
technikami spektroskopowymi.
Efekty kształcenia: Po ukończeniu kursu student powinien umieć interpretować proste
widma molekularne, co umoŜliwi mu rozwiązywanie standardowych problemów odnośnie
struktury molekuł, wybranych własności fizyko- chemicznych, reaktywności, etc.; znaleźć
zastosowania spektroskopii w róŜnych działach chemii i poza nią.
Zalecana literatura:
[1] Z. Kęcki: Podstawy spektroskopii molekularnej, PWN, Warszawa, 1992.
[2] W. Zieliński i A. Rajca, Metody spektroskopowe i ich zastosowanie do identyfikacji związków
organicznych, WNT, Warszawa, 1995.
18
Numer kursu: 0310-3.08.1.002
Numer w siatce studiów: 9
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 15
Rok studiów: 1
Semestr: 1
Matematyka (część I)
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Justyna Sikorska
wykład, konwersatorium
60, 60
obowiązkowy
podstawy matematyki z zakresu szkoły średniej
Treści kształcenia: Elementy logiki matematycznej i teorii mnogości. Definicja funkcji,
złoŜenie funkcji, funkcja odwracalna. Własności zbiorów liczb rzeczywistych i zespolonych.
Zasada indukcji matematycznej. Funkcje elementarne – własności i wykresy. Algebra
liniowa: macierze, układy równań liniowych, wyznaczniki, wartości własne i wektory własne.
Elementy geometrii analitycznej. Elementy geometrii przestrzennej. Ciągi liczbowe: granica
ciągu, zbieŜność w zbiorze liczb rzeczywistych. Twierdzenia o zbieŜności. Szeregi, kryteria
zbieŜności szeregów, szeregi potęgowe. Granica funkcji, własności granic. Ciągłość funkcji,
własności funkcji ciągłych. Ciągłość funkcji elementarnych. Pojęcia pochodnej i róŜniczki
funkcji rzeczywistej. Twierdzenia o wartości średniej oraz ich konsekwencje. Szereg Taylora.
Reguła de l’Hospitala obliczania granic. Całka nieoznaczona, funkcja pierwotna. Całka
Riemanna, metody obliczania całek. Zastosowanie rachunku róŜniczkowego i całkowego do
rozwiązywania zagadnień chemicznych.
Cele przedmiotu: Wprowadzenie podstawowych pojęć matematyki współczesnej: liczby
rzeczywiste i zespolone, funkcje, ciągi i szeregi, algebra liniowa, geometria, rachunek
róŜniczkowy i całkowy. Przedstawienie moŜliwych zastosowań matematyki w chemii i
fizyce.
Efekty kształcenia: Po ukończeniu kursu student powinien posiadać wiedzę na temat
podstawowych pojęć matematyki wyŜszej. Student powinien posiadać umiejętność obliczania
granic, pochodnych i całek, jak równieŜ rozwiązywania układów równań liniowych. Student
powinien umieć zastosować metody matematyczne do rozwiązywania zagadnień
pochodzących z chemii i fizyki.
Zalecana literatura:
[1] J. Ger, Kurs matematyki dla chemików, Wyd. Uniwersytetu Śląskiego, Katowice, 2005.
[2] W. Krysicki, L. Włodarski, Analiza matematyczna w zadaniach, PWN, Warszawa, 2002.
[3] J. Sikorska, Zbiór zadań z matematyki dla studentów chemii, Wyd. Uniwersytetu Śląskiego, Katowice, 2010.
19
Numer kursu: 0310-3.08.1.008
Numer w siatce studiów: 9
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 9
Rok studiów: 1
Semestr: 2
Matematyka (część II)
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Justyna Sikorska
wykład, konwersatorium
45, 45
obowiązkowy
zaliczona matematyka (część I)
Treści kształcenia: Rachunek róŜniczkowy funkcji wielu zmiennych: róŜniczka funkcji wielu
zmiennych, pochodne cząstkowe oraz ich związek z róŜniczką. Działania na róŜniczkach
i pochodnych cząstkowych, zastosowania w chemii. Pochodne cząstkowe wyŜszych rzędów.
Zastosowania rachunku róŜniczkowego funkcji wielu zmiennych do wyznaczania ekstremów
funkcji. Twierdzenie o funkcji uwikłanej. Ekstrema warunkowe. Całka funkcji wielu
zmiennych. Całki iterowane oraz ich związek z całką wielokrotną. Własności całki. Całki
w obszarach normalnych na płaszczyźnie i w przestrzeni. Krzywe i powierzchnie
w przestrzeniach skończenie wymiarowych. Całki krzywoliniowe i powierzchniowe funkcji
wielu zmiennych. Twierdzenia Greena, Gaussa-Ostrogradskiego i Stokesa oraz ich
zastosowania w chemii i fizyce. Elementy teorii równań róŜniczkowych: równanie liniowe,
równanie jednorodne, równanie Bernoulliego, równanie o zmiennych rozdzielonych;
zastosowania w chemii. Układy liniowych równań róŜniczkowych. Równania n-tego rzędu
o stałych współczynnikach; zastosowania w fizyce. Równanie Schrödingera. Szeregi Fouriera.
Elementy statystyki matematycznej. Wybrane zagadnienia optymalizacji oraz analizy
numerycznej.
Cele przedmiotu: Wprowadzenie podstawowych pojęć współczesnej matematyki: róŜniczki
i całki funkcji wielu zmiennych. Podstawowy wykład teorii równań róŜniczkowych
zwyczajnych. Zastosowania rachunku róŜniczkowego i całkowego oraz równań róŜniczkowych
w chemii i fizyce. Przedstawienie elementów statystyki matematycznej, teorii optymalizacji
oraz metod numerycznych.
Efekty kształcenia: Po ukończeniu zajęć student powinien posiadać wiedzę na temat metod
rachunku róŜniczkowego i całkowego funkcji wielu zmiennych oraz podstawowych metod
statystyki, analizy numerycznej oraz teorii optymalizacji. Student powinien nabyć umiejętność
rozwiązywania niektórych klas równań róŜniczkowych. Powinien równieŜ umieć posługiwać
się metodami matematycznymi w opisie zjawisk fizycznych i procesów chemicznych.
Zalecana literatura:
[1] J. Ger, Kurs matematyki dla chemików, Wyd. Uniwersytetu Śląskiego, Katowice, 2005.
[2] W. Krysicki i L. Włodarski, Analiza matematyczna w zadaniach, PWN, Warszawa, 2002.
[3] J. Sikorska, Zbiór zadań z matematyki dla studentów chemii, Wyd. Uniwersytetu Śląskiego, Katowice, 2010.
20
Numer kursu: 0310-3.08.1.003
Numer w siatce studiów: 10
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 7
Rok studiów: 1
Semestr: 1
Fizyka (część I)
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
prof. zw. dr hab. Ewa Talik
wykład, laboratorium, konwersatorium
30, 30, 15
obowiązkowy
brak
Treści kształcenia: Istota Fizyki. Wzorce i jednostki miar. Pomiar wielkości fizycznych.
Modele matematyczne w fizyce. Wektory. Wielkości skalarne i wektorowe. Dodawanie
wektorów. Iloczyn skalarny i wektorowy. Kinematyka. Układ odniesienia. Zjawisko ruchu.
Ruch jednowymiarowy i ruch w przestrzeni. Pojęcie przemieszczenia, prędkości
i przyśpieszenia. Rzuty. Ruch po torze krzywoliniowym. Ruch względny. Dynamika punktu
materialnego. Masa, pęd i siła. Zasady dynamiki Newtona. Zastosowanie zasad dynamiki
Newtona. Siły kontaktowe i bezkontaktowe. Tarcie. Opory ruchu w płynie. Oddziaływania
fundamentalne. Praca. Praca wykonywana przez siłę stałą i zmienną. Energia kinetyczna.
Moc. Energia potencjalna. Zasada zachowania energii. Siły zachowawcze i niezachowawcze.
Zasada zachowania pędu. Środek masy. Ruch środka masy. Zderzenia. Mechanika bryły
sztywnej. Moment bezwładności. Moment siły. Energia i praca w ruchu obrotowym. Moment
pędu. Zasada zachowania momentu pędu. śyroskop i precesja. Warunki równowagi. Moduł
spręŜystości. Moduł ściśliwości. Grawitacja. Prawo powszechnego ciąŜenia. Doświadczenie
Cavendisha. Prawa Keplera ruchu planet. CięŜar. Pole grawitacyjne. Czarne dziury. Ruch
drgający. Siła harmoniczna. Wahadła. Energia ruchu harmonicznego. Oscylator harmoniczny
tłumiony. Drgania wymuszone i rezonans. Mechanika cieczy. Ciśnienie i gęstość. Prawo
Pascala. Pomiar ciśnienia. Prawo Archimedesa. Napięcie powierzchniowe. Włoskowatość.
Ciecz w ruchu. Równanie ciągłości. Równanie Bernoulliego i jego zastosowania. Fale
w ośrodkach spręŜystych. Fale mechaniczne. Rozchodzenie się fal. Prędkość fal.
Przenoszenie energii przez fale. Dźwięk. NatęŜenie dźwięku. Percepcja dźwięku. Fale stojące.
Postacie drgań. Interferencja. Dudnienia. Efekt Dopplera. Fala uderzeniowa.
Cele przedmiotu: Przedstawienie
uniwersyteckiego z fizyki.
podstawowych
zagadnień
z
zakresu
kursu
Efekty kształcenia: Po ukończeniu kursu student powinien opanować wiedzę z zakresu
podstawowych pojęć z fizyki, posiadać umiejętność pomiarów podstawowych wielkości
fizycznych, zrozumienia procesów i zjawisk fizycznych w przyrodzie, wykorzystywać prawa
przyrody w technice i Ŝyciu codziennym.
Zalecana literatura:
[1] D. Halliday, R. Resnick, J. Walker, Podstawy Fizyki, tomy 1-5, PWN, 2003.
21
Numer kursu: 0310-3.08.1.009
Numer w siatce studiów: 10
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 6
Rok studiów: 1
Semestr: 2
Fizyka (część II)
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
prof. zw. dr hab. Ewa Talik
wykład, konwersatorium
30, 15
obowiązkowy
brak
Treści kształcenia: Termodynamika. Ciepło i temperatura. Zerowa zasada termodynamiki.
Termometria. Rozszerzalność termiczna. Ciepło właściwe. Ciepło przemiany fazowej.
Transport ciepła. Gaz doskonały i gaz rzeczywisty. Molekularne własności materii.
Kinetyczny model gazu doskonałego. Ciepło właściwe gazów i ciał stałych. Fazy materii.
Pierwsza zasada termodynamiki. Praca i energia wewnętrzna. Rodzaje procesów
termodynamicznych. Druga zasada termodynamiki. Silniki cieplne. Cykl Carnota. Entropia.
Elektrostatyka. Budowa materii. Ładunek elektryczny. Przewodniki i izolatory. Prawo
Coulomba. Pole elektryczne. Dipol elektryczny. Prawo Gaussa i jego zastosowania. Klatka
Faradaya. Potencjał elektryczny. Pomiar róŜnicy potencjałów. Lampa Browna. Pojemność.
Energia pola elektrycznego. Dielektryki. Polaryzacja dielektryka. Prąd, opór elektryczny.
Prawo Ohma. Siła elektromotoryczna. Obwody elektryczne. Pole magnetyczne. Magnetyzm
ziemski. Doświadczenie Oersteda. Wzór Lorenza. Prawo Ampera. Strumień magnetyczny.
Prawo Biota – Savarta. Indukcja elektromagnetyczna. Widmo fal elektromagnetycznych.
Równania Maxwella. Natura światła. Dualizm korpuskularno-falowy. Widmo fal
elektromagnetycznych. Współczynnik załamania. Prawa odbicia i załamania. Dyspersja.
Optyka geometryczna. Dyfrakcja i interferencja. Doświadczenie Younga. Siatki dyfrakcyjne.
Polaryzacja. Kąt Brewsrera. Dwójłomność. Elementy fizyki kwantowej. Efekt
fotoelektryczny. Zjawisko Comptona. Materia skondensowana. Elementy fizyki jądrowej.
Definicje wstępne. Rozpady i reakcje jądrowe. Kosmologia. Powstanie i budowa
Wszechświata.
Cele przedmiotu: Przedstawienie podstawowych pojęć z zakresu kursu uniwersyteckiego
z fizyki.
Efekty kształcenia: Po ukończeniu kursu student powinien opanować wiedzę z zakresu
podstawowych pojęć z fizyki, posiadać umiejętność pomiarów podstawowych wielkości
fizycznych, zrozumienia procesów i zjawisk fizycznych w przyrodzie, wykorzystywać prawa
przyrody w technice i Ŝyciu codziennym.
Zalecana literatura:
[1] D. Halliday, R. Resnick, J. Walker, Podstawy Fizyki, tomy 1-5, PWN, 2003.
22
Numer kursu: 0310-3.08.1.010
Numer w siatce studiów: 11
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 3
Rok studiów: 1
Semestr: 2
Podstawy elektrotechniki i elektroniki
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Edward Zorębski
wykład, laboratorium
15, 30
obowiązkowy
brak
Treści kształcenia: Podstawowe pojęcia i jednostki w elektrotechnice, obwody prądu stałego,
źródła energii, prawa Ohma i Kirchoffa, prąd przemienny jednofazowy i trójfazowy, wartości
skuteczne, moc pozorna, czynna, bierna, szeregowe i równoległe połączenie elementów RLC,
pomiary elektryczne napięcia, prądu, rezystancji i konduktancji. Pomiary wielkości
nieelektrycznych: siły, ciśnienia, temperatury, pH, poziomu, i natęŜenia przepływu.
Dokładność przyrządów pomiarowych. Mikroprocesorowe systemy pomiarowe, transmisja
szeregowa. Transformatory: budowa, przeznaczenie, zasada działania, przekładnia, moc
i sprawność. Maszyny elektryczne: silniki prądu stałego i zmiennego, budowa i zasada
działania, regulacja prędkości obrotowej, sprawność. Półprzewodniki, właściwości złącza p-n.
Diody półprzewodnikowe, tranzystory bipolarne i unipolarne, termistory, tyrystory, oraz
diody LED – charakterystyki, właściwości, zastosowanie. Wzmacniacze operacyjne –
podstawowe układy pracy, parametry, zastosowanie, wzmacniacze pomiarowe. Układy
logiczne, bramki, liczniki i multipleksery. Przetworniki A/C i C/A – podstawowe parametry,
sposób przetwarzania, dobór. Układy zasilające. Budowa prostowników i stabilizatorów,
podstawowe rodzaje pracy. Generatory drgań: LC, RC i kwarcowe.
Cele przedmiotu: Zaznajomienie z podstawami elektrotechniki i elektroniki. Przedstawienie
wielkości fizycznych i praw wykorzystywanych do opisu obwodów elektrycznych.
Przedstawienie zasad działania podstawowych maszyn elektrycznych. Poznanie
najpopularniejszych elementów i układów elektronicznych. Prezentacja i poznanie
podstawowych przyrządów do pomiarów podstawowych wielkości elektrycznych
i nieelektrycznych. Zaznajomienie z podstawami techniki mikroprocesorowej.
Efekty kształcenia: Znajomość podstawowych pojęć i praw elektrotechniki i elektroniki.
Umiejętność posługiwania się przyrządami do pomiarów podstawowych wielkości
elektrycznych i nieelektrycznych. Zrozumienie zasad działania podstawowych maszyn
elektrycznych i układów kontrolno-pomiarowych. Umiejętność stosowania elektrycznych
układów napędowych oraz wykorzystania elektronicznych układów pomiarowych
i sterowania.
Zalecana literatura:
[1] Elektrotechnika i elektronika dla nieelektryków, praca zbiorowa, WNT, Warszawa, 2007.
[2] F. Przeździecki, Elektrotechnika i elektronika, PWN, Warszawa, 1986.
[3] M. Krakowski, Elektrotechnika teoretyczna, PWN, Warszawa, 1980.
[4] U. Tietze, C.Schenk, Układy półprzewodnikowe, WNT, Warszawa, 1997.
[5] A. Chwaleba, M. Poniński, A. Siedlecki, Metrologia elektryczna, WNT, Warszawa, 2009.
23
Numer kursu: 0310-3.08.1.004
Numer w siatce studiów: 12
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 1
Rok studiów: 1
Semestr: 1
Grafika inŜynierska
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Tomasz Magdziarz
konwersatorium
15
obowiązkowy
brak
Treści kształcenia: zapoznanie się z normami rysunkowymi, rysowanie figur płaskich,
rysowanie brył, rzuty aksonometryczne, rzuty prostokątne, widoki, przekroje i kłady, zasady
wymiarowania, rysowanie schematyczne urządzeń i aparatów dla przemysłu chemicznego.
Czytanie i rozumienie rysunku techicznego, schematów technologicznych. Elementy grafiki
komputerowej z wykorzystaniem oprogramowania AUTO-CAD, CHEM-CAD.
Cele przedmiotu: zapoznanie studentów z podstawami rysunku technicznego, rozumieniem
i czytaniem rysunku technicznego oraz podstawowymi zastosowaniami grafiki komputerowej.
Efekty kształcenia – umiejętności i kompetencje: czytanie i wykonywanie rysunków
konstrukcyjnych i dokumentacji technicznej; współpraca z technologami, konstruktorami
aparatury chemicznej, projektantami technologii, ciągów technologicznych.
Zalecana literatura:
[1] T. Dobrzański: Rysunek techniczny. WNT, Warszawa, 2000.
[2] T. Winkler: Komputerowy zapis konstrukcji. WNT, Warszawa, 1997.
24
4. Przedmioty z grupy treści kierunkowych
Podstawy technologii chemicznej
Termodynamika techniczna i chemiczna
Podstawy inŜynierii chemicznej i procesowej
Maszynoznawstwo i aparatura przemysłu chemicznego
Technologia chemiczna - surowce i procesy
Automatyka i pomiar wielkości fizykochemicznych
Zarządzanie jakością i produktami chemicznymi
Kataliza i procesy katalityczne
Projektowanie procesów technologicznych
Bezpieczeństwo techniczne
Zielona chemia
Współczesna synteza organiczna i nieorganiczna
Technologie utylizacji i recyklingu odpadów
Materiały dla optoelektroniki
Numer kursu: 0310-3.08.2.011
Numer w siatce studiów: 13
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 1
Semestr: 2
Podstawy technologii chemicznej
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Wojciech Pisarski, prof. UŚ
wykład
30
obowiązkowy
brak
Treści kształcenia: Surowce pierwotne i wtórne, syntezy oparte na surowcach wtórnych,
przemysłowe zastosowanie surowców wtórnych. Gaz syntezowy. Wodór. Alkeny, acetylen,
węglowodory aromatyczne oraz inne surowce wtórne: tlen, azot, chlor. Surowce kopalne:
ropa naftowa i gaz ziemny. Procesy chemiczne i ich podział. Procesy homogeniczne
i heterogeniczne. Podstawy kinetyki reakcji chemicznej w technologii chemicznej. Reakcja
chemiczna i dyfuzja. Typy procesów i operacji w technologii chemicznej: absorpcja,
adsorpcja i desorpcja, odparowanie, sublimacja. Krystalizacja, kondensacja, praŜenie,
rozpuszczanie, destylacja, topienie, rektyfikacja, piroliza, ekstrakcja. Reaktory chemiczne.
Reaktory okresowe (periodyczne) i przepływowe (ciągłe). Modele reaktorów chemicznych.
Wymiana ciepła. Wymiana masy. Mieszanie. rozdrabnianie, filtracja, suszenie. Kataliza
i procesy katalityczne. Katalizatory. Kataliza homogeniczna i heterogeniczna. Schematy
technologiczne. Zasady technologiczne. Zasada wykorzystania surowców. Zasada
wykorzystania energii. Zasada wykorzystania aparatury. Utylizacja odpadów. Ocena jakości
surowców i produktów. Metody i techniki eksperymentalne analizy produktów. Wybrane
zagadnienia technologii materiałów nieorganicznych (kryształy, szkła, ceramika), związków
organicznych, polimerów i kompozytów.
Cele przedmiotu: Przedstawienie podstawowych pojęć technologii chemicznej: surowce
przemysłu chemicznego, procesy technologiczne, kataliza przemysłowa, zasady
technologiczne, schematy technologiczne.
Efekty kształcenia: Po ukończeniu kursu student powinien opanować wiedzę z zakresu
podstawowych pojęć technologii chemicznej w stopniu umoŜliwiającym ocenę realizacji
procesu w skali przemysłowej, dobór optymalnych surowców, kontrolę procesu
technologicznego, stosowanie metod analitycznych oraz określenie jakości produktu.
Zalecana literatura:
[1] E. Grzywa i J. Molenda, Technologia podstawowych syntez organicznych, tomy 1-2, WNT 2008.
[2] K. Schmidt-Szałowski, J. Sentek, J. Raabe, E. Bobryk, Podstawy technologii chemicznej. Procesy
w przemyśle nieorganicznym, Oficyna Wydawnicza Politechniki Warszawskiej, 2005.
[3] J. Pielichowski i A. Puszyński, Technologia tworzyw sztucznych, WNT, 2003.
[4] J. Szarawara i J. Piotrowski, Podstawy teoretyczne technologii chemicznej, WNT, 2010.
[5] B. JeŜowska-Trzebiatowska, S. Kopacz, T. Mikulski, Występowanie i technologia pierwiastków rzadkich,
PWN, Warszawa, 1990.
26
Numer kursu: 0310-3.08.2.025
Numer w siatce studiów: 14
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 6
Rok studiów: 3
Semestr: 5
Termodynamika techniczna i chemiczna
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Marzena Dzida
wykład, konwersatorium
30, 30
obowiązkowy
brak
Treści kształcenia: Molekularny i termodynamiczny sposób wyjaśniania zjawisk
fizykochemicznych. Pojęcia podstawowe i zasady termodynamiki. Procesy odwracalne
i nieodwracalne. Praca objętościowa i nieobjętościowa. Termodynamiczne kryteria
równowagi. Termodynamika roztworów. Wielkości cząstkowe molowe i pozorne.
Termodynamiczna klasyfikacja roztworów: roztwory rzeczywiste, idealne, doskonałe.
Funkcje nadmiarowe. Roztwory atermalne, roztwory regularne. Gaz doskonały. Przemiany
gazu doskonałego. Maszyny cieplne. Gazy rzeczywiste – równania stanu. Współczynnik
kompresji, zasada stanów odpowiadających sobie. Współczynnik Joule’a-Thomsona.
Równowagi fazowe w układach jedno- i wieloskładnikowych. Prawo Clausiusa-Clapeyrona.
Przejścia fazowe I i II rodzaju. Przemiany bez pracy nieobjętościowej i z pracą
nieobjętosciową: prawo działania mas, elektrochemia równowagowa. Izoterma van’t Hoffa,
izobara van Laara – Plancka. Ogniwo w stanie równowagi i pracujące. Modele
termodynamiczne estymacji właściwości substancji.
Cele przedmiotu: Ukazanie termodynamiki jako systemu praw i zaleŜności wynikających
z uogólnienia wyników eksperymentów i obserwacji. Przedstawienie obliczeń
termodynamicznych jako efektywnej drogi uzyskiwania informacji o układach fizycznych
i chemicznych. Zapoznanie z praktycznymi zastosowaniami termodynamiki w chemii.
Efekty kształcenia: Umiejętność zastosowania metody termodynamicznej do określania
kierunku zachodzenia procesów fizycznych i chemicznych. Umiejętność obliczenia efektów
energetycznych reakcji. Posługiwanie się modelami termodynamicznymi w rozwiązywaniu
praktycznych problemów fizykochemicznych.
Zalecana literatura:
[1] H. Buchowski, W. Ufnalski, Podstawy termodynamiki, WNT, Warszawa, 1998.
[2] H. Buchowski, W. Ufnalski, Roztwory, WNT, Warszawa, 1995.
[3] J. Szarawara, Termodynamika chemiczna stosowana, WNT, Warszawa, 1997.
27
Numer kursu: 0310-3.08.2.026
Numer w siatce studiów: 15
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 6
Rok studiów: 3
Semestr: 5
Podstawy inŜynierii chemicznej i procesowej
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr inŜ. Jerzy Raczek
wykład, laboratorium
30, 45
obowiązkowy
brak
Treści kształcenia: Operacje dynamiczne: przepływ płynów, mieszanie, opadanie cząstek
ciał stałych w płynach, filtracja. Operacje cieplne: mechanizmy ruchu ciepła, takie jak:
transport ciepła przez przewodzenie, konwekcję, wnikanie i przenikanie. ZatęŜanie
roztworów w aparatach wyparnych. Operacje dyfuzyjne – prawa dyfuzyjnego ruchu masy.
Destylacja i rektyfikacja. Ekstrakcja. Suszenie. Absorpcja. Adsorpcja. Krystalizacja. Skala
operacji: kilogramowa i wielkotonaŜowa. Podstawy obliczeń do projektowania aparatów,
w skali kilogramowej i wielkotonaŜowej.
Cele przedmiotu: Zapoznanie studentów z podstawowymi operacjami jednostkowymi oraz
zdobycie umiejętności opisu procesów wymiany ciepła i masy w operacjach dyfuzyjnych,
cieplnych i cieplno-dyfuzyjnych. Zapoznają się z problemem powiększania skali procesu
w inŜynierii i technologii.
Efekty kształcenia: Umiejętność opisu przepływów jedno- i wielofazowych płynów
o róŜnych charakterystykach reologicznych w wybranych elementach konstrukcyjnych
aparatury przemysłowej; opisu procesów wymiany ciepła i masy w operacjach
mechanicznych, dyfuzyjnych i cieplno-dyfuzyjnych; wykonywania podstawowych obliczeń
projektowych.
Zalecana literatura:
[1] T. Hobler, Ruch ciepła i wymienniki. WNT, Warszawa 1979.
[2] R. B. Bird, W. E. Stewart, E. N. Lightfoot, Transport Phenomena, John Wiley & Sons, Inc., 2002.
[3] T. Hobler, Dyfuzyjny ruch masy i absorbery, WNT, Warszawa 1976.
[4] D. Basmadjian, Mass Transfer, CRC Press, Boca Raton, London, New York, D.C., 2004.
[5] M. Palica, J. Raczek, Pomoce projektowe z inŜynierii chemicznej i procesowej, Wydawnictwo Politechniki
Śląskiej, Gliwice, 2010.
[6] Z. Ziółkowski, Destylacja i rektyfikacja w przemyśle chemicznym, WNT, Warszawa, 1978.
[7] Cz. Strumiłło, Podstawy teorii i techniki suszenia, WNT, Warszawa, 1983.
[8] T. Malinowskaja, I. Kobrinskij, O. Kirsanow, W. Rejnfart, Rozdzielanie zawiesin w przemyśle chemicznym,
WNT, Warszawa, 1986.
28
Numer kursu: 0310-3.08.2.012
Numer w siatce studiów: 16
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 3
Rok studiów: 1
Semestr: 2
Maszynoznawstwo i aparatura przemysłu chemicznego
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr inŜ. Jerzy Raczek
wykład, konwersatorium
30, 15
obowiązkowy
brak
Treści kształcenia: Elementy stereomechaniki technicznej. Właściwości materiałów
konstrukcyjnych, katalogi materiałów konstrukcyjnych. Elementy maszyn, aparatów
i urządzeń: połączenia, napędy, rurociągi, armatura. Przenośniki. Pompy i spręŜarki.
Urządzenia do rozdrabniania i przesiewania. Mieszalniki. Aparaty do rozdzielania zawiesin.
Wymienniki ciepła. Wyparki. Krystalizatory. Aparaty do destylacji i rektyfikacji. Absorbery.
Adsorbery. Ekstraktory. Suszarki. Filtry. Wirówki. Reaktory. Klasyfikatory. Aparaty
i instalacje stosowane w ochronie środowiska. Aparaty szklane i specjalne do produkcji fine
chemicals w skali kilogramowej. Aparaty do produkcji wielkotonaŜowej.
Cele przedmiotu: Studenci poznają aparaty i urządzenia, w których, w praktyce
przemysłowej realizowana jest produkcja chemiczna. W ramach prowadzonych zajęć studenci
poznają techniki obliczeń aparatów i doboru urządzeń współpracujących w instalacjach
przemysłowych.
Efekty kształcenia: Umiejętność opisu i stosowania operacji jednostkowych w technologiach
chemicznych; opisu i doboru tworzyw konstrukcyjnych stosowanych do budowy aparatury
procesowej; opisu maszyn w aparatach i urządzeniach przemysłowych; doboru aparatów
w ramach projektu procesowego – w skali wielkolaboratoryjnej i technicznej.
Zalecana literatura:
[1] J. Pikoń; Aparatura chemiczna, WNT Warszawa, 1978.
[2] J. Warych; Aparatura chemiczna i procesowa, WNT Warszawa, 2004.
[3] J. Pikoń, Maszynoznawstwo i technika cieplna, Gliwice, 1972.
[4] J. Hehlmann, Aparatura procesów chemicznych, biochemicznych i ochrony środowiska, tom I, Grafika
inŜynierska, Gliwice, 2010.
[5] J. Hehlmann, Aparatura procesów chemicznych, biochemicznych i ochrony środowiska, tom II,
Stereomechanika w budowie aparatów, maszyn i urządzeń procesowych, Gliwice, 2010.
29
Numer kursu: 0310-3.08.2.019
Numer w siatce studiów: 17
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 8
Rok studiów: 2
Semestr: 4
Technologia chemiczna - surowce i procesy
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
prof. zw. dr hab. inŜ. Jarosław Polański
wykład, laboratorium
45, 45
obowiązkowy
brak
Treści kształcenia: Surowce energetyczne i nośniki energii. Surowce pierwotne – węgiel,
ropa naftowa, gaz ziemny, rudy metali, minerały. Surowce roślinne i zwierzęce. Surowce
pouŜytkowe. Wzbogacanie, oczyszczanie, rozdzielanie i płytkie uszlachetnianie surowców.
Przetwarzanie surowców pierwotnych we wtórne. Skojarzona gospodarka surowcami. Proces
chemiczno-technologiczny a reakcja chemiczna. Rozwój metody technologicznej – koncepcja
chemiczna, technologiczna, projekt procesowy. Zasady technologiczne. Analiza
stechiometryczna, termodynamiczna i kinetyczna procesu technologicznego. Bilans masowy
i cieplny procesu. Wybrane schematy technologiczne. Reaktory chemiczne. Podstawowe
procesy jednostkowe w technologii chemicznej: periodyczne, półciągłe, ciągłe, katalityczne,
wysokotemperaturowe, ciśnieniowe. Wybrane procesy technologiczne: przemysłowej syntezy
nieorganicznej i organicznej, elektrochemiczne, otrzymywania materiałów ceramicznych
i cementu, destruktywnego przerobu ropy naftowej, petrochemiczne, lekkiej syntezy,
w zakresie chemii gospodarczej. Materiały specjalne (stosowane w elektronice). Barwniki
i pigmenty. Polimery i tworzywa sztuczne – metody otrzymywania wybranych grup
polimerów. Materiały metaliczne, stopy. Materiały ceramiczne, szkło, spieki. Kompozyty.
Nanomateriały. Rozwój zrównowaŜonych, energooszczędnych, materiałooszczędnych,
małoodpadowych lub bezodpadowych technologii.
Cele przedmiotu: Studenci poznają najwaŜniejsze surowce chemiczne, metody ich
uszlachetniania i przekształcania; najwaŜniejsze procesy jednostkowe i metody ich łączenia
w rzeczywistych technologiach. Poznają najnowsze trendy w technologii chemicznej.
Efekty kształcenia: Umiejętność opisu surowców stosowanych w technologii chemicznej
i materiałów; doboru odpowiednich surowców dla danej produkcji (z uwzględnieniem stopnia
czystości); stosowania surowców pouŜytkowych; posługiwania się wiedzą chemiczną
i techniczną w ocenie moŜliwości realizacji procesu w skali technologicznej; opracowania,
realizacji i kontroli procesu technologicznego; doboru surowców dla uzyskania:
oczekiwanego produktu, materiałów polimerowych, metalicznych i ceramicznych oraz ich
identyfikacji; określania właściwości fizyko-chemicznych, mechanicznych i termicznych
materiałów; stosowania tworzyw sztucznych, materiałów metalicznych i ceramicznych;
postępowania z odpadami; stosowania przyjaznych środowisku technologii.
Zalecana literatura:
[1] E. Grzywa, J. Molenda, Technologia podstawowych syntez organicznych, WNT, W-wa, 2000.
[2] Praca zbiorowa, „Surowce przemysłu chemicznego”, skrypt Politechniki Śląskiej, 2005.
[3] K. Schmidt-Szałowski, J. Setek, J. Raabe, E. Bobryk, Podstawy technologii chemicznej. Procesy
w przemyśle nieorganicznym, Oficyna Wydawnicza Pol. Warszawskiej, 2004.
[4] J. Kępiński, Technologia chemiczna nieorganiczna, PWN, W-wa, 1985.
30
Numer kursu: 0310-3.08.2.020
Numer w siatce studiów: 18
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 4
Rok studiów: 2
Semestr: 4
Automatyka i pomiar wielkości fizykochemicznych
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Edward Zorębski
wykład, laboratorium
15, 30
obowiązkowy
brak
Treści kształcenia: Podstawowe pojęcia metrologiczne. Błędy pomiarów ich klasyfikacja.
Niepewność pomiarów. Opracowanie błędów pomiarowych. Metody pomiarowe:
bezpośrednie i pośrednie. Przetworniki pomiarowe: własności statyczne i dynamiczne.
Mierniki analogowe i cyfrowe. Przetworniki A/C i C/A. Pomiary wielkości nieelektrycznych:
pomiary ciśnienia, temperatury, natęŜenia przepływu, poziomu, lepkości, składu oraz pH.
Systemy komputerowe w pomiarach, karty zbierania danych, interfejsy i oprogramowanie.
Akwizycja danych pomiarowych z wykorzystaniem systemu: komputer – karta wejść-wyjść;
wykorzystanie środowiska LabView. Rys historyczny rozwoju automatyki, stan obecny,
perspektywy. Podstawowe pojęcia automatyki. Przekształcenie Laplace’a i jego zastosowanie
w automatyce. Struktury układów sterowania. Modelowanie matematyczne systemów
dynamicznych. Funkcje przejścia, charakterystyki czasowe i częstotliwościowe
podstawowych obiektów dynamicznych. Kryteria stabilności. Regulatory: rodzaje (P, I, PI,
PID), jakość regulacji, dokładność statyczna, jakość dynamiczna. Regulatory liniowe
i nieliniowe. Dobór regulatorów: regulacja dwu- i trójpołoŜeniowa, regulacja kaskadowa.
Synteza układów regulacji. Dobór nastaw regulatorów – metoda Zieglera-Nicholsa. Układy
regulacji nadąŜnej, programowanej i stałowartościowej. Układy automatycznej regulacji:
ciśnienia, temperatury, przepływu i poziomu. Elementy wykonawcze. Sterowanie obiektem
z wykorzystaniem systemu: komputer – karta wejść-wyjść.
Cele przedmiotu: Uzyskanie wiedzy z zakresu metrologii pomiarów wielkości
fizykochemicznych i aparatury kontrolno-pomiarowej w przemyśle chemicznym.
Zaznajomienie z zasadami akwizycji danych z wykorzystaniem układów: komputer – karta
wejść-wyjść. Uzyskanie wiedzy w zakresie podstaw automatyki przemysłowej, sterowania
obiektów i optymalizacji technologicznych układów złoŜonych w przemyśle chemicznym.
Efekty kształcenia: Opanowanie podstaw metrologii i umiejętność doboru przyrządów do
prowadzenia pomiarów wielkości nieelektrycznych. Znajomość podstawowych pojęć
z zakresu automatyki i sterowania obiektów. Umiejętność stosowania aparatury kontrolnopomiarowej oraz korzystania z układów regulacji w przemyśle chemicznym. Umiejętność
wykorzystania automatyki przemysłowej do sterowania obiektów oraz procesami
technologicznymi. Umiejętność wykorzystania komputerowych systemów akwizycji danych.
Zalecana literatura:
[1] M. Miłek, Metrologia elektryczna wielkości nieelektrycznych, Oficyna Wydawnicza
Zielonogórskiego, Zielona Góra, 2006.
[2] A. Urbaniak, Podstawy automatyki, Wydawnictwo Politechniki Poznańskiej, Poznań, 2004.
[3] S. Węgrzyn, Podstawy automatyki, PWN, Warszawa, 1978.
Uniw.
31
Numer kursu: 0310-3.08.2.033
Numer w siatce studiów: 19
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 2
Rok studiów: 3
Semestr: 6
Zarządzanie jakością i produktami chemicznymi
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Sławomir Michalik
seminarium
30
obowiązkowy
podstawy technologii chemicznej
Treści kształcenia: Poziom, jakości, elementy i modele systemów jakości: TQM, Kaizen,
system zarządzania jakością wg ISO 9001, zintegrowany system zarządzania jakością,
środowiskiem i bezpieczeństwem pracy. Działania techniczne, organizacyjne, ekonomiczne
i motywacyjne w zakresie jakości: reengineering i TQM, wdraŜanie systemu jakości, koszty
jakości, komunikacja w zarządzaniu jakością, nagrody jakości. Jakość w zarządzaniu
produkcją: wymagania normy ISO 9001, QFD – projektowanie sterowane przez klienta,
SPC-statystyczne sterowanie procesami (ang. statistical process control). Odpowiedzialność
producenta za cykl Ŝycia produktu, odpowiedzialność za produkt (ustawa WE), oznakowanie
CE, przepisy prawa obowiązujące na terenie Polski, konsekwencje i odpowiedzialność za
produkt wg prawa karnego, odpowiedzialność producenta chemikaliów. Regulacje prawne
w zakresie zarządzania chemikaliami (karta charakterystyki, recykling, utylizacja
chemikaliów) – programy realizowane przez przemysł chemiczny w tym zakresie: przepisy
prawne obowiązujące w zakresie zarządzania chemikaliami, klasyfikacja chemikaliów,
modele zarządzania obrotem chemikaliami (producenci, dystrybutorzy, uŜytkownicy).
Klasyfikacja materiałów niebezpiecznych, REACH. Magazynowanie chemikaliów.
Cele przedmiotu: Zapoznanie z modelami systemów zarządzania jakością, regulacjami
prawnymi w zakresie zarządzania produktami chemicznymi, programami zarządzania
jakością i chemikaliami realizowanymi w przemyśle oraz zasadami bezpieczeństwa
w zakresie magazynowania chemikaliów. Celem nauczania przedmiotu jest poznanie
podstawowych zasad zarządzania produkcją z uwzględnieniem wymagań w zakresie jakości
oraz bezpiecznego stosowania, i magazynowania.
Efekty kształcenia: Po ukończeniu kursu student powinien opanować podstawową zasady
i metody oceny systemów zarządzania jakości w firmie ze szczególnym uwzględnieniem firm
branŜy chemicznej. Umieć klasyfikować materiały niebezpieczne, znać przepisy prawne
obowiązujące na terenie Polski a dotyczące obrotu chemikaliami.
Zalecana literatura:
[1] A. Hamrol i W. Mantura, Zarządzanie jakością. Teoria i praktyka, PWN, Warszawa, 2009.
[2] S. Zapłata, Zarządzanie jakością w przedsiębiorstwie. Ocena i uwarunkowania skuteczności, Wydawnictwo
Wolters Kluwer Polska, 2009.
[3] M. śemigała, Jakość w systemie zarządzania przedsiębiorstwem, wyd. I, Warszawa, 2008.
[4] Materiały Krajowego Centrum Informacyjnego Reach; http://reach.gov.pl/
32
Numer kursu: 0310-3.08.2.021
Numer w siatce studiów: 20
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 6
Rok studiów: 2
Semestr: 4
Kataliza i procesy katalityczne
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
prof dr hab. inŜ. Stanisław Krompiec
wykład, laboratorium
30, 45
obowiązkowy
brak
Treści kształcenia: Kataliza i katalizatory – definicje podstawowe. Katalizator a inhibitor
i inicjator reakcji. Kataliza homogeniczna i heterogeniczna. Pierwiastki i związki chemiczne
jako katalizatory reakcji chemicznych (metale, metale na nośnikach, tlenki metali, kwasy
i zasady Lewisa i Bronsteda, super-kwasy i super-zasady, katalizatory przeniesienia
międzyfazowego, kompleksy metali, enzymy, koenzymy i inne). Kataliza w układach
biologicznych: fotosynteza, oddychanie, wiązanie azotu, synteza biocząsteczek
w organizmach Ŝywych, enzymy jako biokatalizatory. Wybrane procesy przemysłowe
z udziałem katalizatorów – aspekty chemiczne i inŜynierskie. Katalizatory w syntezie
farmaceutyków; synteza asymetryczna, przekształcenia asymetryczne. Katalizatory
w ochronie środowiska: katalizatory samochodowe, znaczenie selektywnych układów
katalitycznych. Chemo-, regio- i stereoselektywność reakcji z udziałem katalizatorów.
Mechanizmy reakcji katalitycznych – homo- i heterogenicznych; analiza wybranych reakcji
homo- i heterogenicznych. Projektowanie katalizatorów: metody obliczeniowe, screening
układów katalitycznych, planowanie. Zalety i wady katalizy homo- i heterogenicznej;
immobilizacja katalizatorów homogenicznych. Kompleksy metali jako katalizatory reakcji –
struktura a aktywność katalityczna. Reaktory do procesów katalitycznych – przykłady;
procesy kontaktowe, przykłady.
Cele przedmiotu: Kataliza jest jedną z najwaŜniejszych dziedzin współczesnej nauki
i technologii. Celem przedmiotu jest ukształtowanie u studentów świadomości znaczenia
katalizy – dla procesów biologicznych, dla technologii chemicznej, dla technologii
materiałowej i dla ochrony środowiska naturalnego. Studenci powinni poznać: podstawy
fizyko-chemiczne procesów katalitycznych, mechanizmy wybranych reakcji, niektóre procesy
przemysłowe z udziałem katalizatorów.
Efekty kształcenia: Po ukończeniu kursu student powinien mieć świadomość znaczenia
procesów katalitycznych dla róŜnych dziedzin nauki i techniki oraz Ŝycia biologicznego na
Ziemi; znać najwaŜniejsze procesy katalityczne – z obszaru biokatalizy, katalizy
przemysłowej (homo- i heterogenicznej), umieć zrealizować w laboratorium proste reakcje
katalityczne i zaplanować katalizator do wybranych, niezbyt złoŜonych reakcji chemicznych.
Zalecana literatura:
[1] F. Pruchnik, Kataliza homogeniczna, PWN, W-wa 1993.
[2] Katalog Firmy STREM, 2009-2011.
[3] E. Grzywa, J. Molenda, Technologia podstawowych syntez organicznych, WNT, W-wa, 2000.
[4] M. Benaglia, Recoverable and Recyclable Catalysts, Wiley, 2009.
[5] K. Schmidt-Szałowski, J. Setek, J. Raabe, E. Bobryk, Podstawy technologii chemicznej. Procesy
w przemyśle nieorganicznym, Oficyna Wydawnicza Pol. Warszawskiej, 2004.
33
Numer kursu: 0310-3.08.2.027
Numer w siatce studiów: 21
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 3
Rok studiów: 3
Semestr: 5
Projektowanie procesów technologicznych
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr inŜ. Jerzy Raczek
wykład, laboratorium
15, 30
obowiązkowy
brak
Treści kształcenia: Projektowanie operacji jednostkowych w technologii nieorganicznej
i organicznej, łączenie elementów w linie i ciągi technologiczne, zasady projektowania
aparatury chemicznej; zasady doboru wymienników ciepła, wymienników masy oraz
urządzeń przetłaczających. Bilanse masowe oraz cieplne. Projektowanie fragmentów
technologii, łączenie fragmentów w instalacje. Dobór urządzeń i aparatury do określonej
wielkości produkcji. Projektowanie małych i wielkotonaŜowych technologii.
Cele przedmiotu: Wykonanie projektu technologii, np. produkcji saletry amonowej lub
etylobenzenu o określonej zdolności produkcyjnej; umiejętność zaplanowania niezbędnej
aparatury, umiejętność współpracy ze specjalistami z inŜynierii chemicznej, technologami,
specjalistami zajmującymi się aparaturą chemiczną.
Efekty kształcenia: W oparciu o indywidualne dane projektowe studenci powinni obliczyć
wielkość reaktora, dobrać wielkość innych niezbędnych aparatów i urządzeń, takich jak
wymienniki ciepła, krystalizator, wirówka, suszarka oraz wykonać bilans masowy, cieplny
technologii i szkic schematu technologicznego.
Zalecana literatura:
[1] M. Serwiński, Zasady inŜynierii chemicznej i procesowej, WNT, Warszawa, 1982.
[2] S. Michałowski, K. Wańkowicz, Termodynamika procesowa, WNT, Warszawa, 1993.
[3] M. Palica, J. Raczek, Pomoce projektowe z inŜynierii chemicznej i procesowej, Wydawnictwo Politechniki
Śląskiej, Gliwice 2010.
[4] K. Schmidt-Szałowski, J. Sentek, Podstawy technologii chemicznej. Organizacja procesów produkcyjnych,
Oficyna Wydawnicza Pol. Warszawskiej, 2001.
[5] L. Synoradzki (red.), J. Wisialski (red.), Projektowanie procesów technologicznych. Od laboratorium do
instalacji przemysłowej, Oficyna Wydawnicza Pol. Warszawskiej, 2006.
34
Numer kursu: 0310-3.08.2.028
Numer w siatce studiów: 22
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 1
Rok studiów: 3
Semestr: 5
Bezpieczeństwo techniczne
Wykładowca:
dr Sławomir Michalik
seminarium
Typ zajęć:
Liczba godzin:
15
Przedmiot:
obowiązkowy
Wymagania wstępne: podstawy technologii chemicznej
Treści kształcenia: Analiza mechanizmu powstawania zagroŜeń chemicznych. Rodzaje, typy
i identyfikacja zagroŜeń chemicznych. Stan prawny w zakresie przeciwdziałania zagroŜeniom
w przemyśle ze szczególnym uwzględnieniem przemysłu chemicznego. Niezawodność.
WspółzaleŜności między niezawodnością a zagroŜeniem technicznym. Czas Ŝycia instalacji.
Bezpośrednie przyczyny powstawania szkód, mechanizm powstawania szkód Organizacja
słuŜb przeciwdziałania i zwalczania skutków powaŜnych awarii. Organizacja systemu
wczesnego ostrzegania i alarmowania. Obowiązki jednostek gospodarczych w zakresie
przeciwdziałania powaŜnym awariom. Charakterystyka ryzyka w procesach przemysłowych
ze szczególnym uwzględnieniem przemysłu chemicznego. Zarządzanie ryzykiem
przemysłowym. Bezpieczeństwo w przemyśle chemicznym. Raporty bezpieczeństwa
instalacji. Sumaryczne koszty bezpieczeństwa technicznego. Wpływ inŜynierii
bezpieczeństwa technicznego na rozwój i kształtowanie postępu w technice.
Cele przedmiotu: Opanowanie przez studentów zagadnień związanych z róŜnymi aspektami
bezpieczeństwa pracy, ze szczególnym uwzględnieniem przemysłu chemicznego, w tym
problematykę zagroŜeń występujących w przemyśle, charakterystykę i oceną ryzyka.
Efekty kształcenia: Student po ukończeniu kursu rozumienie podstawowe zagadnienia
z zakresu inŜynierii bezpieczeństwa. Stosuje aparat matematyczny do opisu zagadnień
związanych z zagroŜeniem technicznym i bezpieczeństwem technicznym (oblicza ryzyko),
potrafi przygotować raport bezpieczeństwa instalacji.
Zalecana literatura:
[1] W. Pihowicz, InŜynieria bezpieczeństwa technicznego. Problematyka podstawowa, WNT, 2008.
[2] M. Ryng, Bezpieczeństwo techniczne w przemyśle chemicznym, Poradnik, WNT, Warszawa, 1985.
[3] Ochrona pracy - zbiór przepisów. Techniczne bezpieczeństwo pracy - Wybór przepisów, Tom III Ośrodek
Szkolenia PIP, Wrocław, 2007.
[4] Bezpieczeństwo i higiena pracy przy stosowaniu substancji i preparatów niebezpiecznych Ośrodek Szkolenia
PIP, Wrocław, 2007.
35
Numer kursu: 0310-3.06.2.034
Numer w siatce studiów: 23
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 8
Rok studiów: 3
Semestr: 6
Zielona chemia
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Beata Zawisza
wykład, laboratorium
30, 60
obowiązkowy dla specjalności Zielona chemia i czyste technologie
podstawy chemii, chemia analityczna, nieorganiczna, organiczna
Treści kształcenia: ZałoŜenia, cele i zasady zielonej chemii. Istota zrównowaŜonego
ekorozwoju. Otrzymywanie produktów na bazie surowców ze źródeł odnawialnych.
Produkcja biopaliw a takŜe metody pozwalające na ich analizę i kontrolę. Analityka
procesowa w czasie rzeczywistym. Techniki zielonej chemii analitycznej. Miniaturyzacja
urządzeń i integracja systemów analitycznych. Alternatywne technologie i metody syntezy
chemicznej zapobiegające skaŜeniu środowiska. Metody ograniczające zuŜycie
niebezpiecznych związków chemicznych. Kierunki rozwoju nowoczesnych metod
prowadzenia reakcji chemicznych wykorzystujących m. in. katalizę, elektrochemię,
fotochemię, mikrofale. Nowe media reakcyjne. Płyny w stanie pod- i nadkrytycznym, ciecze
jonowe. Sposoby degradacji. Sposoby zapewnienia właściwego poziomu bezpieczeństwa
chemicznego.
Cele przedmiotu: Zdobycie wiedzy na temat metod oszczędnego przetwarzania surowców
naturalnych, racjonalnego wykorzystania naturalnych źródeł energii, redukcji emisji
zanieczyszczeń do środowiska oraz syntezy bezpiecznych produktów i procesów
bezpiecznych dla człowieka i środowiska naturalnego.
Efekty kształcenia: Po ukończeniu kursu student powinien opanować podstawową wiedzę
z zakresu zielonej chemii i zrównowaŜonego rozwoju. Powinien posiadać wystarczającą
orientację, co do istoty zastosowania surowców odnawialnych do produkcji chemikaliów,
wyeliminowania rozpuszczalników lub zastąpienia związków z grupy VOC tanimi
i bezpiecznymi mediami reakcyjnymi, bezrozpuszczalnikowych metod przygotowania próbek
do analizy, a takŜe technik zielonej chemii analitycznej. Student powinien posiadać
umiejętność określenia wydajności zaprojektowanych procesów w ramach czystej chemii.
Powinien być zorientowany w nowoczesnych metodach wykorzystujących zminimalizowane
zintegrowane systemy chemiczne m. in. mikroekstrakcję i przyspieszoną ekstrakcję.
Zalecana literatura:
[1] B. Burczyk, Zielona chemia, zarys, Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław, 2006.
[2] J.H. Clark i D.J. Maequarrie, Handbook of Green Chemistry and Technology, Wiley-Blackwell, 2002.
36
Numer kursu: 0310-3.07.2.035
Numer w siatce studiów: 23
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 8
Rok studiów: 3
Semestr: 6
Współczesna synteza organiczna i nieorganiczna
Wykładowca:
prof dr hab. inŜ. Stanisław Krompiec
Typ zajęć:
wykład, laboratorium
Liczba godzin:
30, 60
Przedmiot:
obowiązkowy dla specjalności Technologia nieorganiczna i organiczna
Wymagania wstępne: brak
Treści kształcenia: Regio- i stereoselektywna synteza związków organicznych, w tym
farmaceutyków. Nowoczesne reagenty i katalizatory w syntezie organicznej. Reakcje
utleniania, hydrogenacji, epoksydacji, sprzęgania, cykloaddycji. Synteza związków
chiralnych: indukcja asymetryczna, chiralne katalizatory do syntezy asymetrycznej. Związki
metali przejściowych, kompleksy metali, związki lito-, boro- i krzemoorganiczne w syntezie
organicznej. Związki koordynacyjne jako substraty i katalizatory w syntezie organicznej
i nieorganicznej. Fullereny i ich pochodne: synteza i zastosowania. Organiczne
i nieorganiczne związki metali do celów technologii elektronowej. Związki koordynacyjne
i nieorganiczne jako substraty i katalizatory reakcji chemicznych. Elementy chemii
bionieorganicznej.
Cele przedmiotu: Zapoznanie studentów z kierunkami rozwoju współczesnej syntezy
organicznej i nieorganicznej; pokazanie wspólnych dla obu tych dziedzin obszarów (synteza
organiczna z udziałem związków nieorganicznych, metaloorganicznych i koordynacyjnych
jako substratów i katalizatorów).
Efekty kształcenia: Studenci uzyskują umiejętność planowania syntezy związków
organicznych i nieorganicznych; umiejętność analizowania za pomocą współcześnie
dostępnych technik określania struktury budowę i czystość syntezowanych preparatów;
potrafią znajdywać informacje na temat właściwości i metod syntezy związków organicznych,
nieorganicznych, koordynacyjnych, metaloorganicznych.
Zalecana literatura:
[1] J. Gawroński, K. Gawrońska, K. Kacprzak, M. Kwit, Współczesna synteza organiczna, PWN, W-wa, 2004.
[2] Katalog Firmy STREM, część: „Metal catalysts for organic synthesis”, 2009-2011.
[3] J. SkarŜewski, Wprowadzenie do syntezy organicznej, PWN, W-wa, 1999.
[4] K. Schmidt-Szałowski, J. Setek, J. Raabe, E. Bobryk, Podstawy technologii chemicznej. Procesy
w przemyśle nieorganicznym, Oficyna Wydawnicza Pol. Warszawskiej, 2004.
37
Numer kursu: 0310-3.06.2.043
Numer w siatce studiów: 24
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 4
Semestr: 7
Technologie utylizacji i recyklingu odpadów
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr inŜ. Joanna Pisarska
wykład
30
obowiązkowy dla specjalności Zielona chemia i czyste technologie
brak
Treści kształcenia: Gospodarka odpadami w Polsce. Sytuacja prawna w zakresie gospodarki
odpadami. Aspekty ekonomiczne gospodarki odpadami. Podstawowe pojęcia: odpady,
utylizacja odpadów, recykling. Zapobieganie powstawaniu odpadów. Rodzaje recyklingu.
Termiczna utylizacja odpadów. Ogólna charakterystyka układów rozproszonych i metod
oczyszczania cieczy. Mechaniczne procesy oczyszczania cieczy. Filtracja wgłębna,
powierzchniowa oraz flotacja. Koagulacja i flokulacja. Biologiczne metody oczyszczania
cieczy. Chemiczne metody oczyszczania ścieków. Adsorpcyjne metody oczyszczania
ścieków. Procesy membranowe. Technologie odpylania gazów przemysłowych. Oczyszczanie
gazów z zanieczyszczeń gazowych. Unieszkodliwianie odpadów przemysłowych w procesie
spalania. Technologie odsiarczania spalin. Metody chemiczne i fizyczne unieszkodliwiania
i usuwania odpadów. Stabilizacja osadów ściekowych.
Cele przedmiotu: celem przedmiotu jest przedstawienie problematyki szeroko rozumianej
ochrony środowiska i zagospodarowania odpadów przemysłowych oraz przekazanie
podstawowej wiedzy dotyczącej znanych obecnie i stosowanych powszechnie technologii
utylizacji i recyklingu odpadów powstających w róŜnych gałęziach przemysłowych,
szczególnie uciąŜliwych dla środowiska naturalnego.
Efekty kształcenia: po ukończeniu kursu student powinien opanować wiedzę z zakresu
ochrony środowiska i podstawowych pojęć dotyczących powtórnego wykorzystania
i unieszkodliwiania róŜnego rodzaju odpadów. W szczególności powinien posiadać orientację
w zakresie stosowanych technologii utylizacji i recyklingu przemysłowych zanieczyszczeń
w stanie stałym, ciekłym lub gazowym.
Zalecana literatura:
[1] W. Anigacz i E. Zakowicz, Ochrona środowiska, Wydawnictwo Politechniki Opolskiej, Opole, 2003.
[2] J. Boć, K. Nowacki, E. Samborska-Boć, Ochrona środowiska, Kolonia Limited, Wrocław, 2005.
[3] Z. Brodecki i in., Ochrona środowiska, LexisNexis, Warszawa, 2005.
[4] J. Jendrośka, M. Bar, Prawo ochrony środowiska – podręcznik, Centrum Prawa Ekologicznego, Wrocław,
2005.
[5] K. Górka, B. Poskrobko, W. Kadecki, Ochrona środowiska - problemy społeczne, ekonomiczne i prawne,
PWE, Warszawa, 2001.
[6] C. Rosik-Dulewska, Podstawy gospodarki odpadami, PWN, Warszawa, 2005.
[7] J. Bentkowski, Logistyka odpadów, Wydawnictwo Politechniki Śląskiej, Gliwice, 2002.
38
Numer kursu: 0310-3.07.2.044
Numer w siatce studiów: 24
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 4
Semestr: 7
Materiały dla optoelektroniki
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Wojciech Pisarski, prof. UŚ
wykład
30
obowiązkowy dla specjalności Technologia nieorganiczna i organiczna
brak
Treści kształcenia: Materiały oraz technologie optyczne i optoelektroniczne. Rodzaje
materiałów optycznych i ich zastosowanie w technice. Absorpcja i emisja światła.
Fluorescencja i fosforescencja. Kinetyka zaniku luminescencji. Przepuszczalność światła
ośrodków optycznych. Odbicie światła od powierzchni optycznej. Współczynnik załamania
światła. Procesy promieniste i niepromieniste. Procesy niepromienistego przekazywania
energii wzbudzenia. Konwersja promieniowania podczerwonego na światło widzialne. Wstęp
do fizyki i chemii laserów. Materiały i technologie laserowe. Emisja spontaniczna i emisja
wymuszona. Akcja laserowa. Zasada działania lasera. Kryształy laserowe. Lasery jako źródła
światła w spektroskopii. Nieorganiczne szkła optyczne i fotoniczne. Transparentne układy
szklano-ceramiczne. Technologie otrzymywania. Materiały i technologie światłowodowe.
Budowa i zasada działania światłowodu. Włókna światłowodowe. Tłumienność światła.
Zastosowanie w telekomunikacji (wzmacniacze optyczne, okna telekomunikacyjne w zakresie
podczerwieni). Materiały oraz technologie organiczne i polimerowe. Przykłady związków
organicznych i polimerów luminescencyjnych. Fotoluminescencja i elektroluminescencja.
Diody typu LED i OLED. Diody półprzewodnikowe. Ceramiki, proszki, związki
kompleksowe. Materiały domieszkowane jonami lantanowców i metali przejściowych.
Cele przedmiotu: Celem przedmiotu jest przedstawienie zagadnień dotyczących klasycznych
i zaawansowanych materiałów optycznych i optoelektronicznych. W szczególności zakres
przedmiotu obejmuje poznanie zjawisk absorpcji i emisji światła w róŜnych ośrodkach
amorficznych i krystalicznych, procesów promienistych i niepromienistych, określenie
właściwości optycznych materiałów decydujących o potencjalnych moŜliwościach
zastosowania jako źródła laserowe w zakresie widzialnym i w podczerwieni, światłowody,
wzmacniacze optyczne, przetworniki promieniowania podczerwonego na światło widzialne,
diody typu LED i OLED.
Efekty kształcenia: Po ukończeniu kursu student powinien opanować wiedzę na temat
struktury i właściwości materiałów optycznych oraz obszaru ich zastosowań.
Zalecana literatura:
[1] A. Szwedowski, Materiałoznawstwo optyczne i optoelektroniczne, WNT, 1996.
[2] K. Booth, S. Hill, Optoelektronika, Wydawnictwa Komunikacji i Łączności, Warszawa 2001.
[3] K. Shimoda, Wstęp do fizyki laserów, PWN, 1993.
[4] W. Demtroder, Spektroskopia laserowa, PWN, 1993.
[5] G. Einarsson, Podstawy telekomunikacji światłowodowej, Wydawnictwa Komunikacji i Łączności,
Warszawa, 1998.
5. Przedmioty z grupy innych wymagań
Przedmiot interdyscyplinarny
Technologia informacyjna
Informacja naukowa
Metody obliczeniowe w chemii
Planowanie i optymalizacja eksperymentu
Chemometria w kontroli procesów technologicznych
Projekt technologiczny
Projekt inŜynierski
Seminarium inŜynierskie
Numer kursu: 0310-3.08.3.029 i 037
Numer w siatce studiów: 27
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 2 + 2
Rok studiów: 3
Semestr: 5 i 6
Przedmiot interdyscyplinarny
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
wykład
30
obowiązkowy/obieralny z puli 4 wykładów
brak
Proponowane tematy wykładów:
1. Filozofia,
2. Ekonomia i zarządzanie przedsiębiorstwem,
3. Wprowadzenie do marketingu,
4. Prawo własności intelektualnej.
41
Numer kursu: 0310-3.08.3.006
Numer w siatce studiów: 28
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 2
Rok studiów: 1
Semestr: 1
Technologia informacyjna
Prowadzący:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
personel Zakładu Chemii Teoretycznej
laboratorium
45
obowiązkowy
brak
Treści kształcenia: Podstawy: dane, przetwarzanie danych, algorytmy, języki
programowania, obliczenia numeryczne i symboliczne. Systemy komputerowe: organizacja
i funkcjonowanie, komputery osobiste. Oprogramowanie: klasyfikacja, systemy operacyjne
i oprogramowanie systemowe, narzędziowe i uŜytkowe, aplikacje uŜytkownika. Dane:
organizacja, zagadnienia wymiany i udostępniania, pliki i systemy plikowe, bazy danych i ich
eksploracja. Technologie sieciowe: organizacja i funkcjonowanie sieci komputerowych,
typowe usługi sieciowe, zagroŜenia bezpieczeństwa. Typowe oprogramowanie uŜytkowe:
aplikacje sieciowe, edytory i procesory tekstów, arkusze kalkulacyjne, aplikacje bazodanowe,
aplikacje do przygotowywania grafiki prezentacyjnej i publikacji, narzędzia programisty.
Cele przedmiotu: Przedstawienie najbardziej istotnych zagadnień z zakresu technologii
informacyjnej, ze szczególnym uwzględnieniem ich dalszego praktycznego zastosowania.
Dyskusja bieŜących problemów związanych z prezentowanymi zagadnieniami.
Wprowadzenie do efektywnego wykorzystania systemów komputerowych i sieciowych.
Efekty kształcenia: Wiedza odnośnie najbardziej istotnych zagadnień z zakresu technologii
informacyjnej. Rozumienie problematyki związanej z tymi zagadnieniami. Podstawowe
umiejętności w zakresie efektywnego wykorzystania systemów komputerowych i sieciowych.
Zalecana literatura:
[1] A. Kisielewicz, Wprowadzenie do informatyki, Helion, 2002.
[2] A.S. Tanenbaum, Strukturalna organizacja systemów komputerowych, wyd. 5, Helion 2006 (wersja
oryginalna: Structured Computer Organization, 5th Ed., Pearson Education Inc. 2006).
[3] B.K. Williams, Using Information Technology, 7th Ed., Career Education, 2007.
[4] dokumentacja wykorzystywanego oprogramowania
42
Numer kursu: 0310-3.08.3.038
Numer w siatce studiów: 29
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 1
Rok studiów: 3
Semestr: 6
Informacja naukowa
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Tomasz Magdziarz
konwersatorium
15
obowiązkowy
brak
Treści kształcenia: Zasady dokumentacji i raportowania badań naukowych. Dokumentacja
naukowo-techniczna. Rodzaje literatury chemicznej. Literatura źródłowa. Patenty. Prawa
autorskie. Opis patentowy i jego elementy. Znany stan wiedzy. ZastrzeŜenie patentowe.
Wzory Markusha. Publikacje naukowe. Literatura bibliograficzna. Chemische Zentralblatt.
Encyklopedia związków organicznych Beilsteins Handbuch der Organischen Chemie.
Encyklopedia związków nieorganicznych i metaloorganicznych Gmelins Handbuch der
anorganischen chemie. Chemical Abstracts Service (CAS). System indeksowania CAS.
Specyfika danych chemicznych. Bazy danych. Przeszukiwanie baz danych. Sposoby
kodowania cząsteczek chemicznych. Wzór cząsteczkowy i strukturalny. Edytory molekularne.
System baz danych discoverygate. Chemiczna baza danych crossfire Beilstein. Crossfire
Gmelin. Bazy patentów. Patent Chemistry Database. System baz danych pubmed
(www.ncbi.nlm.nih.gov/pubmed/). Katalogi związków chemicznych jako encyklopedie
danych chemicznych (www.sigmaaldrich.com). Bazy danych Science Citation Index. Journal
Citation Report. ISI Web of Knowledge. Scopus. ScienceDirect. Inne internetowe zasoby
danych naukowych. Wykorzystanie Google Book Search do przeszukiwania ksiąŜkowej
literatury chemicznej. Wykorzystanie księgarni internetowych (np. Amazon.com) do
przeszukiwania ksiąŜkowej literatury chemicznej. Katalogi bibliotek polskich. Zasoby ksiąŜek
i czasopism. Metody zamawiania literatury chemicznej z bibliotek krajowych
i międzynarodowych. Prawne uwarunkowania wykorzystania literatury obcej we własnych
badaniach naukowych. Kontekstowe przeszukiwanie baz danych chemicznych. Zasady
formułowania zapytań do baz danych. Poszukiwania faktów, związków, reakcji, metod
syntezy.
Cele przedmiotu: Przedstawienie podstawowej literatury źródłowej, bibliograficznej oraz baz
danych w zakresie chemii.
Efekty kształcenia: Po ukończeniu kursu student powinien posiadać wiedzę na temat
zasobów literaturowych w zakresie chemii i technologii chemicznej oraz posiadać praktyczne
umiejętności ich wykorzystania, w szczególności formułowania prostych i kontekstowych
zapytań do baz danych.
Zalecana literatura:
[1] MDL, materiały do nauki online, http://www.mdl.com/solutions/videos.
[2] J. March, Chemia organiczna, WNT, Warszawa, 1975.
[3] Beilstein Crossfire, materiały pomocnicze online.
43
Numer kursu: 0310-3.08.3.039
Numer w siatce studiów: 30
Forma zaliczenia przedmiotu: egzamin
Język: polski/angielski
Punkty ECTS: 5
Rok studiów: 3
Semestr: 6
Metody obliczeniowe w chemii
Prowadzący:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
prof. zw. dr hab. Stanisław Kucharski
wykład, laboratorium
15, 30
obowiązkowy
brak
Treści kształcenia: Metody obliczeniowe oparte na mechanice klasycznej. Podstawy
mechaniki molekularnej. Pola siłowe. Energia potencjalna w funkcji długości wiązań oraz
wielkości kątów płaskich. Człony harmoniczne i anharmoniczne. Oddziaływania van der
Waalsa, potencjał Lennarda-Jonesa. Oddziaływania elektrostatyczne, człony torsyjne, funkcja
zaleŜności energii potencjalnej od wartości kąta torsyjnego. Ogólna postać energii cząsteczki
w funkcji połoŜenia jąder. Poszukiwanie stabilnych konfiguracji cząsteczki: wiązanie
rozrywalne i nierozrywalne. Potencjały Morse'a. Dynamika molekularna oparta na
równaniach Newtona. Metody obliczeniowe wywodzące się z metod chemii kwantowej.
Podstawy mechaniki kwantowej. Dualizm korpuskularno-falowy. Hipoteza de Broglie’a. Fale
materii. Zasada nieoznaczoności Heisenberga, wielkości sprzęŜone: pęd - połoŜenie, energia czas. Teoria Bohra budowy atomu wodoru. Równanie Schroedingera. Atom wodoru.
Wartości własne i funkcje własne. Funkcja falowa dla pojedynczego elektronu. Spin, orbitale
i spinorbitale. Atomy wieloelektronowe. Zabudowa elektronowa atomu, powłoki,
podpowłoki,
konfiguracje
elektronowe.
Termy
atomowe.
Podstawy
metod
kwantowochemicznych: zasada i metoda wariacyjna. Metoda Ritza. PrzybliŜenie
jednoelektronowe. Funkcje jednoelektronowe w atomach i cząsteczkach. Pojęcie energii
korelacji. Wiązanie chemiczne, orbitale i spinorbitale molekularne. Cząsteczka wodoru. Idea
metody Hartree-Focka. Hybrydyzacja orbitali atomowych, cząsteczki wieloatomowe, bazy
funkcyjne, przykłady obliczeń kwantowochemicznych. Metody półempiryczne i metody
ab initio. Klasyfikacja metod półempirycznych. Schemat iteracyjny w metodach
półempirycznych. Podstawy metody funkcjonałów gęstości (DFT). Twierdzenia HohenbergaKohna. Funkcjonał i potencjał korelacyjno-wymienny. Równania Kohn-Shama jako
odpowiednik równań Hartree-Focka przy zastąpieniu członu wymiennego przez potencjał
korelacyjno-wymienny.
Cele przedmiotu: Zapoznanie studenta z podstawowymi pojęciami chemii obliczeniowej,
przedstawienie najwaŜniejszych moŜliwości wykorzystania metod mechaniki molekularnej
i chemii kwantowej do opisu struktury i własności cząsteczek chemicznych. Metody
kwantowo-chemiczne w zastosowaniu do opisu zjawisk spektroskopowych.
Efekty kształcenia: Student powinien rozumieć i stosować podstawowe pojęcia i metody
chemii obliczeniowej, umieć wyjaśnić strukturę elektronową cząsteczek organicznych
i nieorganicznych, wykonać proste obliczenia dotyczące struktury i własności cząsteczek.
Zalecana literatura:
[1] L. Piela, Idee chemii kwantowej, PWN, Warszawa, 2004.
[2] D.O. Hayword, Mechanika kwantowa dla chemików’, PWN, Warszawa, 2006.
44
Numer kursu: 0310-3.08.3.045
Numer w siatce studiów: 31
Forma zaliczenia przedmiotu: zaliczenie
Język: polski/angielski
Punkty ECTS: 2
Rok studiów: 4
Semestr: 7
Planowanie i optymalizacja eksperymentu
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Ivana Stanimirova-Daszykowska
wykład, laboratorium
15, 15
obowiązkowy
chemometria w kontroli procesów technologicznych
Treści kształcenia: Cel metod planowania eksperymentów w technologii chemicznej. Kroki
planowania eksperymentu. Strategie optymalizacji eksperymentu. Funkcja odpowiedzi
układu. Kodowanie czynników. Rodzaje odpowiedzi układów, które podlegają optymalizacji.
Rodzaje planów eksperymentów. Regresja liniowa. Współczynniki regresji. Współczynnik
korelacji. Regresja wieloraka. Ograniczenia zastosowań regresji wielorakiej. Plan kompletny
eksperymentu. Macierz planu. Ocena efektów czynników i ich interakcji. Idea ułamkowego
planu selekcyjnego i praktyczne zastosowanie. Macierz planu. Przykład planu połowa 23. Plan
Placketta i Burmana. Główne zastosowania. Zastosowania planów trójpoziomowych.
Centralny plan kompozycyjny. Rodzaje planów kompozycyjnych. RóŜne kryteria
optymalności planów. D-optymalność. Zalety planu Doehlerta. Plany mieszanin i ich
zastosowanie. Wprowadzenie do zagadnień optymalizacji: poszukiwanie minimum w
przedziale, metoda optymalizacji wielowymiarowej sympleks Neldera-Meada, techniki
gradientowe, podejście Pareto, wybrane strategie optymalizacji złoŜonych procesów
przemysłowych, przykłady zastosowań.
Cele przedmiotu: Zapoznanie studentów z podstawowymi zagadnieniami dotyczącymi
planowania i optymalizacji eksperymentu.
Efekty kształcenia: Umiejętność wyboru odpowiedniej metodyki planowania eksperymentu
w zaleŜności od problemu badawczego i jej zastosowanie w praktyce.
Zalecana literatura:
[1] M. Korzyński, Metodyka eksperymentu, WNT, Warszawa, 2006.
[2] J. Kusiak, A. Danielewska-Tułecka i P. Oprocha, Optymalizacja, Wydawnictwo Naukowe PWN, Warszawa,
2009.
[3] D.C. Montgomery, Design and analysis of experiments, John Wiley & Sons, Arizona, USA, 2005.
[4] L. Eriksson, E. Johansson, N. Kettaneh-Wold, C. Wikström i S. Wold, Design of experiments, 3rd edition,
Umetrics Academy, Umeå, Sweden, 2008.
45
Numer kursu: 0310-3.08.3.030
Numer w siatce studiów: 32
Forma zaliczenia przedmiotu: zaliczenie
Język: polski/angielski
Punkty ECTS: 4
Rok studiów: 3
Semestr: 5
Chemometria w kontroli procesów technologicznych
Wykładowca:
prof. zw. dr hab. Beata Walczak
wykład, laboratorium
Typ zajęć:
Liczba godzin:
30, 30
Przedmiot:
obowiązkowy
Wymagania wstępne: podstawy technologii chemicznej, matematyka
Treści kształcenia: Chemometria jako nauka. Idea kontroli procesów technologicznych oraz
metodologia. Natura danych pochodzących z kontroli procesu technologicznego. Statystyczna
kontrola procesów – SPC (ang. statistical process control): podejście jednoparametrowe do
kontroli procesów (karty kontrolne Shewarta, CUMSUM, EWMA); podejście
wieloparametrowe (wieloparametrowe karty bazujące na testach Hotellinga T2 i χ2, karty
CUMSUM i EWMA); wartości progowe dla kart kontrolnych. Wprowadzenie do kontroli
procesów w oparciu o modele z tzw. „ukrytymi” zmiennymi. Analiza czynników głównych
(PCA). Metoda częściowych najmniejszych kwadratów (PLS). Wieloparametrowe karty
kontrolne w przestrzeni ukrytych zmiennych. Praktyczne rozwaŜania: dane modelowe,
sprawdzanie jakości danych procesowych, eksploracja i analiza danych. Ciągła kontrolna
procesu - tryb „on-line”. Modele adaptacyjne. Trajektorie procesu. Kontrola serii procesów
(ang. batch process control). Przykłady zastosowań chemometrii do kontroli procesów
technologicznych (np. produkcja nylonu, proces fermentacji). Modelowanie danych serii
procesowych oraz synchronizacja ich profili czasowych. Inne zagadnienia związane
z modelowaniem danych z kontroli procesów.
Cele przedmiotu: Zapoznanie studentów z podstawowymi metodami statystycznymi
stosowanymi do kontroli procesów oraz podejściami chemometrycznymi, opartych na
konstrukcji tzw. „ukrytych” zmiennych.
Efekty kształcenia: Student po ukończeniu kursu rozumienie podstawowe zagadnienia
z zakresu statystycznej i chemometrycznej kontroli procesów technologicznych od strony
teoretycznej i praktycznej. Jest świadom roli metod kontroli procesów technologicznych i zna
obszary ich zastosowań.
Zalecana literatura:
[1] T. Kourti, Multivariate statistical process control and process control, using latent variables, w S.D. Brown,
R. Tauler i B. Walczak (Eds.), Comprehensive chemometrics, tom 4, Elsevier, 2009, pp. 21-54.
[2] S. Wold, N. Kettaneh-Wold, J.F. MacGregor i K.G. Dunn, Batch process modeling and MSPC,
w S.D. Brown, R. Tauler i B. Walczak (Eds.), Comprehensive chemometrics, tom 2, Elsevier, 2009,
pp. 163-197.
[3] R.G. Brereton, Chemometrics: data analysis for the laboratory and chemical plant, John WIley & Sons,
Chichester, 2003.
[4] D.L. Massart, B.G.M. Vandeginste, L.M.C. Buydens, S. de Jong, P.J. Lewi, J. Smeyers-Verbeke, Handbook
of Chemometrics and Qualimetrics; Part A, Elsevier, Amsterdam, 1997.
[5] B.G.M. Vandeginste, D.L. Massart, L.M.C. Buydens, S. de Jong, P.J. Lewi, J. Smeyers-Verbeke, Handbook
of Chemometrics and Qualimetrics; Part A, Elsevier, Amsterdam, 1998.
46
Numer kursu: 0310-3.08.3.041
Numer w siatce studiów: 34
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 5
Rok studiów: 3
Semestr:6
Projekt technologiczny
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr inŜ. Joanna Pisarska
wykład, konwersatorium
15, 30
obowiązkowy
brak
Treści kształcenia: Zasady projektowania technologii chemicznych, projektowanie operacji
jednostkowych, ciągi technologiczne; zasady projektowania i doboru wymienników ciepła,
wymienników masy oraz urządzeń przetłaczających. Bilanse masowe oraz cieplne.
Projektowanie fragmentów technologii, łączenie fragmentów w instalacje. Dobór urządzeń
i aparatury do określonej wielkości produkcji.
Cele przedmiotu: Wykonanie fragmentu instalacji chemicznej; np do uzdatniania wody;
umiejętność współpracy ze specjalistami z inŜynierii chemicznej, technologami, specjalistami
zajmującymi się aparaturą chemiczną.
Efekty kształcenia: W oparciu o indywidualne dane projektowe studenci powinni obliczyć
podstawowe wymiary adsorbera, opory przepływu przez adsorber, dobrać średnicę
wewnętrzną płaszcza wymiennika ciepła, liczbę i średnicę rurek oraz obliczyć opory
przepływu wody przez wymiennik. Obliczyć i dobrać moc silnika pompy wirowej, oraz
wykonać szkic układu pompowego.
Zalecana literatura:
[1] M. Serwiński, Zasady inŜynierii chemicznej i procesowej. WNT, Warszawa, 1982.
[2] S. Michałowski i K. Wańkowicz, Termodynamika procesowa. WNT, Warszawa, 1993.
[3] M. Palica i J. Raczek, Pomoce projektowe z inŜynierii chemicznej i procesowej, Wydawnictwo Politechniki
Śląskiej, Gliwice, 2010.
47
Numer kursu: 0310-3.08.3.048
Numer w siatce studiów: 36
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 10
Rok studiów: 4
Semestr:7
Projekt inŜynierski
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
opiekun projektu inŜynierskiego
laboratorium
120
obowiązkowy
dopuszczenie do realizacji pracy dyplomowej
Treści kształcenia: Cele przedmiotu: Zajęcia mają na celu realizację indywidualnych konsultacji studentów
z opiekunami projektów inŜynierskich. Kształtowanie umiejętności samodzielnej pracy,
a takŜe pracy zespołowej wraz ze studentami, którzy realizują zbliŜoną tematykę badawczą.
Efekty kształcenia: Student posiada umiejętności samodzielnej pracy, potrafi wspierać się
literaturą fachową w codziennych badaniach.
48
Numer kursu: 0310-3.08.3.049
Numer w siatce studiów: 37
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 5
Rok studiów: 4
Semestr:7
Seminarium inŜynierskie
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
kierownicy Zakładów, w których realizowany jest projekt
seminarium
30
obowiązkowy
dopuszczenie do realizacji pracy dyplomowej
Treści kształcenia: Tematyka zajęć obejmuje zagadnienia związane z technologią chemiczną
oraz zasady pisania projektów inŜynierskich. Przedmiot jest realizowany w oparciu
o elementy samokształcenia (referaty seminaryjne, dyskusja) pod kierunkiem samodzielnego
pracownika naukowego.
Cele przedmiotu: Przygotowanie studentów do realizacji projektu inŜynierskiego oraz
przygotowanie do egzaminu dyplomowego.
Efekty kształcenia: Student posiada znajomość zasad przygotowania pracy dyplomowej, zna
źródła informacji naukowej i potrafi sprawnie wyszukiwać informacje związane z tematyką
swojej pracy.
Zalecana literatura:
[1] J. Weiner, Technika pisania i prezentowania przyrodniczych prac naukowych, Wydawnictwo Naukowe
PWN, Warszawa, 2009.
49
6. Pula proponowanych przedmiotów obieralnych
wspólnych dla dwóch specjalności
Zielona chemia i czyste technologie
oraz Technologia nieorganiczna i organiczna
w semestrze 5:
1. Ratownictwo techniczne i chemiczne lub
2. Zarządzanie środowiskiem
w semestrze 6:
Ochrona środowiska w technologii chemicznej
50
Numer kursu: 0310-3.08.3.055
Numer w siatce studiów: 33
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 2
Rok studiów: 3
Semestr:5
Ratownictwo techniczne i chemiczne
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Sławomir Michalik
wykład
30
obieralny
podstawy technologii chemicznej
Treści kształcenia: Sprzęt ochrony dróg oddechowych: ogólny podział sprzętu; rodzaje
i warunki uŜycia pochłaniaczy przemysłowych; budowa twarzowej maski p-gazowej; aparaty
oddechowe – rodzaje i typy, działanie i budowa. Podział ubrań chemoodpornych; kryteria
odporności chemicznej i rodzaje materiałów ubraniowych; fizjologiczne normy pracy
w odzieŜy gazoszczelnej. Działanie przyrządów do wykrywania substancji chemicznych
w powietrzu; podział czujników i działanie; jednostki pomiarowe i wzajemne relacje
pomiędzy nimi; wykonywanie pomiarów eksplozymetrycznych i stęŜeń toksycznych;
czynniki wpływające na wynik pomiaru. Zestaw pompowy. Przeznaczenie i dobór pomp
zaleŜnie od substancji i warunków pompowania. Sprzęt i materiały uszczelniające; doraźne
uszczelnienia. Zwalczanie rozlewów olejowych na gruncie i wodzie (środki do neutralizacji,
rozpuszczalniki i dyspergenty, materiały sorpcyjne). Istota spalania i jego rodzaje; inicjatory
zapłonu; pojęcia dotyczące zapoczątkowania procesu spalania: granice wybuchowości,
temperatura i grupy samozapalenia, klasy temperaturowe sprzętu, temperatura i klasy
niebezpieczeństwa poŜarowego cieczy palnych; spalanie deflagracyjne i detonacja mieszanin
paliwowo-powietrznych; ogólna ocena zagroŜenia poŜarowego substancji; metody wtórnej
ochrony p. poŜ. w sytuacjach awarii; taktyka zespołów ratowniczych. Definicja zagroŜenia,
awarii chemicznej i nadzwyczajnego zagroŜenia środowiska; zagroŜenia w przemyśle
chemicznym: toksyczne, poŜarowe i zagroŜenia wybuchem; rozprzestrzenianie się i zasięg
zagroŜeń w środowisku; zaleŜność sytuacji taktycznej od zasięgu zagroŜenia – skala
zagroŜenia. Zjawiska fizyczne zachodzące podczas emisji i rozprzestrzeniania się substancji
niebezpiecznych. Rodzaje wypływu gazów z uszkodzonych zbiorników magazynowych lub
transportowych. Jakościowy opis powstawania gazowych chmur wybuchowych. Wpływ
czynników meteorologicznych i fizjograficznych na zasięg chmury gazowej w przyziemnej
warstwie atmosfery. Zasady prowadzenia działań ratowniczych: hierarchia zadań, zasady
bezpieczeństwa i kierowania. Organizacja i prowadzenie działań ratowniczych, rozpoznania,
ewakuacji, ubezpieczenia poŜarowego, rozpraszania chmur gazowych, awaryjnych
przeładunków i doraźnych uszczelnień. Dekontaminacja sprzętu w strefie skaŜonej.
Efekty kształcenia: po ukończeniu kursu student powinien być przygotowany do
prawidłowego działania w sytuacji awarii chemicznej oraz do udziału w akcji ratowniczej.
Student powinien znać podstawowy sprzęt ochronny, sprzęt rozpoznania zagroŜenia oraz
sprzęt i materiały do zwalczania zagroŜeń.
Zalecana literatura:
[1] A. Wojnarowski Podstawy ratownictwa chemicznego. "Firex". Zakład Wydawnictw i Szkolenia Fundacji
Rozwoju Ochrony PrzeciwpoŜarowej.
[2] J. Konieczny, J. Ranecki Ratownictwo chemiczno-medyczne, Garmond, Poznań, 2007.
[3] M. Kowalczyk, S. Rump, Z. Kołaciński Medycyna katastrof chemicznych Wydawnictwo PZWL, 2004.
51
Numer kursu: 0310-3.08.3.056
Numer w siatce studiów: 33
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 2
Rok studiów: 3
Semestr: 5
Zarządzanie środowiskiem
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Edyta Sierka
wykład
30
obieralny
brak
Treści kształcenia: Teoria organizacji i zarządzania - pojęcie i funkcje systemu zarządzania.
Sterowanie i zarządzanie środowiskiem. Źródła finansowania ochrony środowiska. Ogólny
model systemu zarządzania i obiektu zarządzającego Wybrane relacje międzysystemowe.
Prawno-polityczne instytucje systemu zarządzania środowiskowego. Organizacja systemu
i narzędzia zarządzania środowiskowego.
Proekologiczne systemy zarządzania
w przedsiębiorstwach. Strategia Czystszej Produkcji jako podstawa systemu zarządzania
środowiskowego. System zarządzania środowiskowego według norm międzynarodowych:
ISO 4001, EMAS. Etapy wdraŜania SZŚ. Polityka środowiskowa organizacji. Program
zarządzania środowiskowego. Systemy Zarządzania Środowiskowego i wybrane elementy ich
oceny. Certyfikacja i doskonalenie systemów zarządzania na wybranych przykładach.
Cele przedmiotu: Zapoznanie z zakresem zarządzania środowiskiem na róŜnych poziomach
organizacji, rodzajami systemów zarządzania środowiskowego oraz wymaganiami w ich
wdraŜaniu.
Efekty kształcenia: Student powinien znać terminologię z zakresu zarządzania środowiskiem
i zarządzania środowiskowego oraz wymogi dotyczące dokumentacji wymaganej w ramach
poszczególnych systemach zarządzania środowiskowego oraz zasad ich wdraŜania
i doskonalenia.
Zalecana literatura:
[1] T. Borys i P. Rogala (red.), T. Brzozowski, P. Skowron, Piekiełek. Piekiełek, D. Bobik, Systemy zarządzania
jakością i środowiskiem, Wydawnictwo Akademii Ekonomicznej we Wrocławiu, Wrocław, 2007.
[2] A. Carretero, Environmental aspects. Identification and evaluation, wyd. 2nd, Environmental Expert, Madryt,
2007.
[3] M. Kramer, M. Urbaniec, A. Kryński, Międzynarodowe zarządzanie środowiskiem, t. 2., Wydawnictwo C.H.
Beck, 2005.
[4] W. Nierzwicki, Zarządzanie środowiskowe, Polskie Wyd. Ekonomiczne, Warszawa, s. 159, 2006.
[5] Z. Nowak (red.), Zarządzanie środowiskiem, Wydawnictwo Politechniki Śląskiej, Gliwice, 2001.
[6] B. Poskrobko (red.), Zarządzanie środowiskiem. Praca zbiorowa. Polskie Wydawnictwo Ekonomiczne.
s. 327, 2007.
[7] PN-EN 14001, Systemy Zarządzania Środowiskowego-specyfikacja i wytyczne stosowania. PKN,
Warszawa, 2005.
52
Numer kursu: 0310-3.06.3.058
Numer w siatce studiów: 33
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 2
Rok studiów: 3
Semestr: 6
Ochrona środowiska w technologii chemicznej
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Edyta Sierka
wykład
30
obieralny
ogólna wiedza z zakresu technologii chemicznej
Treści kształcenia: Racjonalne gospodarowanie zasobami środowiska przyrodniczego.
koncepcje ograniczoności zasobów naturalnych. Idea zrównowaŜonego rozwoju. Najlepsze
dostępne techniki BAT i efekty ich wdraŜania. LCA – ocena cyklu Ŝycia. Ekoznakowanie,
wymogi prawne w przemyśle chemicznym. Międzynarodowy Program „Odpowiedzialność
i troska”. Optymalizacja procesów technologii chemicznej w celu zmniejszenia ryzyka
związanego z zanieczyszczeniem środowiska. Kodeks dobrych praktyk laboratoryjnych
(GLP). Zasady i priorytety „zielonej chemii”.
Cele przedmiotu: Uświadomienie oddziaływania przemysłu chemicznego na elementy
środowiska przyrodniczego i wskazanie praktycznych działań mających na celu jego
zminimalizowanie.
Efekty kształcenia: Po ukończeniu kursu student powinien znać podstawowe wymogi
prawne z zakresu ochrony środowiska, metody oceny oddziaływania przemysłu chemicznego
na elementy środowiska oraz działania globalne i regionalne prowadzące do ograniczania
negatywnego wpływu na środowisko.
Zalecana literatura:
[1] R. Paczuski. Ochrona środowiska, BRANTA, 2008.
[2] J. Ciechanowicz-McLean, Prawo i polityka ochrony środowiska, Wolters Kluwer Polska – OFICYNA, 2009.
[3] Rozporządzenie Ministra Zdrowia z dnia 4 czerwca 2003 r. w sprawie kryteriów, które powinny spełniać
jednostki organizacyjne wykonujące badania substancji i preparatów chemicznych, oraz kontroli spełnienia tych
kryteriów (Dz. U. z 2003 r. Nr 116, poz. 1103).
[4] E. Białecka-Florjańczyk i J. Włostowska, Chemia organiczna, Wydawnictwa Naukowo-Techniczne WNT,
rozdz. 14, 2007.
53
7. Przedmioty obieralne dla poszczególnych specjalności
Biomateriały i biotechnologie
Laboratorium na chipie
Technologie zgazowania węgla
Transport materiałów niebezpiecznych
Analiza chemiczna procesów
Otrzymywanie odczynników o wysokiej czystości
54
Numer kursu: 0310-3.06.3.057
Numer w siatce studiów: 33
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 7
Rok studiów: 3
Semestr: 6
Biomateriały i biotechnologie
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Wojciech Pisarski, prof. UŚ
wykład
30
obieralny dla specjalności Zielona chemia i czyste technologie
brak
Treści kształcenia: Biomateriały - definicje i kryteria jakości. Podział biomateriałów:
metaliczne, ceramiczne, polimerowe, węglowe, kompozytowe. Cechy biomateriałów.
Biopolimery. Implanty - podstawowe pojęcia. Biotolerancja implantu. Testowanie implantów.
Funkcje biomateriałów. Kryteria jakości biomateriałów. Projektowanie implantów. Próby
kwalifikacyjne implantów. Klasyfikacja urządzeń medycznych. Przykłady implantów.
Biotolerancja implantów polimerowych: czynniki wpływające na proces degradacji
polimerów, reakcja tkankowa na obecność implantu. Wpływ środowiska biologicznie
aktywnego na implanty polimerowe. Mechanizm degradacji implantów polimerowych.
Produkty degradacji implantów. Podatność na degradację. Reakcja tkankowa na obecność
biomateriału polimerowego. Procesy zachodzące podczas wgajania się implantu. Ideał
biotolerancji. Materiały bioceramiczne - podział, zalety, problemy. Tworzywa oparte
o fosforany wapnia. Ceramika tlenkowa i węglanowa. Cementy kostne i stomatologiczne.
Bioaktywne szkła i materiały szklano-ceramiczne. Ceramika hydroksyapatytowa.
Technologie otrzymywania bioceramiki. Biomateriały otrzymywane metodą zol-Ŝel,
technologia otrzymywania, formy, techniki pokrywania. Nanobiomateriały. Biomateriały dla
fotoniki. Biomateriały dla medycyny.
Cele przedmiotu: Celem przedmiotu jest przedstawienie wiedzy dotyczącej biomateriałów.
Zostaną omówione podstawowe definicje, kryteria podziału i funkcje biomateriałów oraz
technologie ich otrzymywania.
Efekty kształcenia: Po ukończeniu kursu student powinien poznać biomateriały, wymagania
stawiane tym materiałom, kryteria ich doboru oraz zastosowania.
Zalecana literatura:
[1] J. Marciniak, Biomateriały, Wydawnictwo Politechniki Śląskiej, Gliwice, 2002.
[2] J. Marciniak, Biomateriały w chirurgii kostnej, Wydawnictwo Politechniki Śląskiej, Gliwice, 1992.
[3] D. Sęk i A. Włochowicz, Polimery i biopolimery, Wydawnictwo Politechniki Łódzkiej, Filia w BielskuBiałej, Bielsko-Biała, 1996.
55
Numer kursu: 0310-3.06.3.059
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: zaliczenie
Język: polski/angielski
Punkty ECTS: 3
Rok studiów: 4
Semestr: 7
Laboratorium na chipie
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Michał Daszykowski
wykład
30
obieralny dla specjalności Zielona chemia i czyste technologie
brak
Treści kształcenia: Podstawy miniaturyzacji procesów laboratoryjnych. Idee zielonej chemii
i ich realizacja poprzez miniaturyzację procesów i systemów pomiarowych.
Mikroelektromechaniczne systemy. Systemy całościowej analizy w skali mikro.
Mikrofluidyka i cyfrowa mikrofluidyka. Laboratorium na chipie. InŜynieria i podstawy
konstrukcji jednostek analitycznych i implementacji procesów na chipie. Podstawowe
problemy związane z miniaturyzacją procesów (zjawiska przepływu cieczy, zjawiska
powierzchniowe). Zagadnienia związane z transportem substancji. Przykładowe procesy
chemiczne realizowane na chipie. Kompletne systemy analizy – praktyczne zastosowania.
Metodyka walidacji jednostki – podejście analityczne.
Cele przedmiotu: Zapoznanie studentów z podstawowymi zagadnieniami dotyczącymi idei
konstrukcji i realizacji procesów za pomocą laboratorium na chipie.
Efekty kształcenia: Po ukończeniu kursu student powinien posiąść podstawową wiedzę
w zakresie konstrukcji laboratoriów na chipie; znać zalety i wady tego typu jednostek.
Zalecana literatura:
[1] Gazeta Lab on a chip, RCS Publishing.
56
Numer kursu: 0310-3.06.3.060
Numer w siatce studiów: 33
Forma zaliczenia przedmiotu: zaliczenie
Język: polski/angielski
Punkty ECTS: 2
Rok studiów: 4
Semestr: 7
Technologie zgazowania węgla
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Adam Smoliński
wykład
30
obieralny dla specjalności Zielona chemia i czyste technologie
brak
Treści kształcenia: Definicja paliw; paliwa kopalne. Parametry fizyko-chemiczne węgla
istotne z punktu widzenia procesu zgazowania. Zgazowanie/spalanie węgla. Termodynamika
procesu zgazowania węgla. Współczesne technologie zgazowania węgla. Technologie
zgazowania ukierunkowane na otrzymywanie gazu bogatego w wodór. Zgazowanie węgla
w złoŜu fluidalnym z uŜyciem sorbentu wapniowego. Technologie przyszłościowe produkcji
energii elektrycznej i wodoru z wychwytywaniem CO2 w oparciu o systemy IGCC.
Podziemne zgazowanie węgla. Reaktywność jako parametr charakteryzujący węgiel
w procesie zgazowania. Definicja reaktywności i jej charakterystyka. Porównanie
stosowanych na świecie metod badania reaktywności. Ocena oddziaływania i minimalizacja
szkodliwego wpływu na środowisko systemów produkcji energii elektrycznej i wodoru
w procesie zgazowania węgla w zakresie emisji gazów cieplarnianych.
Cele przedmiotu: Zapoznanie studentów z podstawowymi zagadnieniami dotyczącymi
technologii zgazowania węgla.
Efekty kształcenia: Po ukończeniu kursu student powinien znać podstawy procesu
zgazowania węgla w tym zgazowania węgla ukierunkowanego na otrzymywanie nowego
przyjaznego środowisku nośnika energii – wodoru. Student powinien równieŜ posiąść wiedzę
na temat stosowanych na świecie technologii zgazowania węgla w tym systemów IGCC
połączonych z wychwytywaniem CO2 oraz metod oceny przydatności danego paliwa do
procesu zgazowania.
Zalecana literatura:
[1] J. Szuba, L. Michalik, Karbochemia – Zarys rozwoju, Wydawnictwo Śląsk, Katowice, 1983.
[2] T. Borowiecki, J. Kijeński, J. Machnikowski i M. ŚciąŜko, Czysta energia, produkty chemiczne i paliwa z
węgla – ocena potencjału rozwojowego, Zabrze, IChPW, 2008.
57
Numer kursu: 0310-3.07.3.066
Numer w siatce studiów: 33
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 2
Rok studiów: 3
Semestr: 6
Transport materiałów niebezpiecznych
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Sławomir Michalik
wykład
30
obieralny dla specjalności Technologia nieorganiczna i organiczna
brak
Treści kształcenia: Informacje ogólne o towarach niebezpiecznych (co to są towary
niebezpieczne, przepisy regulujące transport towarów niebezpiecznych, struktura przepisów
ADR), karta charakterystyki i klasyfikacja towarów niebezpiecznych, zwolnienia i wyłączenia
z przepisów ADR, ochrona towarów niebezpiecznych, dokumentacja wymagana podczas
przewozu towarów niebezpiecznych, wymagania wobec kierowców, wymagania wobec
pojazdów (oznakowanie, budowa, wyposaŜenie, badania). Zabezpieczanie ładunku. Zasady
ruchu drogowego przy przewozie towarów niebezpiecznych (tunele). Postępowanie
w sytuacjach awaryjnych, Przewóz towarów niebezpiecznych w sztukach przesyłki
(pakowanie i oznakowanie), przewóz towarów niebezpiecznych luzem, przewóz towarów
niebezpiecznych w cysternach, przewozy materiałów wybuchowych, przewozy materiałów
radioaktywnych, przewóz kombinowany, kontrola przewozu towarów niebezpiecznych.
Cele przedmiotu: Zapoznanie studentów z podstawowymi zagadnieniami dotyczącymi
transportu materiałów niebezpiecznych.
Efekty kształcenia: po ukończeniu kursu student powinien znać podstawowe zasady
transportu substancji niebezpiecznych; umieć tworzyć pisemne instrukcje dla kierowcy,
potrafić dokonać oceny zgodności realizacji przewozu z wymaganiami określonymi
w ustawie i umowie ADR.
Zalecana literatura:
[1] B. Madej, P. śakowski, R. Madej, Przewozy towarów niebezpiecznych - ADR 2009-2011, ATP, Warszawa.
[2] M. RóŜycki, Bezpieczny transport towarów niebezpiecznych, Wydawnictwo Marek RóŜycki, ISBN: 978-83924640-6-8
[3] Gospodarowanie odpadami i substancjami niebezpiecznymi, Praca zbiorowa pod redakcją A. Tabora, Tom I,
Ustawodawstwo, składowanie odpadów, transport towarów niebezpiecznych, dokumentacja, Politechnika
Krakowska.
58
Numer kursu: 0310-3.07.3.067
Numer w siatce studiów: 33
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 3
Rok studiów: 4
Semestr:7
Analiza chemiczna procesów
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Rafał Sitko
wykład
30
obieralny dla specjalności Technologia nieorganiczna i organiczna
brak
Treści kształcenia: Zastosowanie idei analityki chemicznej w celu kontroli i monitorowania
przebiegu reakcji chemicznych i procesów na potrzeby róŜnych gałęzi przemysłu. Główne
zadania i wyzwania analityki procesowej. Techniki analityczne i techniki analizy
instrumentalnej, które znajdują zastosowania do kontroli przebiegu procesu i reakcji
chemicznych. Badanie i kontrola reakcji na skalę przemysłową i w laboratorium. Popularne
narzędzia detekcji: spektroskopia w bliskiej podczerwieni, IR, Ramana, UV, sensory
i biosensory. Próbkowanie procesu. Pomiar analityczny w środowisku reakcji in situ oraz
w ciągu technologicznym, pomiar na odległość. Analityka procesowa i chemometria.
Akustyczna kontrola procesu technologicznego.
Cele przedmiotu: Zapoznanie studentów z podstawowymi zagadnieniami dotyczącymi
metodyki analizy chemicznej procesów.
Efekty kształcenia: Po ukończeniu kursu student powinien posiąść podstawową wiedzę
w zakresie kontroli procesów technologicznych z zastosowaniem podejść analitycznych.
Zalecana literatura:
[1] W. Szczepaniak, Metody instrumentalne w analizie chemicznej, Wydawnictwo Naukowe PWN, Warszawa,
2008.
[2] K.A. Bakeev, Process analytical technology, Blackwell Publishing Ltd, Oxford, 2005.
59
Numer kursu: 0310-3.07.3.068
Numer w siatce studiów: 33
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 3
Rok studiów: 4
Semestr: 7
Otrzymywanie odczynników o wysokiej czystości
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Beata Zawisza
wykład
30
obieralny dla specjalności Technologia nieorganiczna i organiczna
podstawy chemii
Treści kształcenia: Klasyfikacja odczynników. Odczynniki wysokiej czystości i ich
zastosowanie. Ich wartość rynkowa i znaczenie praktyczne. Nowoczesne techniki analityczne
wykorzystujące odczynniki specjalnej czystości. Nowe technologie i metody syntezy
organicznej i nieorganicznej związków wysokiej czystości. Instalacje do produkcji związków
w tym rozpuszczalników o najwyŜszych parametrach. Wytrącanie cząstek tworzących proszki
wysokiej czystości wykorzystywane jako leki, pigmenty, katalizatory, materiały
magnetyczne. Zaawansowane technologie oczyszczania odczynników. Aparatura
laboratoryjna do oczyszczania odczynników. Metody oczyszczania odczynników
m. in. rekrystalizacja, sublimacja, destylacja. Woda wysokiej czystości. Techniki filtracji
wody. Techniki rozdziału substancji. Badanie procesów membranowego rozdzielania
w procesach ekstrakcji, destylacji, absorpcji oraz filtracji w tym ultrafiltracji, mikrofiltracji
i osmozy odwróconej. Kierunki rozwoju nowoczesnych metod prowadzenia reakcji
chemicznych wykorzystujących odczynniki specjalnej czystości.
Cele przedmiotu: Zdobycie wiedzy na temat metod otrzymywania w tym syntezy związków
chemicznych o wysokiej czystości i oczyszczania odczynników chemicznych. Uzyskanie
wiedzy na temat znaczenia i wykorzystania związków specjalnej czystości.
Efekty kształcenia: Po ukończeniu kursu student powinien opanować podstawową wiedzę z
zakresu technologii otrzymywania reagentów wysokiej czystości. Powinien znać metody
oczyszczania odczynników w tym metody rozdziału chemicznego. Powinien posiadać
wystarczającą orientację, co do istoty zastosowania surowców specjalnej czystości. Student
powinien posiadać umiejętność określenia wydajności procesów syntezy i oczyszczania
substancji. Powinien być zorientowany w nowoczesnych technikach wykorzystujących
odczynniki specjalnej czystości.
Zalecana literatura:
[1] W.L.F. Armarego, C.L.L. Chai, Purification of laboratory chemicals, Butterworth-Heinemann, Oxford, 2009.
[2] Yu.A. Zolotov, N.M. Kuzmin, Preconcentration of trace elements Elsevier, Amsterdam, 1990.
[3] J. Minczewski, J. Chwastowska, R. Dybczynski, Separation and preconcentration Methods in Inorganic
Trace Analysis, 1st ed., Ellis Horwood Limited Press, Chichester, 1982.
60
8. Wykłady specjalizacyjne dla specjalności: Zielona
chemia i czyste technologie
Chemia środowiska
Przemysłowe źródła zanieczyszczenia środowiska
Budowa i eksploatacja składowisk odpadów
Czyste technologie węglowe
Technologia i przetwórstwo polimerów
61
Numer kursu: 0310-3.06.3.050
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 3
Semestr: 5
Chemia środowiska
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Jan Małecki
wykład specjalizacyjny
30
obowiązkowy dla specjalności Zielona chemia i czyste technologie
podstawy chemii, chemia nieorganiczna, chemia organiczna
Treści kształcenia: Chemia środowiska. Skład środowiska; procesy chemiczne
w środowisku; czynniki antropogeniczne. Agencje zajmujące się gromadzeniem danych
o stanie środowiska. Pierwiastki wchodzące w skład Ŝywych organizmów. Cykle obiegu
wybranych pierwiastków w przyrodzie.
Cele przedmiotu: Zapoznanie studentów z problemami środowiskowymi pod względem
chemicznych podstaw działania środowiska tak naturalnego jak i zmienionego w ujęciu
globalnym; zaznajomienie ze składem środowiska, procesami w nim przebiegającymi oraz
rodzajami zmian wynikającymi z działalności człowieka; analiza składu chemicznego,
zachodzących procesów chemicznych i obserwowanych zaburzeń wynikających
z działalności naturalnej i antropogenicznej; zapoznanie z elementami „zielonej chemii”
i toksykologii środowiska; wskazanie na powiązania i zaleŜności występujące pomiędzy
elementami środowiska. W takim ujęciu problemy poruszane w ramach przedmiotu dotyczą:
atmosfery, hydrosfery oraz środowiska lądowego.
Efekty kształcenia: Student po ukończeniu przedmiotu posiada znajomość i rozmienienie
zaleŜności pomiędzy elementami środowiska; potrafi przewidywać skutki obecności
w środowisku substancji szkodliwych i toksycznych; zna podstawowe pojęcia, metody badań,
kontroli oraz oceny stanu środowiska; zna agencje monitorujące stan środowiska oraz normy
środowiskowe; potrafi praktycznie zastosować posiadaną wiedzę do oceny działalności
człowieka na środowisko.
Zalecana literatura:
[1] G.W. VanLoon i S.J. Duffy, Chemia środowiska, Wydawnictwo Naukowe PWN, Warszawa, 2007.
[2] S.E. Manahan, Toksykologia środowiska, aspekty chemiczne i biologiczne, Wyd. Nauk. PWN, Warszawa
2006.
[3] J.E. Andrew i in., Wprowadzenie do chemii środowiska, WNT, Warszawa, 1999.
[4] B.J. Alloway i D.C. Ayres, Chemiczne podstawy zanieczyszczania środowiska, PWN, Warszawa, 1999.
62
Numer kursu: 0310-3.06.3.051
Numer w siatce studiów:
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 3
Semestr: 6
Przemysłowe źródła zanieczyszczenia środowiska
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr inŜ. Joanna Pisarska
wykład specjalizacyjny
30
obowiązkowy dla specjalności Zielona chemia i czyste technologie
brak
Treści kształcenia: Ochrona środowiska. Równowaga ekologiczna. Normy w ochronie
środowiska. Przyrodnicze aspekty ochrony środowiska: ochrona ziemi, ochrona hydrosfery,
ochrona powietrza, ochrona gleb, kopalin, ochrona lasów. ZrównowaŜony rozwój. Koncepcja
czystych technologii. Zanieczyszczenia środowiska związane z działalnością przemysłową.
Rekultywacja terenów zdegradowanych i zdewastowanych. Zanieczyszczenia środowiska
związane z metalurgią Ŝelaza i stali. Zanieczyszczenia środowiska związane z metalurgią
metali kolorowych. Przemysłowe źródła zanieczyszczenia środowiska związane
z przemysłem chemicznym. Zanieczyszczenia środowiska związane z przemysłem
petrochemicznym. Zanieczyszczenia środowiska związane z przemysłem wydobywczym:
górnictwo węgla kamiennego i brunatnego. Przemysłowe źródła zanieczyszczenia środowiska
związane z przemysłem energetycznym. Zanieczyszczenia środowiska związane
z przemysłem ceramicznym. Zanieczyszczenia środowiska związane z przemysłem tworzyw
sztucznych.
Cele przedmiotu: celem przedmiotu jest zapoznanie studentów z problematyką ochrony
i zanieczyszczenia środowiska naturalnego, związanego z działalnością przemysłową:
przemysłem
energetycznym,
wydobywczym
metalurgicznym,
chemicznym
i petrochemicznym, jak równieŜ poznanie sposobów przeciwdziałania i ograniczania
negatywnych skutków oddziaływania na środowisko.
Efekty kształcenia: po ukończeniu kursu student powinien opanować wiedzę z zakresu
ochrony środowiska, norm dotyczących ochrony środowiska oraz przemysłowych źródeł
zanieczyszczenia i związanych z tym zagroŜeń. Powinien znać podstawowe sposoby
ograniczania ilości odpadów i ich ponownego wykorzystania oraz rozumieć procesy, zjawiska
i interakcje występujące w środowisku.
Zalecana literatura:
[1] W. Anigacz i E. Zakowicz, Ochrona środowiska, Wydawnictwo Politechniki Opolskiej, Opole, 2003.
[2] J. Boć, K. Nowacki, E. Samborska-Boć, Ochrona środowiska, Kolonia Limited, Wrocław, 2005.
[3] Z. Brodecki i in., Ochrona środowiska, LexisNexis, Warszawa, 2005.
[4] J. Jendrośka, M. Bar, Prawo ochrony środowiska – podręcznik, Centrum Prawa Ekologicznego, Wrocław,
2005.
[5] K. Górka, B. Poskrobko, W. Kadecki, Ochrona środowiska - problemy społeczne, ekonomiczne i prawne,
PWE, Warszawa, 2001.
[6] C. Rosik-Dulewska, Podstawy gospodarki odpadami, PWN, Warszawa, 2005.
63
Numer kursu: 0310-3.06.3.052
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 4
Semestr:7
Budowa i eksploatacja składowisk odpadów
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr inŜ. Joanna Pisarska
wykład specjalizacyjny
30
obowiązkowy dla specjalności Zielona chemia i czyste technologie
brak
Treści kształcenia: Ochrona środowiska. Podstawowe akty prawne UE dotyczące składowisk
odpadów. Gospodarka odpadami. Klasyfikacja odpadów. Rodzaje składowisk odpadów. Rola
składowisk w systemie gospodarki odpadami. Decyzje administracyjne na etapie procesu
inwestycyjnego. Wymagania dotyczące lokalizacji, budowy, eksploatacji i zamknięcia
poszczególnych typów składowisk. Elementy konstrukcyjne składowiska odpadów. Materiały
geotekstylne w budowie składowisk. Materiały stosowane na przesłony uszczelniające
podłoŜa i skarpy. Wymagania dotyczące wykonawstwa geomembran. WyposaŜenie
składowisk. Eksploatacja składowiska odpadów. Systemy odgazowania składowiska.
Systemy drenaŜu i gospodarka odciekami. Monitoring składowisk. Zamknięcie i rekultywacja
składowisk. Modernizacja składowisk odpadów. Przeglądy ekologiczne.
Cele przedmiotu: celem przedmiotu jest zapoznanie studentów z problematyką gospodarki
odpadami w szerokim kontekście ochrony środowiska i zrównowaŜonego rozwoju. Kurs
obejmuje zagadnienia związane z klasyfikacją odpadów, typami składowisk oraz budową
i eksploatacją składowisk odpadów. Omawiane są równieŜ problemy zamknięcia i
rekultywacji oraz modernizacji składowisk.
Efekty kształcenia: po ukończeniu kursu student powinien opanować podstawową wiedzę
z zakresu ochrony środowiska, roli składowisk w gospodarce odpadami oraz budowy
i eksploatacji składowisk odpadów. Powinien znać podstawowe słownictwo, elementy
konstrukcyjne i materiały stosowane w budowie, a takŜe wymagania dotyczące lokalizacji,
eksploatacji i zamknięcia składowiska.
Zalecana literatura:
[1] W. Anigacz, E. Zakowicz, Ochrona środowiska, Wydawnictwo Politechniki Opolskiej, Opole, 2003.
[2] J. Boć, K. Nowacki, E. Samborska-Boć, Ochrona środowiska, Kolonia Limited, Wrocław, 2005.
[3] Z. Brodecki i in., Ochrona środowiska, LexisNexis, Warszawa, 2005.
[4] J. Jendrośka i M. Bar, Prawo ochrony środowiska – podręcznik, Centrum Prawa Ekologicznego, Wrocław,
2005.
[5] K. Górka, B. Poskrobko, W. Kadecki, Ochrona środowiska - problemy społeczne, ekonomiczne i prawne,
PWE, Warszawa, 2001.
[6] C. Rosik-Dulewska, Podstawy gospodarki odpadami, PWN, Warszawa, 2005.
[7] S. Łuniewski, Bezpieczne składowanie odpadów, Wydawnictwo ekonomia i środowisko, Białystok, 2000.
[8] J. Bentkowski, Logistyka odpadów, Wydawnictwo Politechniki Śląskiej, Gliwice, 2002.
64
Numer kursu: 0310-3.06.3.053
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: egzamin
Język: polski/angielski
Punkty ECTS: 2
Rok studiów: 4
Semestr: 7
Czyste technologie węglowe
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr Adam Smoliński
wykład specjalizacyjny
30
obowiązkowy dla specjalności Zielona chemia i czyste technologie
brak
Treści kształcenia: Przyszłość węgla w Polsce i na świecie. Charakterystyka zasobów węgla
w Polsce. Rola węgla w zapewnieniu bezpieczeństwa energetycznego kraju. Czyste
technologie węglowe. Główne kierunki przetwórstwa węgla (spalanie węgla, zgazowania
węgla, upłynnianie węgla), sekwestracja CO2, rozwaŜane na świecie opcje sekwestracji,
inicjatywny w zakresie czystych technologii węglowych.
Cele przedmiotu: Zapoznanie studentów z podstawowymi zagadnieniami dotyczącymi
czystych technologii węglowych, zasobów energetycznych i bezpieczeństwa energetycznego
kraju.
Efekty kształcenia: Po ukończeniu kursu student powinien posiąść podstawową wiedzę
w zakresie czystych technologii węglowych a w szczególności powinien umieć omówić
podstawowe procesy przetwórstwa węgla (w tym krótko scharakteryzować podstawowe
pojęcia takie jak CTW, zgazowanie węgla, spalanie węgla, upłynnianie węgla, uwodornienie
węgla, sekwestracja CO2), a takŜe posiąść wiedzę na temat posiadanych w Polsce zasobów
węgla kamiennego i brunatnego oraz ich wykorzystywania w procesach wytwarzania energii.
Zalecana literatura:
[1] J. Szuba, L. Michalik, Karbochemia – Zarys rozwoju, Wydawnictwo Śląsk, Katowice, 1983.
[2] T. Borowiecki, J. Kijeński, J. Machnikowski i M. ŚciąŜko, Czysta energia, produkty chemiczne i paliwa
z węgla – ocena potencjału rozwojowego, Zabrze, IChPW, 2008.
65
Numer kursu: 0310-3.06.3.054
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 4
Semestr: 7
Technologia i przetwórstwo polimerów
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. inŜ. Ewa Schab-Balcerzak
wykład specjalizacyjny
30
obowiązkowy dla specjalności Zielona chemia i czyste technologie
brak
Treści kształcenia: Specyfika właściwości związków wielkocząsteczkowych – porównanie
z substancjami o niskiej masie molowej. Wybrane monomery – technologie ich wytwarzania.
Polimery i tworzywa sztuczne – metody otrzymywania związków wielkocząsteczkowych –
polimeryzacja, polikondensacja, poliaddycja. Właściwości fizykochemiczne polimerów
i tworzyw sztucznych - masa cząsteczkowa i jej pomiar, stany fazowe i temperatury
charakterystyczne, lepkość i właściwości mechaniczne, związek między budową
a właściwościami polimerów. Wybrane grupy polimerów: poliolefiny, polimery winylowe,
poliestry, poliamidy, poliuretany, kauczuki. Technologie stosowane w przemyśle
chemicznym do otrzymywania, formowania, modyfikacji i przetwórstwa wybranych
polimerów addycyjnych, polimerów kondensacyjnych, modyfikowanych polimerów
naturalnych. Formowanie poprzez wytłaczanie, wtryskiwanie, prasowanie, laminowanie.
Polimerowe Ŝywice fenolowo-formaldehydowe, epoksydowe i silikonowe. Reakcje
sieciowania. Charakterystyka dodatków modyfikujących i uszlachetniających tworzywa
sztuczne: wypełniacze, barwniki, plastyfikatory, stabilizatory. Polimery konstrukcyjne.
Materiały kompozytowe. Polimery do specjalnych zastosowań, w tym polimery przewodzące.
Polimery naturalne. Recykling materiałów polimerowych.
Cele przedmiotu: Uświadomienie studentom znaczenia polimerów i materiałów
polimerowych dla współczesnej cywilizacji. Zrozumienie znaczenia właściwego doboru
tworzywa sztucznego do konkretnego zastosowania oraz zasady wyboru metod przetwórstwa.
Zapoznanie z technikami zagospodarowania odpadów tworzyw sztucznych.
Efekty kształcenia: Studenci uzyskują wiedzę o technologiach otrzymywania podstawowych
materiałów polimerowych oraz o metodach ich identyfikacji; mają umiejętność określania
właściwości fizycznych, chemicznych, mechanicznych i termicznych materiałów
polimerowych; znają zasady wyboru i stosowania tworzyw sztucznych w róŜnych działach
nauki i techniki; postępowania z odpadami; stosowania przyjaznych środowisku technologii
recyklingu polimerów.
Zalecana literatura:
[1] J. Pielichowski i A. Puszyński, Technologia tworzyw sztucznych, WNT, Warszawa, 2003.
[2] Z. Florjańczyk i S. Penczek, Chemia polimerów, PWN, Warszawa, 1998.
[3] M. Kozłowski, Recykling tworzyw sztucznych. Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław,
2004.
66
9. Wykłady specjalizacyjne dla specjalności: Technologia
nieorganiczna i organiczna
Nanomateriały i nanotechnologie
Materiały dla medycyny
Materiały i technologie ceramiczne
Technologie wytwarzania kryształów i materiałów krystalicznych
Katalityczne procesy heterogeniczne
67
Numer kursu: 0310-3.07.3.061
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: zaliczenie
Język: polski
Punkty ECTS: 2
Rok studiów: 3
Semestr: 5
Nanomateriały i nanotechnologie
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Wojciech Pisarski, prof. UŚ
wykład specjalizacyjny
30
obowiązkowy dla specjalności Technologia nieorganiczna i organiczna
brak
Treści kształcenia: Kopolimery blokowe w nanotechnologii. Kopolimery blokowe dla
litografii. Kopolimery blokowe jako nanoreaktory. Kopolimery blokowe powierzchniowoczynne. Kopolimery blokowe jako nanowłókna i nanorurki. Otrzymywanie nanowłókien
i nanorurek. Właściwości. Reakcje chemiczne. Modyfikacje. Nanozestawy kopolimerów
blokowych jako nośników leków i genów. Wyzwalanie reakcji. Polimery spiralne na bazie
supramolekularnych warstw. Synteza nanorurek nieorganicznych. Nanorurki chalkogenkowe.
Nanorurki tlenków metali. Nanorurki SiO2, TiO2, ZnO, CdO, Al2O3. Nanorurki tlenków
metali przejściowych. ZłoŜone nanostruktury nieorganiczne oparte na nanorurkach.
Nanocząstki złota i nanorurki węglowe – jako prekursory nowoczesnych materiałów
kompozytowych. Zastosowanie nanocząstek i nanorurek. Nanostruktury metali. Polimery
optycznie aktywne jako nanokompozyty zawierające funkcyjne chromofory organiczne
i nanostruktury metali. Mezoporowaty tlenek glinu: synteza, właściwości, zastosowanie.
Nanoceramika do zastosowań medycznych. Nanoceramika jako nośniki leków.
Mikrobioceramika jako nośniki leków. Mikrobioceramika dla radioterapii. Nanotoksykologia
i nanodiagnostyka. Kompozytowe nanocząstki SiC. Ekologia i toksykologia inŜynieryjnych
nanocząstek węglowych. Fulereny. Nanoklastery. Oddziaływanie nanorurek węglowych
z biomolekułami. Kropki kwantowe. Nanoproszki. Nanokryształy w transparentnych
układach szklano-ceramicznych: właściwości optyczne i zastosowanie.
Cele przedmiotu: Celem przedmiotu jest zapoznanie studentów z zagadnieniami szeroko
rozumianej nanotechnologii i podstawowymi zagadnieniami technologii nanomateriałów
polimerowych, metalicznych i ceramicznych i ich zastosowaniem w technice i w medycynie.
Efekty kształcenia: Po ukończeniu kursu student powinien znać róŜne rodzaje
współczesnych nanomateriałów, podstawowe właściwości tych materiałów oraz
najwaŜniejsze aspekty technologiczne.
Zalecana literatura:
[1] K.E. Geckeler, H. Nishide, Advanced Nanomaterials, tom 1 i 2, WILEY-VCH Verlag GmbH&Co. KGaA,
Weinheim, 2010.
[2] C.N.R. Rao, A. Müller, A.K. Cheetham, Nanomaterials Chemistry, WILEY-VCH Verlag GmbH&Co.
KGaA, Weinheim, 2007.
[3] Kumar, S.S.R Challa, Nanomaterials for the Life Sciences, WILEY-VCH Verlag GmbH&Co. KGaA,
Weinheim, 2010.
[4] Kumar, S.S.R Challa, Nanotechnologies for the Life Sciences, WILEY-VCH Verlag GmbH&Co. KGaA,
Weinheim, 2007.
[5] D. Vollath, Nanomaterials, WILEY-VCH Verlag GmbH&Co. KGaA, Weinheim, 2008.
[6] M. Jurczyk, Nanomateriały, Wydawnictwo Politechniki Poznańskiej, Poznań, 2001.
68
Numer kursu: 0310-3.07.3.062
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 3
Semestr: 6
Materiały dla medycyny
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Wojciech Pisarski, prof. UŚ
wykład specjalizacyjny
30
obowiązkowy dla specjalności Technologia nieorganiczna i organiczna
brak
Treści kształcenia: Polimery w medycynie. Biofizyka tkanek: bioelektroniczne cechy
środowiska tkanek, tkanka nerwowa, mięśniowa, kostna, problemy w chirurgii
rekonstrukcyjnej i zabiegowej. Biomateriały - definicje i kryteria jakości. Funkcje i kryteria
jakości biomateriałów. Implanty - podstawowe pojęcia. Klasyfikacja urządzeń medycznych.
Polimery dla celów medycznych: wymagania i kryteria doboru. Rodzaje polimerów
stosowanych w medycynie. Zastosowanie polimerów w medycynie: kardiochirurgia, chirurgia
naczyniowa, szczękowo-twarzowa, urazowa, plastyczna, ortopedia. Łączenie tkanej miękkich.
Naprawa i regeneracja tkanek. Polimery w inŜynierii tkankowej. Soczewki kontaktowe.
Polimery jako leki. Biomateriały w kardiochirurgii: przegląd materiałów, protezy zastawek
serca, sztuczne serce, pompy krwi. Biotolerancja implantów polimerowych. Technologie
przetwarzania polimerów na wyroby medyczne. Podstawowe techniki charakteryzowania
polimerów. Polimery jako nośniki leków: zalety kontrolowanego długotrwałego podawania
leków, sposoby ich wprowadzania do organizmu. Polimery biodegradowalne. Stopy NiTi do
zastosowań w medycynie i stomatologii. Stopy metali z pamięcią kształtu. Kompozyty.
Materiały ceramiczne w medycynie. Cementy. Materiały bioceramiczne: biomimetyczne,
kompozytowe, inteligentne, do regeneracji tkanek, nośniki leków, sztuczne organy
hybrydowe, moŜliwości wykorzystania fulerenów w medycynie, nanowyroby, biomateriały
otrzymywane metodą zol-Ŝel, technologia otrzymywania, formy, techniki pokrywania.
Cele przedmiotu: Celem przedmiotu jest przedstawienie wiedzy dotyczącej materiałów
stosowanych w medycynie: biomateriałów metalicznych, ceramicznych i polimerowych.
zapoznanie studentów z zagadnieniami szeroko rozumianej chemii materiałów. Zostaną
omówione podstawowe definicje, kryteria podziału i funkcje biomateriałów oraz technologie
ich otrzymywania.
Efekty kształcenia: Po ukończeniu kursu student powinien poznać róŜnorodne biomateriały
mające zastosowanie w medycynie, wymagania stawiane tym materiałom oraz kryteria ich
doboru.
Zalecana literatura:
[1] H. Kuś, Biomateriały, t. 4 w: M. Nałęcz, „Problemy biocybernetyki i inŜynierii biomedycznej, Wydawnictwo
Komunikacji i Łączności, Warszawa, 1990.
[2] Praca zbiorowa, Tworzywa sztuczne w medycynie, WNT, Warszawa, 1970.
[3] J. Marciniak, Biomateriały w chirurgii kostnej, Wydawnictwo Politechniki Śląskiej, Gliwice, 1992.
[4] J. Marciniak, Biomateriały, Wydawnictwo Politechniki Śląskiej, Gliwice, 2002.
[5] S. BłaŜewicz, L. Stoch, Biomateriały, t. 4 w: M. Nałęcz, Biocybernetyka i inŜynieria biomedyczna,
Akademicka Oficyna Wydawnicza EXIT, Warszawa, 2003.
69
Numer kursu: 0310-3.07.3.063
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 4
Semestr: 7
Materiały i technologie ceramiczne
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr inŜ. Joanna Pisarska
wykład specjalizacyjny
30
obowiązkowy dla specjalności Technologia nieorganiczna i organiczna
brak
Treści kształcenia: Klasyfikacja materiałów ceramicznych. Porcelana stołowa i techniczna.
Fajans. Wyroby sanitarne. Kamionka kanalizacyjna i kwasoodporna. Ceramika radiowa.
Ceramika inŜynieryjna. Szkła. Właściwości materiałów ceramicznych: wiązania chemiczne,
właściwości cieplne, właściwości mechaniczne, właściwości elektryczne. Podział
i właściwości surowców ceramicznych. Surowce ilaste. Metody wzbogacania surowców
ilastych. Kaoliny. Surowce krzemionkowe. Surowce skaleniowe. Surowce węglanowe.
Przerabianie surowców i przygotowanie mas formierskich. Mielenie. Suszenie półwyrobów
ceramicznych. Wypalanie wyrobów. Przygotowanie szkliwa i szkliwienie. Przemiany fazowe
w układach ceramicznych. Równowagi fazowe. Otrzymywanie i charakterystyka proszków
ceramicznych. Budowa proszków. Rozdrabnianie. Specjalne metody preparatyki proszków.
Metody formowania. Prasowanie. Formowanie plastyczne. Formowanie przez odlewanie.
Wady powstające w procesie formowania. Procesy zachodzące podczas spiekania.
Witryfikacja. Budowa polikryształów. Obróbka końcowa spieków. Połączenia ceramiki
z metalem. Pokrycia przewodzące. Zagadnienia obróbki powierzchni wyrobów ceramicznych.
Cele przedmiotu: celem przedmiotu jest przedstawienie podstawowej wiedzy dotyczącej
materiałów ceramicznych klasycznych i zaawansowanych oraz technologii ceramicznej. Kurs
obejmuje zaznajomienie z klasyfikacją materiałów ceramicznych, ich właściwościami oraz
podstawowymi procesami technologicznymi. Przedstawienie zagadnień związku budowy
w róŜnych skalach wielkości z właściwościami materiałów ceramicznych, stanowi podstawę
świadomego kształtowania właściwości i wykorzystania materiałów ceramicznych.
Efekty kształcenia: po ukończeniu kursu student powinien opanować wiedzę z zakresu
podstawowych pojęć związanych z materiałami ceramicznymi oraz opanować podstawy
technologii ceramicznej.
Zalecana literatura:
[1] R. Pampuch i K. Haberko, M. Kordek, Nauka o procesach ceramicznych, Wydawnictwo Naukowe PWN,
Warszawa, 1992.
[2] A. Bolewski, M. Budkiewicz, P. Wyszomirski, Surowce ceramiczne, Wydawnictwa geologiczne, Warszawa,
1991.
[3] R. Pampuch, Materiały ceramiczne, PWN, Warszawa, 1988.
[4] W. D. Callister , Materials science and engineering, John Wiley & Sons, New York, 1990.
[5] M. Blicharski, InŜynieria materiałowa, WNT, Warszawa, 2004.
[6] R. Pampuch, Budowa i właściwości materiałów ceramicznych, Wydawnictwo AGH, Kraków, 1995.
[7] M. Blicharski, Wstęp do inŜynierii materiałowej, WNT, Warszawa, 1998.
[8] O. H. Wyatt i D. Hughes, Wprowadzenie do inŜynierii materiałowej, WNT Warszawa, 1978.
[9] J. Dereń, J. Haber, R. Pampuch, Chemia ciała stałego, PWN, Warszawa 1977.
70
Numer kursu: 0310-3.07.3.065
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 4
Semestr:7
Technologie wytwarzania kryształów i materiałów krystalicznych
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
dr hab. Barbara Machura, prof. UŚ
wykład specjalizacyjny
30
obowiązkowy dla specjalności Technologia nieorganiczna i organiczna
brak
Treści kształcenia: Ciało krystaliczne a ciało amorficzne. Elementy krystalografii
i krystalochemii. Defekty struktury krystalicznej i ich rola. Proces krystalizacji.
Termodynamiczne aspekty zarodkowania homo- i heterogenicznego. Mechanizmy i teorie
wzrostu kryształu. Wzrost kryształów z roztworu, ze stopu i z fazy gazowej. Wybrane
technologie wytwarzania kryształów objętościowych. Spiekanie i rozrost ziaren. Krystalizacja
chemiczna z fazy gazowej CVD. Osadzanie fizyczne z fazy gazowej PVD i PVT. Epitaksja.
Kinetyka wzrostu struktur epitaksjalnych. Krystalizacja epitaksjalna i techniki epitaksjalne.
Właściwości i zastosowania materiałów krystalicznych.
Cele przedmiotu: Zdobycie wiedzy umoŜliwiającej pełne zrozumienie zjawisk zachodzących
przy zarodkowaniu i wzroście kryształów z roztworu, ze stopu i z fazy gazowej oraz
zapoznanie się z podstawowymi technologiami otrzymywania materiałów krystalicznych.
Efekty kształcenia: Po ukończeniu kursu student powinien opanować podstawową wiedzę
z zakresu krystalografii i krystalochemii, rozumieć zjawiska zachodzące podczas
homogenicznego i heterogenicznego zarodkowania i wzrostu kryształów z roztworu, ze stopu,
z fazy gazowej, znać podstawowe technologie wytwarzania materiałów krystalicznych
i mechanizmy sterowania procesem krystalizacji oraz nabyć umiejętność przewidywania
właściwości materiałów krystalicznych w zaleŜności od ich struktury krystalicznej.
Zalecana literatura:
[1] Z. Kosturkiewicz, Metody krystalografii, Wydawnictwo naukowe UAM, Poznań, 2000.
[2] J. śmija, Podstawy teorii wzrostu monokryształów, PWN, Warszawa, 1987.
[3] J. śmija, Otrzymywanie monokryształów, PWN, Warszawa, 1988.
[4] J. Dereń, J. Haber, R. Pampuch, Chemia ciała stałego, PWN, Warszawa, 1975.
71
Numer kursu: 0310-3.07.3.064
Numer w siatce studiów: 35
Forma zaliczenia przedmiotu: egzamin
Język: polski
Punkty ECTS: 2
Rok studiów: 4
Semestr: 7
Katalityczne procesy heterogeniczne
Wykładowca:
Typ zajęć:
Liczba godzin:
Przedmiot:
Wymagania wstępne:
prof. dr hab. inŜ. Stanisław Krompiec
wykład specjalizacyjny
30
obowiązkowy dla specjalności Technologia nieorganiczna i organiczna
brak
Treści kształcenia: Heterogeniczne procesy katalityczne w syntezie i technologii organicznej
i nieorganicznej: układy gaz-ciało stałe, ciecz ciało stałe, ciecz-ciało stałe, ciecz-ciecz, układy
wieloskładnikowe. Modelowanie procesów kontaktowych w ziarnie katalizatora,
projektowanie morfologii powierzchni katalizatora. Reaktory kontaktowe. Materiały o
rozwiniętej powierzchni, materiały mezoporowate, ciecze jonowe, klastery metali,
immobilizowane enzymy. Zjawiska powierzchniowe. Procesy sorpcji na granicach faz.
Reakcje chemiczne zachodzące na powierzchni. Reakcje ciało stałe-gaz. Katalizatory
immoblizowane: na powierzchni nośników stałych, w cieczach jonowych. Przemysłowe
procesy katalityczne heterogeniczne. Kataliza Phase Transfer. Selektywność procesów
kontaktowych. Projektowanie katalizatorów kontaktowych. Regeneracja katalizatorów.
Cele przedmiotu: studenci poznają róŜne heterogeniczne procesy katalityczne. W ten sposób
uzyskują wiedzę pozwalającą na stosowanie róŜnych układów katalitycznych (szczególnie
heterogenicznych) do selektywnej realizacji oczekiwanych przemian chemicznych.
Efekty kształcenia – umiejętności i kompetencje: studenci uzyskują zdolność rozumienia
zjawisk i reakcji chemicznych zachodzących w układach heterogenicznych, szczególnie na
powierzchni; są przygotowani do projektowania i dokonywania wyboru oraz stosowania
katalizatorów heterogenicznych w technologiach chemicznych, małych i wielkotonaŜowych.
Zalecana literatura:
[1] R. Pampuch i K. Haberko, M. Kordek, Nauka o procesach ceramicznych, Wydawnictwo Naukowe PWN,
Warszawa, 1992.
[2] A. Bolewski, M. Budkiewicz, P. Wyszomirski, Surowce ceramiczne, Wydawnictwa geologiczne, Warszawa,
1991.
[3] R. Pampuch, Materiały ceramiczne, PWN, Warszawa, 1988.
[4] W.D. Callister , Materials science and engineering, John Wiley & Sons, New York, 1990.
[5] M. Blicharski, InŜynieria materiałowa, WNT, Warszawa, 2004.
[6] R. Pampuch, Budowa i właściwości materiałów ceramicznych, Wydawnictwo AGH, Kraków, 1995.
[7] M. Blicharski, Wstęp do inŜynierii materiałowej, WNT, Warszawa, 1998.
[8] O.H. Wyatt i D. Hughes, Wprowadzenie do inŜynierii materiałowej, WNT Warszawa, 1978.
[9] J. Dereń, J. Haber, R. Pampuch, Chemia ciała stałego, PWN, Warszawa, 1977.
72