Rekomendacje do stosowania antybiotyków,
diagnostyki i terapii zakażeń
W
Wielkopolskim Centrum Pulmonologii i Torakochirurgii
2012 rok
Opracowanie
Dr med. Tomasz Ozorowski
Weryfikacja
Komitet Terapeutyczny
Akceptacja
Dyrektor Szpitala
Data:
Data:
Dr n. med. Paweł Gruszczyński
Data: 2.02.2012
1
Spis treści
I.
1
2
3
4
5
II.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
III.
1
2
3
4
5
6
7
8
IV.
1
2
3
4
5
6
7
8
Rozdział
Ogólne informacje dotyczące szpitalnej polityki antybiotykowe w WCPiT
System szpitalnej polityki antybiotykowej w WCPiT
Lista antybiotyków dostępnych w szpitalu i ich dawkowanie
Zużycie antybiotyków w WCPiT w 2011 roku
Wskazania do stosowania poszczególnych antybiotyków
Koszty leczenia poszczególnymi antybiotykami
Zakażenia układu oddechowego
Ostre zapaleni oskrzeli i grypa
Zaostrzenie POChP
Stosowanie antybiotyków u pacjentów z rozstrzeniami oskrzeli
Pozaszpitalne zapalenie płuc
Niepowodzenia terapeutyczne w pozaszpitalnym zapaleniu płuc
Szpitalne zapalenie płuc oraz zapalenie płuc związane z zakładami opieki
zdrowotnej
VAP, VAT- zapalenie płuc oraz tracheobronchitis związane z leczeniem
respiratorem
Wykonywane mikrobiologicznych badań przesiewowych u pacjentów OAiT
Zapalenie płuc u pacjenta z niedoborem odporności
Interpretacja wyników badan mikrobiologicznych z materiału pobranego drogą
bronchoskopii
Leczenie zapalenia płuc przy określonej etiologii
Ropniak opłucnej
Ropień płuca
Diagnostyka zakażeń układu oddechowego w WCPIT
Diagnostyka zakażeń układu oddechowego poza WCPIT
Szczepienia pacjentów WCPiT jako profilaktyka zakażeń układu oddechowego
Gruźlica i inne mykobakteriozy
Zakaźność gruźlicy
Postępowanie po ekspozycji na gruźlicę i badanie osób z kontaktu
Diagnostyka i leczenie formy latentnej
Diagnostyka gruźlicy płucnej
Rola testu IGRA (Quanti-FERRON TB GOLD) w diagnostyce gruźlicy
Leczenie gruźlicy płucnej
Inne mykobakteriozy
Piśmiennictwo
Zakażenia inne
Zakażenia układu moczowego
Zakażenia tkanek miękkich i skóry
Zakażenia w obrębie jamy brzusznej: zakażenie Clostridium difficile, eradykacja
Helicobacter pylori
Zakażenia związane z linia naczyniową
Profilaktyka bakteryjnego zapalenia wsierdzia
Gorączka neutropeniczna
Leczenie zakażeń grzybiczych: Candida sp. , Aspergillus sp.
Stosowanie antybiotyków jako profilaktyka okołooperacyjna
2
Strona
3
4
6
6
17
19
19
21
24
26
27
34
38
41
43
47
49
50
51
53
54
55
57
57
59
61
64
68
69
71
72
75
75
78
82
84
84
85
86
89
I.
Ogólne informacje dotyczące szpitalnej polityki
antybiotykowej w WCPIT
1. SYSTEM SZPITALNEJ POLITYKI ANTYBIOTYKOWEJ
W ciągu ostatnich lat zauważalne jest bardzo szybkie narastanie oporności bakterii na antybiotyki,
szczególnie w środowisku szpitalnym. Zakażenie wieloopornym szczepem bakteryjnym zwiększa
ryzyko niepowodzenia terapeutycznego oraz powoduje wydłużenie czasu hospitalizacji pacjenta.
Równocześnie ograniczeniu uległy możliwości przemysłu farmaceutycznego do wyprodukowania
nowych, skutecznych antybiotyków.
Z tych powodów jednym ze strategicznych celów szpitala jest wdrażanie programów racjonalizujący
stosowanie antybiotyków i tym samym ochrona szpitala przed niekorzystnymi zjawiskami
epidemiologicznymi.
Rekomendacje do diagnostyki i terapii zakażeń obejmują metody mikrobiologiczne diagnostyki
zakażenia oraz stosowanie antybiotyków , nie omawiają innych rodzajów leczenia, w tym stosowania
leków objawowych oraz leczenia chirurgicznego.
Akty prawne regulujące stosowanie antybiotyków w szpitalu
Ustawa o zapobieganiu oraz zwalczaniu zakażeń i chorób zakaźnych u ludzi z dnia 5 grudnia 2008
roku wymaga od kierowników zakładów opieki zdrowotnej następujących działań dotyczących
stosowania antybiotyków
Artykuł 14 ustęp 1.3.: ograniczenie narastania lekooporności biologicznych czynników
chorobotwórczych w wyniku niewłaściwego stosowania profilaktyki i terapii antybiotykowej;
artykuł 15 ustęp 4: opracowywanie i aktualizacja standardów farmakoprofilaktyki i
farmakoterapii zakażeń i chorób zakaźnych w szpitalu
Rozporządzenie Ministerstwa Zdrowia z dnia 27 maja 2010 roku w sprawie zakresu, sposobu i
częstotliwości prowadzenia kontroli wewnętrznej w obszarze realizacji działań zapobiegających
szerzeniu się zakażeń i chorób zakaźnych zobowiązuje kierownika zakładu opieki zdrowotnej do
prowadzenia kontroli jednostek w zakresie oceny prawidłowości i skuteczności profilaktyki i terapii
antybiotykowej.
Kluczowe zakażenia w Wielkopolskim Centrum Pulmonologii i Torakochirurgii
Przybliżone liczby hospitalizacji pacjentów z zakażeniami w ciągu roku, nie ujęta gruźlica:
1. Przewlekle zapalenie oskrzeli/zaostrzenie POChP= 350-400
2. Zapalenia płuc = 200-250
3. Rozstrzenia oskrzeli 80-100
4. Ropniak opłucnej 80-100
5. Ropień płuca 30
6. Ropień płuca i śródpiersia =5-10
3
2. LISTA ANTYBIOTYKÓW, LEKÓW PRZECIWWIRUSOWYCH I LEKÓW
PRZECIWGRZYBICZYCH DOSTĘPNYCH W WCPiT
Leki przeciwbakteryjne
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
Amikacyna iv
Amoksycylina po
Amoksycylina z klawulanianem iv, po
Ampicylina iv
Ampicylina z sulbaktamem iv
Azytromycyna iv
Cefazolina iv
Cefepim iv
Ceftriakson iv
Ceftazydym iv
Cefuroksym iv,po
Ciprofloksacyna iv,po
Doksycyklina iv, po
Ertapenem iv
Fenoksymetylpenicylina po
Furagin
Gentamycyna iv
Imipenem iv
Kloksacylina iv
Kolistyna iv, inhalacje
Klarytromycyna po
Klindamycyna iv, po
Lewofloksacyna po ,iv
Linezolid iv
Metronidazol iv, po
Meropenem iv
Penicylina benzylowa iv
Piperacylina iv
Piperacylina tazobactam iv
Teikoplanina
Trimetoprim/sulfametoksazol iv, po
Wankomycyna
Leki przeciwwirusowe
1. Acyklowir iv, po
2. Oseltamiwir po
Leki przeciwgrzybicze
1.
2.
3.
4.
5.
Flukonazol
Itrakonazol
Worikonazol
Echinokandyna wg aktualnego przetargu: anidulafungina lub caspofungina lub micafungina
Nystatyna
4
Leki stosowane w leczeniu gruźlicy
1.
2.
3.
4.
5.
6.
7.
8.
9.
Rifabutina
Rifampicyna
Izoniazyd + Rifampicyna
Klofazimina
Etionamid
Ofloksaycna
Cykloseryna
Streptomycyna
Pyrazinamid
5
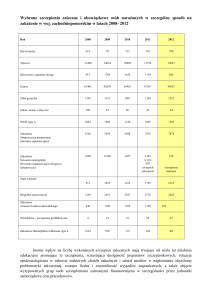
3. ZUŻYCIE ANTYBIOTYKÓW W 2011 ROKU W WCPIT
Najczęściej stosowane antybiotyków w DDD w okresie I-IX.2011; dane przedstawione w formie dni
leczenie przy zastosowaniu zdefiniowanej dawki dobowej
4. WSKAZANIA DO STOSOWANIA POSZCZEGÓLNYCH ANTYBIOTYKÓW
W WCPIT
1. Amoksycylina z klawulanianem
Należy zaznaczyć bardzo poważne dysproporcje między powszechnym stosowaniem formy
dożylnej amoksycyliny z klawulanianem a brakiem dowodów naukowych potwierdzających jej
skuteczność i bezpieczeństwo
Sytuacje, gdy amoksycylina z klawulanianem nie powinna być stosowana:
- w ciężkich zakażeniach pozaszpitalnych
- w zakażeniach szpitalnych
- u kobiet ciężarnych; wykazano, że stosowanie amoksycyliny z klawulanianem w
przedwczesnym przedporodowym pęknięciu błon płodowych zdecydowanie zwiększa ryzyko
martwiczego zapalenia jelit u noworodków
6
- u noworodków z powodu braku dowodów potwierdzających bezpieczeństwo jej stosowania
oraz informacje o niekorzystnym działaniu na zdrowie noworodków, gdy jest stosowana u
ciężarnych; brak penetracji przez barierę krew-mózg
- u pacjentów z chorobami, które mogą zwiększać ryzyko hepatotoksyczności amoksycyliny z
klawulanianem
Stosowanie amoksycyliny z klawulanianem w WCPiT:
jeżeli to możliwe należy stosować formę doustną zamiast dożylnej
optymalna dawka formy doustnej amoksycyliny z klawulanianem w zapaleniach płuc to
dawka, która umożliwia podanie amoksycyliny 3 x 1 g p/o, co oznacza podanie
następujących postaci leku: amoksycylina z klawulanianem 3 x 625 + amoksycylina 3 x 500
mg , ewentualnie amoksycylina z klawulanianem 3 x 1 g
główne wskazania do stosowania w WCPiT
1) pozaszpitalne zapalenie płuc: brak przewagi nad amoksycyliną, częstsze objawy uboczne
2) zaostrzenie POChP: przewaga nad amoksycyliną gdyż skuteczna wobec Moraxella
catharallis i H. influenzae produkujące beta-laktamazy
3) pozaszpitalny ropień płuca
4) pozaszpitalny ropniak opłucnej
2. Amoksycylina
Lek z wyboru w ostrym zapaleniu ucha środkowego i ostrym zapaleniu zatok przynosowych ;
dawkowanie u dorosłych: 2 x 1,52 g/dobę, p.o.,
W pozaszpitalnym zapaleniu płuc u dorosłych o przebiegu łagodnym lub umiarkowanym;
dawkowanie: 3 x 1 g/dobę
Zaostrzenie POChP u pacjentów w mniej zaawansowanym stadium choroby w dawce 3 x 1g/dobę
Eradykacja Helicobacter pylori : w dawce 2 x 1 g/dobę w skojarzeniu z inhibitorem pompy
protonowej oraz klarytromycyną
Profilaktyka bakteryjnego zapalenia wsierdzia
wszystkie procedury stomatologiczne związane z naruszeniem dziąseł oraz
okołoszczytowych regionów zębów lub perforacją błony śluzowej jamy ustnej oraz w
zabiegach nacięcia błony śluzowej dróg oddechowych (np. tonsillektomia), które
wykonywane są u pacjentów: z wcześniejszym epizodem bakteryjnego zapalenia
wsierdzia, protezą zastawki serca, wadą wrodzoną serca (nieskorygowane wady
przebiegające z sinicą, wady serca leczone poprzez wszczepienie ciała obcego - w ciągu 6
miesięcy od zabiegu, skorygowane wady wrodzone z resztkowym defektem
pozostającym przy miejscu wszczepienia ciała obcego, przeszczep serca przebiegający z
wadą zastawkową)
Dawkowanie amoksycyliny: 2 g lub 50 mg/kg u dzieci ok. 2 godz. przed zabiegiem;
dopuszczalne jest podawanie jednej dawki po zabiegu, jeżeli pacjent nie otrzymał jej
wcześniej
7
3. Ampicylina
Pozaszpitalne zapalenie płuc u dorosłych w dawce 4 x 1 g/dobę iv
Zakażenia krwi i zapalenie wsierdzia o etiologii Enterococcus sp. w dawce dla bakteryjnego
zapalenia wsierdzia: 6 x 2 g/dobę iv w skojarzeniu z gentamicyną oraz w zakażeniach krwi w
zależności od stopnia ciężkości: 12 g iv co 46 godz.
Lek z wyboru w zakażeniach o etiologii Listeria monocytogenes; zalecane początkowe dodanie
gentamicyny w przypadku bakteriemii, zapaleń opon mózgowo-rdzeniowych lub zakażeń u
pacjentów z ciężkim niedoborem odporności
Zakażenia układu moczowego o etiologii Enterococcus faecalis, Streptococcus agalactiae
Profilaktyka bakteryjnego zapalenia wsierdzia, gdy nie jest możliwe podanie doustne
amoksycyliny
4.
Kloksacylina
Kloksacylina w formie dożylnej jest lekiem z wyboru w leczeniu zakażeń o etiologii
Staphylococcus aureus i gronkowców koagulazo-ujemnych wrażliwych na metycylinę,
Dawkowanie dożylne :
- zakażenia umiarkowanełagodne: 4 x 1 g iv
- zakażenia umiarkowaneciężkie: 6 x 1 g iv
- zakażenia bardzo ciężkie, w tym bakteryjne zapalenie wsierdzia i zakażenie centralnego
układu nerwowego: 12 g iv na dobę w 6 dawkach podzielonych
5. Piperacylina
jedynie w zakażeniach o etiologii Pseudomonas aeruginosa
Dawkowanie
- Łagodne zakażenia: 412 g/dobę w 4 dawkach podzielonych
- Ciężkie zakażenia: 1224 g/dobę w 6 dawkach podzielonych
6. Ampicylina z sulbaktamem
Zakażenia pozaszpitalne
- pozaszpitalne zapalanie otrzewnej, stany zapalne miednicy mniejszej w skojarzeniu z
doksycykliną
- zakażenia dróg żółciowych o umiarkowanie ciężkim przebiegu
zakażenia tkanek miękkich i skóry, takich jak: martwicze zakażenia skóry, tkanek miękkich i
mięśni w skojarzeniu z klindamycyną (gdy etiologię może stanowić również Streptococcus
pyogenes -działanie na toksynę) i ciprofloksacyną, zakażenia związane z ukąszeniem , zakażenia
stopy cukrzycowej o umiarkowanym przebiegu
Zakażenia szpitalne
- W terapii empirycznej zbyt wąskie spektrum działania aby zalecać stosowanie
- Terapia celowana: zakażenia o etiologii Acinetobacter baumanii
Dawkowanie
- Najczęstsza dawka ampicyliny z sulbaktamem to: od 3 x 1,5 g iv do 4 x 3 g iv (2 g ampicyliny i
1 g sulbaktamu): w stanach zapalnych miednicy mniejszej 4 x 3 g iv
8
- W ciężkich zakażeniach o etiologii Acinetobacter baumannii antybiotyk powinien być
podawany tak, aby dawka sulbaktamu wynosiła 6 g na dobę, co oznacza, że ampicylina z
sulbaktamem powinna być podawana w dawce 6 x 3 g iv (2 g ampicyliny i 1 g sulbaktamu)
7. Piperacylina z tazobaktamem
Ciężkie pozaszpitalne zapalenie otrzewnej
Szpitalne zapalenie otrzewnej
Szpitalne zapalenie płuc
Gorączka neutropeniczna
Powikłane zakażenia tkanek miękkich i skóry, w tym zakażenia stopy cukrzycowej
Powikłane zakażenia dróg moczowych
Zakażenia powodowane przez Pseudomonas aeruginosa powinny być z reguły leczone
piperacyliną bez tazobaktamu
Z reguły nie powinna być stosowana w leczeniu zakażeń powodowanych przez pałeczki z rodziny
Enterobacteriaceae produkujące ESBL, mimo stwierdzonej wrażliwości, ze względu na ryzyko
powstania oporności w trakcie leczenia; jedynie do rozważenia w zakażeniach układu moczowego
przy wykazanej wrażliwości
Dawkowanie
- W ciężkich zakażeniach: 4 x 4,5 g iv
- W zakażeniach łagodniejszych: 3 x 4,5 g iv
8. Cefuroksym
Pozaszpitalne zakażenia układu oddechowego:
nie powinien stanowić antybiotyku pierwszego rzutu w pozaszpitalnym zapaleniu płuc u
dorosłych oraz u dzieci w innych przedziałach wiekowych niż jak wyżej
zaostrzenie POChP: może stanowić jeden z antybiotyków pierwszego rzutu
Niepowikłane zakażenia układu moczowego:
zapalenie pęcherza: w leczeniu zapaleń pęcherza ma zbyt szerokie spektrum działania i mniej
badań klinicznych potwierdzających jego skuteczność niż kotrimoksazol i nitrofurantoina
odmiedniczkowe zapalenie nerek u poza tym zdrowych kobiet: obecne rekomendacje
zalecają stosowanie w tym wskazaniu cefalosporyny III generacji lub fluorochinolonu
Powikłane zakażenia układu moczowego (zakażenia szpitalne związane z cewnikiem do pęcherza
moczowego, obecnością zaburzeń anatomicznych, schorzeniami nerek, niedoborami odporności,
schorzeniami neurologicznymi wpływającymi na funkcję układu moczowego):
stosowanie cefuroksymu nie jest uwzględniane w rekomendacjach leczenia tych zakażeń
Niepowikłane, pozaszpitalne, zakażenia tkanek miękkich:
większość z nich powodowana jest przez S. aureus i S. pyogenes, dla których cefuroksym nie
jest leczeniem optymalnym; w terapii empirycznej należy stosować cefalosporynę I generacji
Inne zakażenia tkanek miękkich:
w rekomendacjach IDSA z 2005 roku wskazania do cefuroksymu obejmują jedynie zakażenia
związane z ukąszeniami powodowanymi przez zwierzęta lub ludzi
9
brak badań klinicznych jednakże uwzględniona w wytycznych towarzystw naukowych w
umiarkowanym zakażeniu w stopie cukrzycowej
Wtórne zapalenie otrzewnej w skojarzeniu z metronidazolem w zakażeniach o przebiegu
umiarkowanym, lecz nie w zakażeniach ciężkich
Ze względu na zbyt wąskie spektrum działania na bakterie Gram-ujemne i brak wystarczających
badań klinicznych nie powinien być stosowany empirycznie w terapii zakażeń szpitalnych
Dawkowanie
- Łagodne zakażenia: 0,75 g iv co 8 godz.
- Ciężkie zakażenia: 1,5 g iv co 68 godz.
9. Ceftriakson
Zakażenia pozaszpitalne:
ciężkie pozaszpitalne zapalenie płuc w skojarzeniu z makrolidem
pozaszpitalne zapalenie otrzewnej w skojarzeniu z metronidazolem
pierwotne zapalenie otrzewnej
pozaszpitalne odmiedniczkowe zapalenie nerek
Zakażenia szpitalne:
stosowane w terapii empirycznej, gdy zakażenie Pseudomonas aeruginosa i Staphylococcus
aureus jest mało prawdopodobne; nie powinny być stosowane w terapii empirycznej zakażeń
późnych na oddziale intensywnej terapii (konieczne działanie na Pseudomonas aeruginosa)
oraz gdy zakażenie wywodzi się z linii naczyniowej centralnej lub obwodowej (najczęściej
zakażenia gronkowcowe)
można rozważyć w szpitalnym zakażeniu układu moczowego oraz szpitalnym zapaleniu płuc u
pacjentów bez czynników ryzyka zakażenia wieloopornym drobnoustrojem
10. Ceftazydym
Gorączka neutropeniczna, z wyjątkiem sytuacji gdy prawdopodobne jest zakażenie Streptococcus
viridans np. ciężka postać mucositis
Zapalenie płuc u pacjentów leczonych respiratorem: w zależności od sytuacji epidemiologicznej w
oddziale
Zaawansowane stadium zaostrzenia przewlekłej obturacyjnej choroby płuc (wcześniejsze
zakażenia/kolonizacja Pseudomonas aeruginosa)
Stosowany w leczeniu zakażeń o etiologii Pseudomonas aeruginosa w tym bakteriemia, zapalenie
opon mózgowo-rdzeniowych, zakażenie kości, zakażenia układu moczowego; wybór antybiotyku
zależy od MIC
Dawkowanie
- Umiarkowane zakażenia: 1 g iv co 812 godz.
- Ciężkie zakażenia, w tym gorączka neutropeniczna, zapalenie opon mózgowordzeniowych: 2 g iv co 8 godz.
- Zakażenie układu moczowego: 500 mg iv co 812 godz.
10
11. Doksycyklina
Ze względu na wysoką oporność pneumokoków i trudności diagnostyczne zakażeń atypowych
nie jest zalecana do stosowania w leczeniu empirycznym zakażeń dolnych dróg oddechowych
Stany zapalne miednicy mniejszej w dwóch skojarzeniach: ampicylina/sulbaktam iv +
doksycyklina w dawce 2 x 100 mg iv lub w skojarzeniu z ceftriaksonem i metronidazolem
Inne wskazania: borelioza, inne zoonozy – najczęściej w warunkach ambulatoryjnych
12. Ciprofloksacyna
Zakażenia pozaszpitalne:
- może stanowić pierwszy rzut w leczeniu odmiedniczkowego zapalenia nerek oraz
powikłanych zakażeń układu moczowego; zaleca się przeprowadzenie wywiadu dotyczącego
wcześniejszego stosowania chinolonów
- w zaawansowanym stadium zaostrzenia przewlekłej obturacyjnej choroby płuc, w skojarzeniu
z antybiotykiem beta-laktamowym o działaniu na pneumokoki
- zapalenie otrzewnej, w skojarzeniu z metronidazolem
- zakażenie tkanek miękkich: dotyczy zakażeń przewlekłych z dużym ryzykiem zakażenia florą
bakteryjną Gram-ujemną, np. stopa cukrzycowa; empirycznie powinna być stosowana z
antybiotykiem o działaniu na Staphylococcus aureus i często również obejmującym
beztlenowce
Zakażenia szpitalne:
- szpitalne zapalenie płuc w dawce 3 x 400 mg iv na dobę
- szpitalne zakażenie układu moczowego, w tym związane z cewnikiem do pęcherza
moczowego
- ciężka sepsa: w celu poszerzenia spektrum działania antybiotyku beta-laktamowego lub
glikopeptydu i gdy są przeciwwskazania do aminoglikozydu; w dawce 3 x 400 mg iv na dobę
13. Lewofloksacyna
Pozaszpitalne ciężkie zapalenie płuc w skojarzeniu z cefriaksonem
Pozaszpitalne zapalenie płuc oraz zaostrzenie POCHP u pacjentów uczulonych na antybiotyki
beta-laktamowe
Lek z wyboru w leczeniu Legionella pneumophilia
14. Linezolid
Szpitalne i pozaszpitalne zapalenia płuc, w których znanym lub podejrzewanym czynnikiem
chorobotwórczym są bakterie Gram-dodatnie
Powikłane zakażenia skóry i tkanek miękkich: stosowany wyłącznie wtedy, kiedy wyniki badań
mikrobiologicznych wykazały, że zakażenie zostało wywołane przez wrażliwe bakterie Gramdodatnie
Zakażenia wywołane przez enterokoki oporne na wankomycynę, w tym bakteriemia
11
15. Metronidazol
Zachłystowe zapalenie płuc, ropień płuca: najczęściej w skojarzeniu z antybiotykiem betalaktamowym bez inhibitora beta-laktamazy
Zakażenia tkanek miękkich, gdy należy podejrzewać zakażenie beztlenowcami: dotyczy
przewlekłych zmian skórnych ulegających zakażeniu lub martwiczych zapaleń powięzi u
pacjentów z niedokrwieniem kończyny; alternatywnie do klindamycyny; w skojarzeniu głównie z
cefalosporyną III generacji
Eradykacja Helicobacter pylori w skojarzeniu
Zakażenia Clostridium difficile
Stosowanie miejscowe metronidazolu: stosowanie metronidazolu w postaci 1-procentowego
roztworu lub 0,750,80-procentowego żelu jest uzasadnione w przypadku ran cuchnących, gdy
zakażenie powodowane jest najprawdopodobniej przez beztlenowce
Profilaktyka okołooperacyjna w zabiegach, w których powikłania infekcyjne mogą być
powodowane przez bakterie beztlenowe
16. Kotrimoksazol (Biseptol)
Odmiedniczkowe zapalenie nerek: nie powinien być stosowany w terapii empirycznej zakażeń
wymagających hospitalizacji; może być zastosowany jako doustna kontynuacja leczenia po
weryfikacji wyników antybiogramu; w zakażeniach powikłanych wykazano przewagę
fluorochinolonów nad kotrimoksazolem
Szpitalne zakażenia układu moczowego: jedynie w terapii celowanej
Profilaktyka okołooperacyjna zakażeń w zabiegach urologicznych
Zakażenia Stenotrophomonas maltophilia
Bakteriemia: może być stosowany w sytuacjach wyjątkowych, gdy nie można podać innych
antybiotyków, głównie beta-laktamowych; badania kliniczne potwierdzają skuteczność w
leczeniu zakażeń krwi o etiologii Escherichia coli, Klebsiella sp., Proteus, Enterobacter, Yersinia
enterocolitica
Zapalenia płuc o etiologii Pneumocystis jirovecii
Dawkowanie kotrimoksazolu
- Dawkowanie w zakażeniach układu moczowego: najczęściej 2 x 960 mg
- Zapalenie płuc o etiologii Pneumocystis jirovecii: 1520 mg/kg/dobę (wg trimetoprimu) w
34 dawkach podzielonych
- Ciężkie zakażenia Stenotrophomonas maltophilia: dawkowanie podobne jak dla
Pneumocystis jirovecii, tj. ≥ 15 mg/kg/dobę (wyliczane wg trimetoprimu)
- Profilaktyka w zabiegach urologicznych: jednorazowo 960 mg doustnie na 1 godz. przed
zabiegiem
17. Furagin
12
Brak wskazań do stosowania
18. Wskazania do stosowania aminoglikozydów
W monoterapii jako leczenie empiryczne mogą być stosowane jedynie w zakażeniach układu
moczowego, w tym w odmiedniczkowym zapaleniu nerek u pacjenta bez czynników ryzyka
nefrotoksyczności lub gdy antybiogram uniemożliwia stosowanie mniej toksycznych preparatów
W terapii skojarzonej z antybiotykiem beta-laktamowym mogą być stosowane jako terapia
empiryczna cieżkiego zakażenia, jeżeli podejrzewane jest zakażenie szczepem wieloopornym
Stosowanie aminoglikozydów w skojarzeniu jest zalecane w ciężkich zakażeniach o etiologii
Pseudomonas aeruginosa
Mimo małej ilości badań stosowanie aminoglikozydów w skojarzeniu jest zalecane w przypadku
zapalenia wsierdzia o etiologii enterokokowej i gronkowcowej
stosowanie aminoglikozydów jest uzasadnione u noworodków, zarówno w leczeniu zakażeń
wczesnych, jak i zakażeń późnych
Aminoglikozydy należy odstawić po uzyskaniu stabilizacji stanu klinicznego pacjenta lub
uzyskaniu wyniku badania mikrobiologicznego, który daje możliwość zastosowania mniej
toksycznych antybiotyków; dłuższe stosowanie jest zalecane jedynie w bakteryjnym zapaleniu
wsierdzia
Dawkowanie gentamicyny:
- dawkowanie kilka razy na dobę: zalecane jest stosowanie tego dawkowania w przypadku
bakteryjnego zapalenia wsierdzia o etiologii Enterococcus sp. w dawce 3 x 1 mg/kg; w
przypadku zakażeń o etiologii bakterii Gram-ujemnych stosowana jest pierwsza dawka
nasycająca 22,5 mg/kg (3 mg/kg w leczeniu wstrząsu septycznego) i następnie 1,7 mg/kg co
8 godz.; ten sposób dawkowania dotyczy osób dorosłych z klirensem kreatyniny > 90 ml/min;
dawka nasycająca jest niezależna od klirensu kreatyniny i dodatkowo u osób otyłych powinna
być wyliczona wg tzw. idealnej masy ciała; dawka podtrzymująca jest zależna od klirensu
kreatyniny
- dawkowanie raz na dobę: w skojarzeniu z antybiotykiem beta-laktamowym dawkowanie
wynosi 45 mg/kg, natomiast gdy jest stosowana w monoterapii z powodu ciężkiego
zakażenia dawka może wzrastać do 7 mg/kg/dobę; w przypadku bakteriemii powodowanej
przez drobnoustroje Gram-ujemne o MIC ≤ 1 mg/L wystarczające może być dawkowanie 5
mg/kg, natomiast gdy MIC = 2 mg/L, dawka 7 mg/kg może być bardziej skuteczna
Dawkowanie amikacyny:
- dawkowanie dwa razy na dobę: najczęściej amikacyna jest podawana w dawce 7,5 mg/kg co
12 godz.
- dawkowanie jednorazowe: 1520 mg/kg/dobę; w jednym badaniu dotyczącym leczenia
pacjentów w ciężkiej sepsie spwodowanej zakażeniem
wieloopornym szczepem
Pseudomonas aeruginosa, amikacyna była stosowana w jednorazowej dawce dobowej
2550 mg/kg, tak aby uzyskać stosunek maksymalnego stężenia do MIC 810 (Cmax:MIC)
13
19. Wskazania do stosowania makrolidu
Terapia empiryczna
- Ciężkie pozaszpitalne zapalenie płuc w skojarzeniu z ceftriaksonem/cefotaksymem
- Podejrzenie atypowego zapalenia płuc
- Zakażenia układu oddechowego, gdy wymagany jest antybiotyk, a w wywiadzie stwierdzona
nadwrażliwość typu I na antybiotyki beta-laktamowe
Terapia celowana
- Legionella pneumophila: w badaniach na zwierzętach wykazano wyższą skuteczność
azytromycyny w stosunku do innych makrolidów; azytromycyna w tym wskazaniu jest
stosowana w dawce dobowej 500 mg doustnie lub dożylnie przez okres 510 dni
- Mycoplasma pneumoniae
- Chlamydophila pneumoniae
- Bordetella pertussis (krztusiec)
- Eradykacja Helicobacter pylori: klarytromycyna w
skojarzeniu z amoksycyliną lub
metronidazolem i inhibiterem pompy protonowej
- Mycobacterium avium: azytromycyna lub klarytromycyna
20. Klindamycyna
Zakażenia tkanek miękkich powodowane przez gronkowce lub paciorkowce u osób uczulonych na
antybiotyki beta-laktamowe: doustnie: 3 x 300400 mg/dobę, u dzieci: 1020 mg/kg/dobę w 3
dawkach podzielonych
Ciężkie zakażenia Streptococcus pyogenes przebiegające ze wstrząsem toksycznym, w skojarzeniu
z penicyliną, najczęściej wychodzące ze skóry i tkanki podskórnej i martwiczego zapalenia powięzi;
dawkowanie: 3 x 600900 mg/dobę iv
Profilaktyka okołooperacyjna u pacjentów uczulonych na antybiotyki beta-laktamowe w dawce
600-900 mg iv
Zachłystowe zapalenie płuc: w pozaszpitalnym zakażeniu u pacjentów z chorobami około
zębowymi lub alkoholizmem w dawce 3 x 600 mg iv i w skojarzeniu z fluorochinolonem lub
ceftriaksonem
21. Wankomycyna
Leczenie udowodnionych zakażeń powodowanych przez drobnoustroje Gram-dodatnie oporne na
metycylinę (gronkowiec złocisty i gronkowce koagulazoujemne) lub enterokoki oporne na
penicylinę/ampicylinę
Leczenie zakażeń powodowanych przez bakterie Gram-dodatnie u pacjentów, którzy nie mogą
otrzymywać antybiotyków beta-laktamowych
Leczenie ciężkiej postaci Clostridium difficile lub opornej na leczenie metronidazolem
Profilaktyka okołooperacyjna w u pacjentów uczulonych na antybiotyki beta-laktamowe, nosicieli
MRSA
W terapii empirycznej zakażeń związanych z linią naczyniową centralną
Dawkowanie
- dawka 15-20 mg/kg w przeliczeniu na aktualną wagę ciała podawana co 8-12 godz. jest
zalecana u pacjentów z prawidłową czynnością nerek; takie dawkowanie prowadzi do
uzyskania skutecznych stężeń gdy MIC drobnoustroju dla wankomycyny wynosi ≤ 1 mg/L i nie
14
jest wystarczające gdy MIC wynosi ≥ 2 mg/L; dawka jednorazowa nie powinna być większa niż
2g
- u pacjentów z ciężkim zakażeniem należy podać pierwszą dawkę nasycająca w wysokości 2530 mg/kg w przeliczeniu na aktualną wagę ciała ; aby zmniejszyć ryzyko powstania zespołu
czerwonego człowieka należy rozważyć przedłużenie podania dawki nasycającej do 2 godz. i
ewentualnie podać lek antyhistaminowy
dawkowanie doustne w leczeniu Clostridium difficile:
- u dorosłych: 4 x 125-500 mg
- u dzieci : 40mg/kg/dobę w 3 dawkach podzielonych
Oznaczanie stężeń wankomycyny
Wskazania do oznaczenia stężeń wankomycyny we krwi:
bardzo ciężkie zakażenie
niewydolność nerek
stosowanie wankomycyny i innych leków o znacznej nefrotoksyczności
Kiedy pobierać krew na stężenie wankomycyny:
oznaczane jest jedynie stężenie minimalne wankomycyny, tzw. Cthrough, tj. krew jest pobierana
tuż przed podaniem kolejnej dawki
z reguły wystarczający jest jednorazowy pomiar przed podaniem 5. dawki od rozpoczęcia
kuracji
kolejne pomiary należy dokonywać w sytuacjach:
o jeżeli nie zostało uzyskane właściwe stężenie
o gdy zmieniły się parametry czynności nerek
o przy długotrwałej kuracji 1 x w tygodniu
Pożądane wartości Cthrough są zależne od rodzaju zakażenia i lekooporności drobnoustroju (tzw.
MIC-minimalnych stężeń wankomycyny):
stężenia oznaczane są w jednostkach µg/ml lub µmol/L; przelicznik: wynik w µg/ml x 0,69 =
µmol/L
ciężkie zakażenia powodowane przez Staphylococcus aureus opornego na metycylinę
(bakteryjne zapalenie wsierdzia, zakażenie kości i szpiku, zapalenie opon mózgowordzeniowych, szpitalne zapalenie płuc): 1520 µg/ml
inne zakażenia o etiologii MRSA: 1015 µg/ml
inne łagodniejsze zakażenia o etiologii innej niż Staphylococcus aureus: 515 µg/ml
22. Teikoplanina
Jako antybiotyk równoważny do wankomycyny w leczeniu zakażeń o etiologii MRSA, z wyjątkiem
zapalenia opon mózgowo-rdzeniowych
U pacjentów, u których wystąpiły objawy uboczne po wankomycynie
Jako kontynuacja kuracji w warunkach ambulatoryjnych, ze względu na możliwość podawania raz
na dobę i domięśniowo
W przypadku enterokoków opornych na wankomycynę z fenotypem vanB lub vanC
15
Dawkowanie
- Umiarkowane zakażenia (skóra i tkanki miękkie, zakażenia układu moczowego): pierwsza
dawka nasycająca 400 mg iv, następnie 1 x 200 mg/dobę iv
- Ciężkie zakażenia: trzy pierwsze dawki po 400 mg iv podawane w odstępie 12 godz.,
następnie 1 x 400 mg/dobę iv
- U pacjentów ważących > 85 kg dawka podtrzymująca wynosi: umiarkowane zakażenia: 3
mg/kg/dobę, ciężkie zakażenia: 6 mg/kg/dobę
- U pacjentów z bardzo ciężkimi zakażeniami dawka podtrzymująca może dochodzić do 12
mg/kg/dobę
23. Kolistyna
W Polsce aktualnie dostępny jest kolistymetat sodowy (Colistin TZF)
Wskazania do stosowania formy dożylnej wg producenta
W leczeniu ciężkich zakażeń powodowanych przez wrażliwe bakterie Gram-ujemne, w tym sepsy,
zapalenia płuc i zakażenia układu moczowego, gdy ze względu na przeciwwskazania lub brak
skuteczności nie ma możliwości zastosowania innych antybiotyków
Zastosowanie kolistyny w leczeniu zakażeń Acinetobacter baumannii :
Działa bakteriobójczo, skuteczność jest zależna od stężenia
W mechanizmie pomp efluksowych mogą być identyfikowane szczepy oporne
Najczęściej skuteczność w ciężkich zakażeniach jest określana w przedziale 5777%; mniejsza
skuteczność w zapaleniach płuc, ze względu na słabą penetrację: 2561%
Podawanie wziewne
Badania dotyczące pacjentów z mukowiscydozą są bardzo szerokie i dowodzą skuteczności
kolistyny wziewnej stosowanej w okresie zakażeń układu oddechowego
Zdecydowanie mniej badań dotyczy pacjentów ze szpitalnymi zapaleniami płuc, zakażonych
wieloopornymi drobnoustrojami; w jednym z badań uzyskano korzystne efekty, dodając formę
wziewną kolistyny do podawanej już dożylnie w zapaleniach płuc o etiologii Pseudomonas
aeruginosa i Acinetobacter baumannii; kolistyna (preparat taki jak w Polsce) była podawana w
dawce jednorazowej 0,52 mln j.m. co 8 godz. przez 519 dni; w innym badaniu dotyczącym VAP
o etiologii Pseudomonas aeruginosa, Acinetobacter baumannii i Klebsiella sp. wrażliwych tylko na
kolistynę dodanie jej wziewnej formy do formy dożylnej nie zwiększyło skuteczności
terapeutycznej, jednakże badanie to było prowadzone retrospektywnie i na małej grupie
pacjentów
Objawy uboczne
Nefrotoksyczność: w dwóch badaniach na stosowanej dożylnie kolistynie w oddziałach
intensywnej terapii nefrotoksyczność była stwierdzana u 14 i 19% chorych; na próbie 66
pacjentów ostrą niewydolność nerek stwierdzono u 45% chorych, a u 21% kolistyna musiała być
odstawiona; prawdopodobieństwo wystąpienia uszkodzenia nerek było bardziej zależne od
całkowitej dawki kumulatywnej niż od wielkości dawki dobowej; po miesiącu od zakończenia
kuracji poziom kreatyniny wracał do wartości sprzed leczenia
16
Neurotoksyczność: w starych badaniach częstość występowania neurotoksyczności była
określana po podaniu dożylnym na ok. 27%, głównie mająca charakter parestezji
Dawkowanie
Dawkowanie jest zależne od rodzaju preparatu kolistyny, a więc wyniki badań oraz stosowane w
nich dawki różnych preparatów kolistyny należy interpretować z dużą ostrożnością
Dawkowanie dożylne:
wg zaleceń producenta: pacjenci o masie ciała 60 kg: 50 000 j.m./kg/dobę, maksymalnie do
75 000 jm./kg w 3 dawkach podzielonych; pacjenci > 60 kg: 12 mln jm. 3 razy na dobę
istnieją poważne niejasności dotyczące właściwego dawkowania kolistyny i wg niektórych
źródeł podana wyżej dawka jest zdecydowanie zbyt niska, a dawkowanie kolistyny w ciężkich
zakażeniach powinno być podwojone
na uwagę zasługują doniesienia wskazujące na podawanie dawki nasycającej kolistyny, w
szczególności u pacjentów z ciężkim zakażeniem: 9 mln j.m., następnie 4,5 mln j.m. co 12
godz.
Dawkowanie wziewne:
u dorosłych i dzieci > 2. roku życia: 12 mln j.m. 2 razy dziennie
u dzieci < 2. roku życia: 0,51 mln j.m. 2 razy dziennie
Piśmiennictwo
1. Hryniewicz W.: Szpitalna lista antybiotyków. Narodowy Program Ochrony Antybiotyków.
www.antybiotyki.edu.pl
5.KOSZTY LECZENIA POSZCZEGÓLNYMI ANTYBIOTYKAMI
Ceny antybiotyków są zależne od aktualnych przetargów; poniższe ceny są aktualne na styczeń 2012
roku.
Antybiotyk
Acyklowir
iv
po
Amikacyna iv
Amoksycylina po
Amoksycylina z klawulanianem
iv
po
Ampicylina iv
Ampicylina z sulbaktamem iv
Azytromycyna iv
Cefaleksyna po
Cefazolina iv
Cefepim iv
Dawka dobowa
Koszt doby leczenia w zł
3 x 500 mg
4 x 800 mg
1x 1g
3x1g
83
5
9
2
3 x 1,2 g
3 x 625 mg
4 x2 g
4 x 1,5 g
1 x 500 mg
4 x 0,5 g
3x1g
2x2g
10
2
29
153
48
5
5
152
17
Ceftriakson iv
Ceftazydym iv
Cefuroksym
iv
po
Ciprofloksacyna
iv
po
Doksycyklina
iv
po
Ertapenem
Erytromycyna iv
Flukonazol iv, po
iv
po
Gancyklowir iv
Gentamicyna iv
Imipenem iv
Kloksacylina iv
Kolistyna iv
Klarytromycyna po
Klindamycyna
iv
po
Lewofloksacyna
iv
1x2g
3x1g
4
27
3 x 1,5 g
2 x 500 mg
10
4
2 x 200 mg
2 x 500 mg
7
1
1 x 100 mg
1 x 100 mg
1x1g
4 x 0,3 g
6
0,4
186
24
1 x 200 mg
1x200 mg
2 x 250 mg
1x 240 mg
4 x 0,5 g
4 x 2g
3 x 2 mln
2 x500 mg
17
6
217
1
336
13
38
2
3 x 600 mg
4 x 300 mg
17
3
1 x 500 mg
po
1 x 500 mg
Linezolid iv
Metronidazol
iv
po
Meropenem iv
Norfloksacyna po
Oseltamivir po
Penicylina benzylowa iv
Piperacylina iv
Piperacylina/tazobaktam iv
Rifampicyna po
Trimetoprim/sulfametoksazol
iv
po
Teikoplanina iv
Wankomycyna iv
2 x 400 mg
88 (cenna
zmienna)
17
(cena
zmienna)
335
2 x 500 mg
3 x 500 mg
3x1g
2 x 400 mg
1 x 75 mg
4 x 3 mln
4x4g
4 x 4,5 g
1 x 600 mg
10
2
291
1
8
19
193
94
1
2 x 960 mg
2 x 960 mg
1 x 200 mg
2x1g
5
1
186
24
18
bardzo
bardzo
II. Zakażenia układu oddechowego
1. OSTRE ZAPALENIE OSKRZELI I GRYPA
Diagnostyka
Ostre zapalenie oskrzeli rozpoznajemy na podstawie objawów klinicznych, przede wszystkim
kaszlu, któremu mogą towarzyszyć furczenia i świsty
Przy podejrzeniu ostrego zapalenia oskrzeli i niestwierdzeniu objawów, takich jak tachykardia
powyżej 100/min., tachypnoe powyżej 24/min., temperatura ciała powyżej 38°C i ogniskowe
zmiany osłuchowe, dalsza diagnostyka nie jest konieczna
U pacjentów powyżej 75 roku życia, ze względu na częsty brak objawów klinicznych typowych dla
zapalenia płuc, zalecane jest wykonanie badania radiologicznego klatki piersiowej w celu
różnicowania ostrego zapalenia oskrzeli z zapaleniem płuc
U chorych z ostrym zapaleniem oskrzeli, u których stwierdza się świsty, występowanie w ciągu
ostatniego roku napadów duszności lub objawów związanych z ekspozycją na alergeny, zaleca się
wdrożenie diagnostyki w kierunku astmy
Rozpoznanie zakażenia wirusem grypy może być postawione na podstawie badania klinicznego w
okresie epidemicznego wzrostu zachorowań przy wystąpieniu wysokiej gorączki, kaszlu i bólu
głowy
W ostrym zapaleniu oskrzeli rutynowe wykonywanie badań dodatkowych nie jest uzasadnione
Badania w kierunku wirusa grypy należy rozważyć u pacjenta z wysokim prawdopodobieństwem
zachorowania, jeżeli zalecane będzie leczenie grypy lub postępowanie profilaktyczne u osób z
kontaktu, albo jako diagnostyka różnicująca wirusowe i bakteryjne zapalenie płuc; w WCPiT
dostępne są szybkie testy w kierunku grypy oraz badania genetyczne; ze względu na niską
czułość szybkich testów wynik ujemny powinien być potwierdzony w badaniu genetycznym
Leczenie
1. Leczenie ogólne
Nie zaleca się rutynowego stosowania antybiotyku w ostrym zapaleniu oskrzeli lub oskrzelików
Przy kaszlu przedłużającym się powyżej 14 dni może być wskazane podawanie makrolidu,
szczególnie w przypadku podejrzenia krztuśca
Nie zaleca się rutynowego stosowania leków rozszerzających oskrzela (beta2mimetyków lub
cholinolityków) w ostrym zapalaniu oskrzeli ; stosowanie tych leków można rozważyć u osób z
ostrym zapaleniem oskrzeli, u których stwierdzane są świsty, jeśli korzyści z ich stosowania mogą
być większe od ryzyka wystąpienia działań niepożądanych
2. Leczenie grypy sezonowej
Leczenie zakażenia wirusem grypy oseltamiwirem należy zastosować u:
- chorych z czynnikami ryzyka ciężkiego przebiegu grypy
19
- chorych z ciężkim przebiegiem grypy
Oseltamiwir stosuje się terapeutycznie przez 5 dni:
- u osób dorosłych i dzieci ważących powyżej 40 kg:2 x 75 mg na dobę
- dzieci o wadze poniżej 15 kg: 2 x 30 mg na dobę
- dzieci o wadze 15-23 kg: 2 x 45 mg na dobę
- dzieci o wadze 23-40 kg: 2 x 60 mg na dobę
Czas leczenia wynosi 5 dni; leczenie należy rozpocząć w okresie do 48 godz. od początku
objawów; w okresie późniejszym (do 96 godz.) lek można stosować u osób z ciężkim przebiegiem
grypy
Profilaktyka grypy sezonowej
1. Szczepienie przeciwko grypie
Podstawowym środkiem zapobiegającym zakażeniu grypą jest szczepienie
Wskazaniach do szczepienia przeciwko grypie:
- pracownicy służby zdrowia
- osoby > 65 roku życia
- osoby przebywające na stałe w domach opieki społecznej
- dorośli i dzieci z przewlekłymi schorzeniami układu oddechowego
- dorośli i dzieci z przewlekłymi chorobami układu krążenia prowadzącymi do pogorszenia
funkcji hemodynamicznej
- dorośli i dzieci wymagający częstej hospitalizacji z powodu: cukrzycy, niewydolności
nerek, immunosupresji
Przeciwwskazania do szczepienia
- uczulenie na białko jaja kurzego
- reakcja alergiczna po poprzednim szczepieniu
- ostra choroba zakaźna przebiegająca z gorączką
Informacje dodatkowe o szczepieniu
- szczepienie można wykonywać do początku grudnia ( najlepiej w listopadzie)
- nie stwierdzono różnic w skuteczności oraz częstości występowania objawów ubocznych
między szczepionkami
2. Zakaźność grypy i postępowanie z osobą chorą na grypę
Okres zakaźności grypy: 24 godz. przed i do 5 dni po wystąpieniu pierwszych objawów
zakażenia
Zakażenie jest przenoszone drogą kropelkową - obszar szczególnej zakaźności : do 1 m. od
osoby z zakażeniem
Nowo przyjmowani pacjenci z rozpoznaniem grypy w okresie zakaźności:
- jeżeli jest to możliwe nie powinni być przyjmowani do szpitala
- jeżeli są przyjmowani powinni być przyjmowani na salę jednoosobową lub
umiejscawiania na wspólnej sali „grypowej”
Personel nieszczepiony zakłada maskę przy bezpośrednim kontakcie z chorym
Personel medyczny będący w okresie zakaźności nie powinien przebywać w otoczeniu
pacjentów
Personel medyczny proszony jest o zwrócenie uwagi na konieczność ograniczenia odwiedzin
przez osoby z objawami zakażenia dróg oddechowych
20
Proponowane zasady postępowania dotyczą okresu: grudzień - koniec marca lub wg zaleceń
zespołu ds. kontroli zakażeń szpitalnych
3. Profilaktyczne podawanie oseltamiwiru
zaleca się u osób nieszczepionych przeciwko grypie:
- szczególnie podatnych na ciężki przebieg grypy i przebywających w kontakcie domowym z
osobą chorą na grypę ;
- szczególnie podatnych na zakażenie i przebywających w zamkniętych skupiskach, w których
doszło do epidemicznych zachorowań (np. szpital, domy opieki) ;
- szczególnie podatnych na ciężki przebieg grypy, w okresie zwiększonej liczby zachorowań
- w okresie zwiększonej liczby zachorowań na grypę
Oseltamiwir stosuje się profilaktycznie przez 10 dni w dawkach:
- u osób dorosłych i dzieci o wadze powyżej 40 kg: 1 x 75 mg na dobę
- dzieci o wadze poniżej 15 kg: 2 x 30 mg na dobę
- dzieci o wadze 15-23 kg: 2 x 45 mg na dobę
- dzieci o wadze 23-40 kg: 1 x 60 mg na dobę
- Stosowanie profilaktyczne oseltamiwiru nie jest zarejestrowane u dzieci < 1 roku życia.
Piśmiennictwo:
1. Hryniewicz W. i wsp.: Rekomendacje postępowania w pozaszpitalnych zakażeniach układu
oddechowego. Narodowy Program Ochrony Antybiotyków.
2. Antiviral Agents for the Treatment and Chemoprophylaxis of Influenza Recommendations of
the Advisory Committee on Immunization Practices (ACIP), MMWR 2011;60:1
3. Health Protection Agency: Guidance on use of antiviral agents for the treatment and
prophylaxis of influenza, 2011-12 (Wielka Brytania)
4. Centers for Diseases Control: Influenza Antiviral Medications: A Summary for Clinicians:
2011-2012
2. ZAOSTRZENIE PRZEWLEKŁEJ OBTURACYJNEJ CHOROBY PŁUC POSTĘPOWANIE W DIAGNOSTYCE I TERAPII ZAKAŻENIA JAKO PRZYCZYNA
ZAOSTRZENIA POCHP
Etiologia
Zakażenie, zarówno bakteryjne jak i wirusowe są przyczyna ok. 70-80% zaostrzeń POChP [1];
Zakażenia bakteryjne są najczęściej powodowane przed drobnoustroje: Haemophilus influenzae,
Moraxella catarrhalis i Streptococcus pneumoniae ; zaostrzenie POCHP jest najczęściej związane z
nabyciem nowego drobnoustroju [2]; drobnoustroje atypowe bardzo rzadko są przyczyną
zaostrzeń (<5%) [3,4];
Pseudomonas aeruginosa: może stanowić etiologię zaostrzeń w przypadku pacjentów z
określonymi czynnikami ryzyka, do których należą [1]: hospitalizacja w ciągu ostatnich 90 dni,
częsta antybiotykoterapia ( ≥ 4 kursów w ciągu ostatniego roku), ciężkie POChP (FEV1 < 50%
21
wartości przewidywalnej), wcześniejsza izolacja Pseudomonas aeruginosa i stosowanie sterydów
doustnych
Inne bakterie Gram-ujemne: stanowią rzadką przyczyną zaostrzeń, przede wszystkim w
zawansowanym stadium choroby, a ich izolacja może być jedynie przejawem kolonizacji dróg
oddechowych [5]
Diagnostyka mikrobiologiczna
Posiew plwociny lub popłuczyn oskrzelowych nie powinien być rutynowo wykonywany przy
przyjęciu pacjenta z zaostrzeniem POChP gdyż: 1) drobnoustroje bakteryjne najczęściej
powodujące zaostrzenie POChP rzadko identyfikowane są w posiewie plwociny, 2) w posiewie
plwociny częściej identyfikowane są bakterie, które przewlekle kolonizują drogi oddechowe i nie
powodują zaostrzeń [6]
Posiew plwociny należy wykonać w dwóch grupach chorych [6,7]:
o gdy obraz kliniczny i badania dodatkowe wskazują na zakażenie bakteryjne i pacjent nie
reaguje na leczenie właściwymi antybiotykami
o gdy stwierdzane są czynniki ryzyka do zakażenia Pseudomonas aeruginosa, wymienione
wyżej
Wynik posiewu plwociny należy interpretować z ostrożnością gdyż ujemny wynik nie oznacza, że
przyczyną zaostrzenia nie jest zakażenia bakteryjne a dodatni wynik może zarówno identyfikować
etiologię zakażenia lub oznaczać jedynie kolonizację, która nie wymaga leczenia antybiotykami,
dotyczy w szczególności pałeczek gram ujemnych
W okresach epidemicznych dla grypy zalecane jest wykonanie badania w kierunku grypy u
pacjentów, u których obraz kliniczny i/lub badania dodatkowe mogą wskazywać na zakażenie
wirusowe
CRP i leukocyty w różnicowaniu zakażenia bakteryjnego jako przyczyna zaostrzenia POCHP
Znaczenie CRP w określaniu zakażenia bakteryjnego jako przyczyny zaostrzenia POCHP: nie
określono jakie wartości CRP wskazują na zakażenie bakteryjne [8]; u pacjentów z POChP w
stanie stabilnym CRP jest większe niż w grupie kontrolnej średnio ok. 2-krotnie [9]; w jednym z
badań stwierdzono że pacjenci z zaostrzeniem POChP i obrazem klinicznym nie wskazującym na
zakażenia bakteryjne (bez ropnej plwociny) mieli CRP średnio 8 mg/L ( 3-16 mg/L) a pacjenci z
ropna plwociną średnio 45 mg/l (8,5-86 mg/l) [10]
Poziom leukocytów: w jednym badaniu nie stwierdzono różnic w wielkości wzrostu leukocytów u
pacjentów z różnymi postaciami zaostrzenia POChP tj. gdy obraz kliniczny nie wskazywał lub
wskazywał na zakażenia bakteryjne, jak również między zaostrzeniem POChP (9-14 x 10 6/L) i
zaostrzeniem POChP z towarzyszącym zapaleniem płuc ( 10-17 x 106 /) [10]
Wskazania do stosowania antybiotyków [6]
Stosowanie antybiotyków przynosi efekty w niektórych postaciach zaostrzenia POCHP, nie
przynosi efektu w zaostrzeniach o przebiegu łagodnym
22
Wg GOLD wskazania do stosowania antybiotyku obejmują [2]: 1) zaostrzenie POChP wymagające
zastosowania wentylacji mechanicznej, 2) zaostrzenie przebiegające ze wzrostem charakteru
ropnego plwociny i co najmniej jeden z dwóch parametrów: wzrost objętości plwociny lub wzrost
duszności
Wybór antybiotyku u pacjentów hospitalizowanych z zaostrzeniem POCHP [6,11]
Bez czynników ryzyka rozumianych jako: wiek < 65 lat, FEV1 > 50%, < 3 zaostrzeń /rok, bez
towarzyszących schorzeń sercowych: cefuroksym 2 x 500 mg po lub 3 x 1,5 g iv lub
amoksycylina z klawulanianem 3 x 625 mg + 500 mg amoksycylina po
Czynniki ryzyka : wiek > 65 lat, FEV1 < 50%, ≥ 3 zaostrzenia/rok, towarzyszące schorzenia
sercowe: ceftriakson 1 x 2 g iv lub lewofloksacyna 1 x 750 mg po lub iv ;
jeżeli czynniki ryzyka do zakażenia Pseudomonas aeruginosa: amoksycylina z klawulanianem
+ ciprofloksacyna, lub ceftazydym 3 x 1 g iv lub lewofloksacyna 1 x 750 mg;
Czas leczenia
Czas leczenia z reguły powinien wynosić 3-7 dni; kuracja dłuższa niż 5 dni nie przynosi
korzyści a zwiększa ryzyko objawów ubocznych [12]
Piśmiennictwo
1. Sapey E.: COPD exacerbations . 2: aetiology. Thorax 2006; 61:250.
2. Sethi S, Wrona C, Grant BJ, et al. New strains of bacteria and exacerbations of chronic obstructive
disease. N Engl J Med 2002;347:465–71.
3. Blasi F, Legnani D, Lombardo VM, et al. Chlamydia pneumoniae infection in acute exacerbations
of COPD. Eur Respir J 1993; 6:19.
4. Smith C.: Associtaion of viral and Mycoplasma pneumoniae infections with acute respiratory
illness in patients with chronic obstructive pulmonary disease. Am Rev Respir Dis 1980;121:225
5. Hirschmann J.: Do bacteria cause exacerbations of COPD. Chest 2000;118:193-203
6. Global strategy for the diagnosis, management and prevention of COPD, Global Initiative for
Chronic Obstructive Lung Disease (GOLD) 2007
7. Snow V, Lascher S, Mottur-Pilson C, Joint Expert Panel on Chronic Obstructive Pulmonary Disease
of the American College of Chest Physicians and the American College of Physicians-American
Society of Internal Medicine. Evidence base for management of acute exacerbations of chronic
obstructive pulmonary disease. Ann Intern Med 2001; 134:595.
8. Lacoma A.: Biomarkers in the management of COPD. Eur Resp Rev 2009;18:96-104
9. Gan WQ, Man SF, Senthilselvan A, et al. Association between chronic obstructive pulmonary
disease and systemic inflammation: a systematic review and a metaanalysis. Thorax 2004; 59:
574–580.
10. Weis N, Almdal T. C-reactive protein – can it be used as a marker of infection in patients with
exacerbation of chronic obstructive pulmonary disease? Eur J Intern Med 2006; 17: 88–91.
11. Sethi S.: Acute exacerbationsa of chornic bronchitis. Infect Dis Clin North Am 2004;18: 861
12. Falagas ME, Avgeri SG, Matthaiou DK, et al. Short- versus long-duration antimicrobial treatment
for exacerbations of chronic bronchitis: a meta-analysis. J Antimicrob Chemother 2008; 62:442.
23
Rekomendacje:
1. Hryniewicz W. i wsp.: Rekomendacje postępowania w pozaszpitalnych zakażeniach układu
oddechowego. Narodowy Program Ochrony Antybiotyków. 2010. www.antybiotyki.edu.pl
2. European Respiratory Society and European Society for Clinical Microbiology and Infectious
Diseases Guidelines for the management of adult lower respiratory tract infections , Clin
Microbiol Infect 2011;17;suppl 6: E1-59
3. Zalecenia Polskiego Towarzystwa Chorób Płuc rozpoznawania i leczenia przewlekłej
obturacyjnej choroby płuc (POChP) Pneumonol. Alergol. Pol. 2010; 78, 5: 318–347
3.DIAGNOSTYKA ZAKAŻENIA I STOSOWANIE ANTYBIOTYKÓW U PACJENTÓW
Z ROZSTRZENIAMI OSKRZELI
Diagnostyka
Badania diagnostyczne prowadzone w kierunku obecności zakażenia u pacjenta, u którego
rozpoznawane są rozstrzenia oskrzeli
U osób powyżej 50 roku życia, przebyte zakażenie jest przyczyną 28-52% rozstrzeni oskrzeli
[1,2,3]
Zalecane jest wdrożenie diagnostyki w kierunku alergicznej postaci aspergilozy oskrzelowopłucnej gdy nie zostały rozpoznane inne przyczyny rozstrzeni i/lub gdy stwierdzane są w
badaniu HRCT centralnie położone rozstrzenia; diagnostyka polega na oznaczenie specyficznych
dla Aspergillus sp. IgE i IgG w surowicy [4]; alergiczna postać aspergilozy oskrzelowo- płucnej
może być przyczyną do 10% rozstrzeń oskrzeli [1]
W przypadku zaostrzenia zalecane jest wykonanie badań w kierunku postaci alergicznej
apsergillozy oskrzelowo płucnej jeżeli nie były wykonane wcześniej lub nie wykazywały odchyleń
w okresie bez zaostrzeń; zalecane jest oznaczenie poziomu IgE, IgE specyficznego dla Aspergillus
sp. oraz testu skórnego dla Aspergillus sp.
Badanie mikrobiologicznego plwociny powinno być wykonane u wszystkich pacjentów, u których
rozpoznawane są rozstrzenia oskrzeli; należy rozważyć zastosowanie nebulizacji z
hypertonicznym roztworem soli fizjologicznej w celu zwiększenia jakości materiału lub
wykonanie bronchoskopii; plwocina na badanie powinna być pobrany trzy razy w kolejne dni
jeżeli w pierwszym materiale nie uzyskano wzrostu drobnoustrojów chorobotwórczych; materiał
powinien zostać dostarczony do laboratorium w ciągu < 3 godz. od pobrania
Materiał na badane mikrobiologiczne powinie być pobrany przy każdym epizodzie zaostrzenia,
przed podaniem antybiotyku
Diagnostyka w kierunku Mycobacterium sp. należy wdrożyć gdy: 1) stwierdzane są objawy
ogólne: gorączka, poty, utrata wagi , bez identyfikacji innych przyczyn, 2) nowy naciek lub jama
która nie ustępuje w wyniku leczenia antybiotykami, 3) niewyjaśnione pogorszenie które nie
reaguje na tradycyjne leczenie, 4) stwierdzenie niedoborów odporności lub zakażenia
Pneumocystis carinii, 5) kobiety w średnim lub zawansowanym wieku z kaszlem i obrazem
radiologicznym wskazującym na rozstrzenia); prątki niegruźlicze mogą być stwierdzane do 10%
chorych z rozstrzeniami oskrzeli [5]
24
Stosowanie antybiotyków
1. Zaostrzenia choroby
Zastosowanie antybiotyku jest zalecane w okresie zaostrzenia, które występuje nagle ( w ciągu
kilku dni) z pogorszeniem objawów ze strony układu oddechowego (kaszel, wzrost ilości
wydzieliny, pojawienie się charakteru ropnego plwociny); obecność jedynie ropnej plwociny nie
jest wskazaniem do zlecenia antybiotyku nawet w przypadku dodatnich posiewów w badaniu
mikrobiologicznym
Przed zastosowaniem antybiotyku należy pobrać plwocinę na badane mikrobiologiczne
Jeżeli wcześniejsze wyniki badań mikrobiologicznych nie wskazują na konieczność wyboru innego
antybiotyku to zalecane jest podanie amoksycyliny 3 x 0,5-1 g po lub amoksycyliny z
klawulanianem 3 x 625 mg po lub cefuroksymu 3 x 1,5 g iv lub 2 x 500 mg po
W przypadku wcześniejszego stwierdzenia Pseudomonas aeruginosa zalecane jest dodanie
ciprofloksacyny w dawce 2 x 500-750 mg po lub zastosowanie innego antybiotyku
antypseudomonasalnego w zależności od antybiogramu
Wynik badania mikrobiologicznego plwociny jest wskazaniem do modyfikacji antybiotykoterapii
tylko gdy brak jest poprawy klinicznej i stwierdzany jest drobnoustrój oporny na zastosowany
wcześniej antybiotyk
Jeżeli brak jest poprawy po zastosowaniu antybiotyku zalecane jest ponowne pobranie materiału
na badanie mikrobiologiczne
Nie jest zalecane rutynowe stosowanie dwóch antybiotyków
W przypadku zakażenia o etiologii Pseudomonas aeruginosa zalecana jest analiza wcześniejszych
antybiogramów i stosowanie antybiotyków zaznaczonych w rozdziale: leczenie zakażeń układu
oddechowego wg zidentyfikowanego drobnoustroju
Czas stosowania antybiotyków ok. 14 dni, brak jest dowodów na to, że krótsza
antybiotykoterapia jest skuteczna [6]
2. Profilaktyczne podawanie antybiotyków w okresach między zaostrzeniami
Profilaktyczne podawania antybiotyku należy rozważyć u pacjentów, u których stwierdzane są ≥ 3
zaostrzenia w ciągu roku wymagające antybiotykoterapii lub przy mniejszej ilości zaostrzeń ale
przebiegające bardzo ciężko; wybór antybiotyku zależny jest od wyniku badania
mikrobiologicznego z materiału pobranego w okresie stabilizacji choroby; nie należy stosować
przewlekle fluorochinolonów [4]
U pacjentów kolonizowanych Pseudomonas aeruginosa, u których stwierdzane są ≥ 3 zaostrzenia
w ciągu roku wymagające antybiotykoterapii, należy rozważyć profilaktyczne stosowanie
nebulizacji z kolistyną w dawce 1-2 mln w 2 ml soli fizjologicznej [7]
Piśmiennictwo
1. Pasteur M.: An investigation into causative factors in patients with bronchiectasis. Am J
Respir Crit Care Med 2000;162:1277-84.
2. Nicotra M.: Clinical, pathophysiologic, and microbiologic characterization of bronchiectasis in
an aging cohort, Chest 1995;108:955-61.
3. Kelly M.: Bronchiectasis in secondary care a comprehensive profile of a neglected disease,
Eur J Intern Med 2003;14:488-92
25
4. Guideline for non-CF bronchiectasis, British Thoracic Society Bronchiectasis (non-CF)
Guideline Group, Thorax 2010; 65;suppl 1
5. Fowler S.: Nontuberculous mycobacteria in bronchiectasis: prevalence and patient
characteristics Eur Respir J 2006; 28: 1204–1210
6. Wurzel D.: Short courses of antibiotics forchildren and adults with bronchiectasis. Cochrane
Database of Systematic Reviews 2011, Issue 6. Art. No.: CD008695. DOI:
10.1002/14651858.CD008695.pub2.
7. Steifnort D.: Effect of long-term nebulized colistin on lung function and quality of life in
patients with chronic bronchial sepsis, Internal Medicine Journal 37 (2007) 495–498
4. POZASZPITALNE ZAPALENIE PŁUC
Diagnostyka mikrobiologiczna u pacjenta przyjmowanego do WCPiT
Zalecane jest wykonanie dwóch posiewów krwi u pacjentów z ostrymi objawami
choroby
Torakocenetza z badaniem mikrobiologicznym powinno być wykonane u pacjentów
ze znacznym wysiękiem opłucnowym
Badanie plwociny: zalecane wykonanie u pacjentów zdolnych od odkrztuszenia
ropnej plwociny; wykonywane jest barwienie metodą Grama a przeprowadzenie
posiewu zależne jest od wyniku preparatu Grama
Antygen Streptococcus pneumoniae w moczu w przypadku ciężkiego zapalenia płuc
Antygen Legionella pneumophila w moczy w przypadku ciężkiego zapalenia płuc lub
gdy brak jest odpowiedzi na leczenie antybiotykami beta-laktamowymi
Nie jest zalecane rutynowe wykonywanie badań serologicznych w kierunku
Mycoplamsa pneumoniae i Chlamydia pneumoniae; w wyjątkowych sytuacjach np.
pacjenta z zapaleniem płuc nie odpowiadającym na leczenia antybiotykiem betalaktamowym należy rozważyć równoczesne zastosowanie oznaczenia poziomu IgG,
IgM oraz badań PCR
Antybiotykoterapia
1. Leczenie ambulatoryjne (pozaszpitalne)
Leczenie pozaszpitalnego zapalenia płuc zawsze powinno obejmować Streptococcus
pneumoniae i odbywa się głównie przy zastosowaniu amoksycyliny.
Ze względu na coraz częstsze występowanie szczepów o zmniejszonej wrażliwości
na penicylinę zalecane jest stosowanie amoksycyliny w dawce 3 x 1 g p/o
U pacjentów z wywiadem reakcji uczuleniowej typu I na penicyliny: lewofloksacyna
2. Leczenie szpitalne
stan pacjenta nie jest ciężki, możliwe leczenie doustne: amoksycylina 3 x 1 g po
stan pacjenta nie jest ciężki, konieczne zastosowanie leczenia parenteralnego:
ampicylina 4 x 1 g makrolid iv (azytromycyna iv lub klarytromycyna po)
stan pacjenta ciężki: ceftriakson 1 x2 g iv + azytromycyna 1 x 500 mg iv lub
lewofloksacyna 1 x 750 mg iv
26
3. Czas kuracji
- Czas leczenia zależy głównie od etiologii zakażenia i najczęściej, gdy etiologię
zakażenia stanowi Streptococcus pneumoniae wynosi ok. 3 dni od momentu
normalizacji temperatury ciała i stabilizacji stanu klinicznego (całkowity czas kuracji
ok. 7 dni)
- Zakażenia powodowane przez drobnoustroje atypowe powinny być leczone nie
krócej niż 14 dni
- Dłuższego leczenia wymagają również zapalenia płuc powodowane przez
Staphylococcus aureus
Piśmiennictwo
1. Hryniewicz W. i wsp.: Rekomendacje postępowania w pozaszpitalnych zakażeniach układu
oddechowego. Narodowy Program Ochrony Antybiotyków. 2010. www.antybiotyki.edu.pl
2. European Respiratory Society and European Society for Clinical Microbiology and Infectious
Diseases Guidelines for the management of adult lower respiratory tract infections , Clin
Microbiol Infect 2011;17;suppl 6: E1-59
3. Guidelines for the management of community acquired pneumonia in adults: update 2009
British Thoracic Society Community Acquired Pneumonia in Adults .Guideline Group. Thorax
2009;64;suppl III:
4. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on
the Management of Community-Acquired Pneumonia in Adults. Clin Infect Dis2007;44: S2772
5. NIEPOWODZENIA TERAPEUTYCZNE W ZAPALENIU PŁUC
1. Rodzaje niepowodzeń terapeutycznych [1]
Powolnie ustępujące zapalenie płuc: opóźnienie ustępowania klinicznych objawów zapalenia płuc
oraz odchyleń radiologicznych, pacjent jest stabilny klinicznie
Nieustępujące zapalenie płuc: utrzymywanie się odchyleń w badaniu radiologicznym, pacjent jest
stabilny klinicznie
Niereagujące lub postępujące zapalenie płuc: pogorszenie obrazu klinicznego związanego z
zapaleniem płuc, pacjent jest niestabilny klinicznie
2. Prawidłowa reakcja na skuteczne leczenie zapalenia płuc
Średni czas potrzebny do stwierdzenia poprawy ustępowania objawów lub odchyleń [2]
Gorączka 2-4 dni
Kaszel 4-9 dni
Trzeszczenia: 3-6 dni
Leukocytoza 3-4 dni
CRP 1-3 dni
Na próbie 1424 chorych z pozaszpitalnym zapaleniem płuc przyjmowanych do szpitala czas potrzebny
do uzyskania stabilności klinicznej (normalizacja temperatury, , tętno < 100/min, liczba oddechów
27
24/min, saturacja tlenem > 90%, ciśnienie skurczowe krwi > 90 mmHg) wynosił średnio 4 dni i
następował wyraźnie później u pacjentów z niewydolnością nerek , niewydolnością krążenia,
przewlekłym zapaleniem oskrzeli, , splątaniem i wielopłatowym zapaleniem [3]
3. Ustępowanie zmian w obrazie radiologicznym w pozaszpitalnym zapaleniu płuc
a) Zapalenie płuc o etiologii Streptococcus pneumoniae [4], dane zaprezentowane jako odsetek
pacjentów, u których stwierdzane jest ustąpienie zmian zapalnych w kolejnych tygodniach
od początku zakażenia
b) Ustępowanie zmian w RTG w zależności od etiologii zapalenia płuc [5], dane zaprezentowane jako
odsetek pacjentów, u których stwierdzane jest ustąpienie zmian zapalnych w kolejnych tygodniach
od początku zakażenia
28
4. Częstość występowania niepowodzenia terapeutycznego u hospitalizowanych pacjentów z
poazszpitalnym zapaleniem płuc
Opóźnienie reakcji na leczenie , rozumiane jako wolniejsze ustępowanie objawów lub zmian w
RTG jest stwierdzane u 10-20% pacjentów hospitalizowanych z powodu pozaszpitalnego
zapalenia płuc
U ok. 10% hospitalizowanych pacjentów z powodu pozaszpitalnego zapalenia płuc dochodzi do
progresji objawów klinicznych
5. Interpretacja pogorszenia obrazu radiologicznego w badaniu kontrolnym pozaszpitalnego
zapalenia płuc:
W badaniu kontrolnym wykonanym 4 tygodnie od przyjęcia do szpitala często stwierdzane jest
pogorszenie obrazu radiologicznego mimo skutecznego leczenia ocenionego na podstawie
obrazu klinicznego
Tabela. Częstość pogorszenia kontrolnego obrazu radiologicznego, wykonanego po 4 tygodniach,
stwierdzanego u pacjentów hospitalizowanych z powodu pozaszpitalnego zapalenia płuc, w
zależności od jego etiologii [5]
Drobnoustrój
Legionella sp.
S.pneumoniae
bakteriemią
S.pneumoniae
bakteriemii
Mycoplasma
pneumoniae
Liczba
pacjentów Progresja w
samym płacie
46
20 (42)
z 27
6 (22)
bez 57
44
Liczba pacjentów ( %)
tym Progresja
do
innych płatów
12 (26)
6 (22)
6 (10)
5 (9)
3 (7)
3 (7)
Progresja
do
drugiego płuca
13 (28)
6 (22)
5 (9)
1 (2)
6. Niepowodzenie terapeutyczne w pozaszpitalnym zapaleniu płuc: niereagujące lub postępujące
zapalenie płuc ostry obraz kliniczny
Niepowodzenie terapeutyczne definiowane jest jako [6]
- Wczesne: pogarszanie obrazu klinicznego w ciągu 72 godz. od wdrożenia leczenia ;
- Późne: pogorszenie obrazu klinicznego po 72 godz. od wdrożenia leczenia
W tej grupie chorych śmiertelność wzrasta kilkukrotnie i może sięgać 50% [6]
29
Brak reakcji na antybiotyki występuje u 5-15% hospitalizowanych z powodu pozaszpitalnego
zapalenia płuc [7,8]
Przyczyny niepowodzenia wczesnego
- Ciężkie zakażenie od początku
- Nietrafiony antybiotyk: oporność drobnoustroju, brak pokrycia w spektrum
- Obecność zakażenia przerzutowego lub powikłań infekcyjnych: ropniak opłucnej,
zapalenie wsierdzia , obecność ropni przerzutowych w układzie kostno stawowym,
mięśni biodrowo-lędźwiowych itp.
- Niewłaściwa diagnoza: zator płucny, zachłyśnięcie, vasculitis
Przyczyny niepowodzenia późnego:
- Nadkażenie drobnoustrojami szpitalnymi
- Pogorszenie schorzeń towarzyszach: niewydolność krążenia, niewydolność nerek
- Wystąpienie innych schorzeń w trakcie hospitalizacji: zatorowość płucna, zawał serca
Tabela. Przyczyny niepowodzenia w pozaszpitalnym zapaleniu płuc wg BTS [10]
Grupy przyczyn
1. Niewłaściwa diagnoza
Przyczyny
Częste
Rzadkie
Zator/zawał płuca, obrzęk płuc, rak płuca, rozstrzenia
Eozynofilowe zapalenie płuc, krwotok pęcherzykowy, ciało
obce, kryptogenne zapalenie płuc, wrodzone wady
2. Drobnoustrój oporny na Drobnoustroje atypowe, pneumokok o wysokiej oporności na
penicylinę, MRSA
zastosowany antybiotyk
3. Niewłaściwe zastosowanie Zbyt niska dawka, pacjent nie pobrał antybiotyku
antybiotyku
lokalne lub Lokalne: rozstrzenia, obstrukcja oskrzela, aspiracja
układowe
układu Ogólne: neutropenia , HIV, sterydoterapia
odpornościowego
4. Zaburzenia
5. Lokalne lub ogólne
powikłania zapaleni płuc
Płucne: wysięk opłucnowy/ropniak, ropień płuca, ARDS
Pozapłucne: zakażenia przerzutowe, sepsa,
7. Postępowanie w niepowodzeniu wczesnym gdy należy podejrzewać, że przyczyną
niepowodzenia jest niewłaściwie dobrany antybiotyk: należy zawsze różnicować z przyczynami
nie-infekcyjnymi
1)
Ocena miejsca nabycia zakażenia w trzech aspektach: należy przeprowadzić wywiad, którego celem
jest weryfikacja miejsca nabycia zakażenia w trzech możliwościach:
Zakażenie pozaszpitalne
Zakażenie szpitalne
Zakażenie związane z zakładami opieki zdrowotnej (są to zakażenia identyfikowane przy przyjęciu
do szpitala, do których doszło w wyniku kontaktu z zakładami opieki zdrowotnej
30
Kiedy należy rozpoznawać lub podejrzewać zakażenia związane z ZOZ oraz jaką należy
podejrzewać etiologię [7]:
a) Domy opieki: etiologia: 1) pałeczki Gram-ujemne, 2) S .pneumoniae, 3) H. influenzae, 4) S.
aureus
b) Pacjent dializowany: etiologia : 1) S. pneumoniae, 2) Pseudomonas aeruginosa, 3)
Klebsiella sp., 4) H. influenzea;
c) Pacjent niedawno hospitalizowany ( < 1 miesiąca)
2)
Ocena możliwości zakażenia oportunistycznego – patrz rozdział „Zapalenia płuc u pacjentów z
niedoborami odporności”
3)
Weryfikacja dotychczasowych badań mikrobiologicznych i poszerzenie diagnostyki mikrobiologicznej
Należy dokonać przeglądy dotychczasowych wyników badań mikrobiologicznych oraz rozważyć
poszerzenie zakresu diagnostyki
1) Antygen Legionella sp. w moczu
2) Posiewy krwi 2-6 pobrań
3) Posiew plwociny
4) Posiew płynu z opłucnej
5) Antygen S. pneumoniae w moczu
6) Badania w kierunku grypy
4)
Inne badania do rozważenia [6]
Tomografia komputerowa klatki piersiowej
Bronchoskopia
Torakocenteza
5)
Modyfikacja antybiotykoterapii
Stosowanie antybiotyków tzw. drugiego rzutu w zapaleniu płuc nie było przedmiotem badań i
wytycznych towarzystw naukowych i jest trudna do ustalenia.
Można przyjąć poniższe założenia:
1) Należy przeprowadzić analizę wcześniejszej antybiotykoterapii: czas trwania i dawki
antybiotyku.
Pierwsza możliwość: zakażenia pozaszpitalne
Jeżeli w dotychczasowej terapii nie stosowano optymalnego leczenia w kierunku
pneumokoków np.: makrolidy, doksycyklina, biseptol, aminoglikozydy, cefalosporyny I
generacji, cefuroksym, niskie dawki amoksycliny (3 x 500 mg) należy rozważyć zastosowanie
ceftriaksonu 1 x 2 g iv opcjonalne z klarytromycyną lub azytromycyną (jeżeli nie stosowano
wcześniej antybiotyków skutecznych wobec zakażeń atypowych
Jeżeli w dotychczasowej terapii zastosowano optymalne antybiotyki w leczeniu zakażeń
pneumokokowych należy rozważyć zastosowanie lewofloksacyny 1 x 750 mg z wankomycyną
2 x 1 g iv
31
Druga możliwość: Zakażenia z prawdopodobną etiologią drobnoustrojów bardziej opornych na
antybiotyki (pacjent z domu opieki, niedawno wypisany ze szpitala):
Ceftriakson 1 x 1 g iv ± ciprofloksacyna 2 x 400 mg iv
Lewofloksacyna 1 x 750 mg
Ceftazydym 3 x 1 g iv
8. Powolnie ustępujące zapalenie płuc lub nieustępujące zapalenie płuc
Najczęściej definiowane jest jako utrzymywanie się zmian zapalnych poza spodziewany okres czasu .
Spodziewany okres czasu nie został jasno określony ale często jest określany jako nieustalenie zmian
radiologicznych badaniu radiologicznym powyżej 30 dni [11].
W tak zdefiniowanym nieustępującym zapaleniu płuc aż 30% pacjentów hospitalizowanych z powodu
zapalenia płuc może spełniać jego kryteria [11]. Z tego powodu pierwszym krokiem w analizie tych
przypadków jest identyfikacja czynników ryzyka do opóźnienia ustępowania odchyleń w badaniu
radiologicznym [12]. Do tych czynników należą głównie wiek chorego , wyjściowa ciężkość zakażenia
oraz choroby towarzyszące [13]
Dalsza diagnostyka nieustępującego zaplenia płuc opiera się na tomografii komputerowej,
bronchoskopii, biopsji przezklatkowej [13,14]
9. Analiza przyjęć pacjentów do WCPiT otrzymujących wcześniej antybiotyki – analiza rozpoznań
ostatecznych
Okres badany 7.01-3.02.2009
Liczba pacjentów przyjętych , którzy otrzymywali antybiotyk = 74 tj. ok. 8% wszystkich
przyjętych pacjentów
Rozpoznania przy przyjęciu
Pobierane antybiotyki
32
Rozpoznania ostateczne stawiane w WCPiT
Piśmiennictwo:
1. Fein, A. M., and S. H. Feinsilver. 1995. Nonresolving and slowly resolving pneumonia. In S. H.
Feinsilver and A. M. Fein, editors. Textbook of Bronchoscopy. Williams & Wilkins, Philadelphia,
286–301.
2. Ost D.: Nonresolving pneumonia. UpToDate 2012
3. Menendez R.: . Reaching Stability in Community-Acquired Pneumonia: The Effects of the Severity
of Disease Treatment, and the Characteristics of Patients Clin Infect Dis 2004;39:1783-90
4. ay S.: The radiographics resolution of Streptococcus pneumonia. N Eng J Med 1975;293:798-801
5. Macfarlane J.: Comparative radiographics fetaures of community acquired legionnaires disease,
pneumococcal pneumonia , mycoplasma pneumonia,and psitaccosis. Thorax 1984;39: 28-33
6. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the
Management of Community-Acquired Pneumonia in Adults. Clin Infect Dis 2007;44: S27-72
7. Arancibia F, Ewig S, Martinez JA, et al. Antimicrobial treatment failures in patients with
community-acquired pneumonia: causes and prognostic implications. Am J Respir Crit Care Med
2000; 162:154–160
33
8. Roson B, Carratala J, Fernandez-Sabe N, Tubau F, Manresa F, Gudiol F. Causes and factors
associated with early failure in hospitalized patients with community-acquired pneumonia. Arch
Intern Med 2004; 164:502–8.
9. Kolef M.: Health Care–Associated Pneumonia (HCAP): A Critical Appraisal to Improve
Identification, Management, and Outcomes—Proceedings of the HCAP Summit, Clin Infect Dis
2008;46: S269-334
10. Guidelines for the management of community acquired pneumonia in adults: update 2009
British Thoracic Society Community Acquired Pneumonia in Adults .Guideline Group. Thorax
2009;64;suppl III:
11. Mittl RL Jr, Schwab RJ, Duchin JS, Goin JE, Albeida SM, Miller WT. Radiographic resolution of
community-acquired pneumonia. Am J Respir Crit Care Med 1994; 149:630–5.
12. Kyprianou A, Hall CS. The challenge of nonresolving pneumonia: Knowing the norms of
radiographic resolution is the key. Postgraduate medicine 2003; 113:42-90.
13. Rome l.: Nonresolving pneumonia and mimics of pneumonia. Med Clin North Am2001;85:1511
14. Kuru T.: Nonresolving or slowly resolving pneumonia. Clin Chest Med 1999; 20:3
6. SZPITALNE ZAPALENIE PŁUC ORAZ ZAPALENIE PŁUC ZWIĄZANE Z
ZAKŁADAMI OPIEKI ZDROWOTNEJ
Definicje
Szpitalne zapalenie płuc jest to zakażenie, do którego dochodzi > 48 godz. od przyjęcia do
szpitala i które nie było w okresie inkubacji przy przyjęciu do szpitala [1]
Zapalenie płuc związane z zakładami opieki zdrowotnej: obejmuje pacjentów, u których do
zakażenia doszło w ciągu 90 dni od wypisania ze szpitala, rezydentów domów opieki,
leczonych powtarzaną hemodializą, w ciągu ostatnich 30 dni byli leczenie antybiotykami
dożylnymi, otrzymywali chemioterapię lub byli leczeni z powodu zakażenia rany [1];
Uwaga
sposób diagnostyki i leczenia obu zakażeń jest podobny [2]
W przypadku przyjmowania do WCPiT pacjenta z zapaleniem płuc, w szczególności
przenoszonego z innego szpitala, należy poprzez rozmowę z lekarzem kierującym za konieczne
różnicowanie zakażenia pozaszpitalnego z zakażeniem szpitalnym lub zakażeniem związanym z
zakładami opieki zdrowotnej gdyż sposób diagnostyki i wybór antybiotykoterapii jest różny
Kiedy należy rozpoznawać
podejrzewać etiologię [2]
lub podejrzewać zakażenia związane z ZOZ oraz jaką należy
Domy opieki: etiologia: 1) pałeczki Gram-ujemne, 2) S .pneumoniae, 3) H. influenzae, 4) S. aureus;
inne drobnoustroje (Mycoplasma pneumoniae, Chlamydia pneumoniae, Legionella pneumophilia)
występowały bardzo rzadko < 1 %; zauważalna bardzo zróżnicowana etiologia zależna od ośrodka
Zapalenie płuc u leczonych chemioterapią: zdecydowana większość powodowana była przez
pałeczki gram ujemne , głównie Pseudomonas aeruginosa, Klebsiella sp. oraz grzyby, należy
34
zaznaczyć, że większość badanych chorych stanowiły osoby chore na choroby rozrostowe układu
krwiotwórczego , nie raka płuca
Pacjent dializowany: etiologia : 1) S. pneumoniae, 2) Pseudomonas aeruginosa, 3) Klebsiella sp.,
4) H. influenzea;
Etiologia zakażeń szpitalnych oraz zakażeń związanych z zakładami opieki zdrowotnej jest
trudna do przewidzenia
bardzo
Diagnostyka etiologii zakażenia szpitalnego/ związanego z zakładem opieki zdrowotnej
Ponieważ etiologia szpitalnego zapalenia płuc jest trudna do przewidzenia przed podaniem
antybiotyku zalecane jest wykonanie badań [1,11,12,13]
posiew krwi należy pobrać u wszystkich pacjentów ze szpitalnym zapaleniem płuc
posiew z dróg oddechowych: posiew plwociny, jeżeli założona rurka tracheotomijna: aspirat
tchawiczy lub pobranie materiału metoda bronchoskopową
jeżeli zapalenie płuc przebiega ze znacznym wysiękiem lub pacjent prezentuje objawy
intoksykacji zalecana jest torakocenteza z pobraniem płynu na badanie analityczne i badanie
mikrobiologiczne
w interpretacji wyniku posiewu z dróg oddechowych należy brać pod uwagę, że nie wszystkie
wyhodowane drobnoustroje mogą być przyczyną szpitalnego zapalenia płuc (np. Candida sp.
gronkowce koagulazo ujemne, enterokoki) - patrz rozdział interpretacja materiału z dróg
oddechowych
Leczenie
-
-
Wybór leczenia: jest zależny od ciężkości stanu chorego, ryzyka zakażenia wieloopornymi
drobnoustrojami szpitalnymi, wyniku barwienia metoda Grama wydzieliny z dolnych dróg
oddechowych oraz obrazu radiologicznego [1]
ryzyko zakażenia drobnoustrojem wieloopornym wzrasta wraz z czasem hospitalizacji pacjenta,
wcześniejsza antybiotykoterapia oraz gdy pacjent przebywał na Oddziale Intensywnej Terapii
zalecana jest analiza wcześniejszych wyników badań bakteriologicznych
pacjent niskiego ryzyka do zakażenia wieloopornym szczepem bakteryjnym : ceftriakson 1 x 2 g
lub ciprofloksacyna 2 x 400 mg;
Jeżeli ryzyko zakażenia szczepem wieloopornym:
jeden z następujących: ceftazydym 3 x 2 g iv, piperacylina z tazobaktamem 4 x 4,5 g iv lub
imipenem 4 x 0,5 g iv lub meropenem 3 x 1 g iv
+
Ciprofloksacyna 2 x 400 mg iv lub amikacyna
±
Wankomycyna 2 x 1 g iv
Zakażenia występujące u pacjentów z rakiem płuca
35
Ten rodzaj zakażeń był przedmiotem bardzo nielicznych publikacji. Jedną z najważniejszych jest
publikacja na próbie 275 chorych z rakiem płuca, u których analizowano zakażenia obecne przy
przyjęciu do szpitala oraz te, które wstąpiły w trakcie hospitalizacji, wyniki [3]:
U 275 chorych zidentyfikowano 435 epizodów gorączki lub mikrobiologiczne/kliniczne
potwierdzonych zakażenia: 79% zakażeń wystąpiło u chorych z rakiem nie-drobnokomórkowym i
18% z rakiem drobnokomórkowym
Rodzaje zakażeń:
o Tracheobronchitis 136
o Pneumonia 94
o Inne zakażenia układu oddechowego 14
o Zakażenia krwi 38
o Zakażenia układu moczowego 35
o Zakażenia górnych dróg oddechowych 26
o Zakażenia skóry 22
o Zakażenia przewodu pokarmowego 22
70% zakażeń zostało potwierdzonych mikrobiologicznie
Etiologia zakażeń układu oddechowego:
o H. influenzae 64
o S. pneumoniae 21
o S. aureus 17
o E. coli 16
o M.catharralis 15
o Pseudomonas aeruginosa 14
Implikacje diagnostyczne
Materiał z dróg oddechowych : plwocina, aspirat tchawiczy, materiał bronchoskopowy powinny
zostać zawsze pobrane w przypadku zapalenia płuc i /lub tracheobronchitis
Diagnoza tracheobronchitis może być postawiona jeżeli stwierdzana jest ropna wydzielina z dróg
oddechowych oraz spełnione są co najmniej dwa z następujących: gorączka > 38oC, leukocytoza
12 x 109/L, znaczny wzrost drobnoustrojów chorobotwórczych z materiału z dróg oddechowych
oraz w badaniu rtg klatki piersiowej nie są stwierdzane cechy zapalenia płuc [10]
W przypadku gorączki bez uchwytnej przyczyny zawsze należy pobrać posiewy krwi 2-4 zestawy ;
liczba zależna od tego czy pacjent był leczonych antybiotykami oraz badanie ogólne i posiew
moczu przynajmniej u pacjenta z cewnikiem do pęcherza moczowego
Implikacje terapeutyczne
W leczeniu zakażeń układu oddechowego można w terapii empirycznej rozważyć zastosowanie
amoksycyliny klawulanianem 3 x 625 mg po z ciprofloksacyną 2 x 400 mg iv lub 2 x 500 mg po lub
ceftriakson 1 x 2 g iv
Zapalenie płuc u pacjentów po zabiegach torakochirurgicznych
36
Częstość występowania zapaleń płuc u pacjentów po całkowitej lub częściowej resekcji płuca
(pneumonectomia, lobektomia, bilobecotmia) wynosi ok. 14-25% [4,5,6,7]
80% zapaleń płuc występuje w ciągu 5 dni od zabiegu
Do głównych czynników ryzyka zakażenia należy POChP [8]
Etiologia:
Wielobakteryjna ok. 30%
Najczęściej drobnoustroje: Haemophiluz influenzae,, Streptococcus pneumoniae, Pseudomonas
aeruginosa
słaba jest korelacja między bakteriami wyhodowanymi przed zabiegiem a tymi które powodują
zapalenie płuc po zabiegu [8]
Implikacje diagnostyczne
Materiał z dróg oddechowych : plwocina, aspirat tchawiczy, materiał bronchoskopowy powinien
być zawsze pobrany w przypadku zapalenia płuc
Implikacje terapeutyczne
Wybór antybiotyku jest zależny od czynników ryzyka do zakażenia wieloopornym
drobnoustrojem, do których należy głownie długi czas hospitalizacji w Oddziale Intensywnej
Terapii , czas leczenia respiratorem oraz stosowania antybiotyków przed zakażeniem [1] ;
Niskie ryzyko: cefriskon 1 x 2 g iv
Wysokie ryzyko: ceftazydym 3 x 1 g , piperacylina z tazobaktamem 4 x 4,5 g
Wysokie ryzyko oraz ciężki stan chorego: imipenem 4 x 0, 5 g iv
Piśmiennictwo
1. American Thoracic Society (2005) Guidelines for the management of adults with hospitalacquired, ventilator-associated, and health- care associated pneumonia. Am J Respir Crit Care
Med 171:388–416
2. Kolef M.: Health Care–Associated Pneumonia (HCAP): A Critical Appraisal to Improve
Identification, Management, and Outcomes—Proceedings of the HCAP Summit, Clin Infect
Dis 2008;46: S269-334
3. Berghmans T.: A Prospective Study of Infections in Lung Cancer Patients Admitted to the
Hospital. Chest 2003;124:114-20
4. Radu D.: Postoperative Pneumonia After Major Pulmonary Resections: An Unsolved Problem
in Thoracic Surgery, Ann Thorac Surg 2007;84:1669 –74
5. Bernard A, Ferrand L, Hagry O, Benoit L, Cheynel N, Favre JP. Identification of prognostic
factors determining risk groups for lung resection. Ann Thorac Surg 2000;70:1161–7. 2.
6. Schussler O, Alifano M, Dermine H, et al. Postoperative pneumonia after major lung
resection. Am J Respir Crit Care Med 2006;173:1161–9.
7. Blanquette B.: Early respiratory acidosis is a new risk factor for pneumonia after lung
resection, Interactive CardioVascular and Thoracic Surgery 2011; 1-5
37
8. Yamada Y.: Trends of bacterial colonisation and the risk of postoperative pneumonia in lung
cancer patients with chronic obstructive pulmonary disease European Journal of Cardiothoracic Surgery 37 (2010) 752—757
9. D'Journo X.: Airways colonizations in patients undergoing lung cancer surgery Eur J
Cardiothorac Surg 2011;40:309-319
10. Nan D.: Nosocomial Infection After Lung Surgery Chest 2005; 128:2647–2652
11. Masterton R, Galloway A, French G, Street M, Armstrong J, Brown E, Cleverley J P. Dilworth8,
C. Fry9, A. D. Gascoigne10, Alan Knox11, Dilip Nathwani12, Robert Spencer13 and Mark
Wilcox14 2008 Guidelines for the management of hospital-acquired pneumonia in the UK:
Report of the Working Party on Hospital-Acquired Pneumonia of the British Society for
Antimicrobial Chemotherapy Journal of Antimicrobial Chemotherapy 2008
12. Rotstein C. Clinical practice guidelines for hospital acquired pneumonia and ventilator
acquired pneumonia in adults. Can J INfec Dis Med Microbiol 2008;19:19-53
13. Torres A, Ewig S, Lode E, Carlet J For The European HAP working group (2009)Defining,
treating and preventing hospital acquired pneumonia: European perspective, Intensive Care
Med 35:9–29
7.RESPIRATOROWE ZAPALENIE PŁUC (VAP) I TRACHEOBRONCHITIS (VAT)
W Oddziale Intensywnej Terapii u pacjenta leczone respiratorem za kluczowe należy uznać
różnicowanie między trzema stanami klinicznymi
Kolonizacja dróg oddechowych: obecność bakterii w drogach oddechowych bez
powodowania objawowego zakażenia, dotyczy większości chorych hospitalizowanych > 48
godz. w oddziale, nie może być leczona antybiotykami
Respiratorowe zapalenie płuc VAP
Respiratorowe tracheobronchitis VAT
Respiratorowe zapalenie płuc - VAP
Diagnostyka
a) Kryteria kliniczne
antybiotyku [1,2]
rozpoznania VAP (kryteria Johanson), które są wskazanie do podania
w RTG nowy naciek zapalny lub progresja zmian
oraz
- oraz stwierdzenie co najmniej dwóch z trzech: gorączka > 38,3oC, leukocytoza (> 10000/mm3) lub
leukopenia (<4000/mm3), ropna wydzielina
-
W badaniach porównujących z diagnozą stawianą w badaniach pośmiertnych, na próbie 25
pacjentów wentylowanych mechanicznie, czułość kryterium Johanson do rozpoznania VAP wyniosła
69% a specyficzność 75% [3].
38
Jeżeli jako kryterium rozpoznania VAP wymagane jest spełnienie wszystkich 3 odchyleń oraz zmian
radiologicznych to czułość wykrywania VAP spada do < 50%, natomiast stwierdzenie tylko jednego
objawu i odchyleń radiologicznych charakteryzuje się małą swoistością i bardzo wysoką czułością
i taki punkt wyjścia może służyć jako wstępne badanie przesiewowe do dalszej weryfikacja przy
zastosowaniu głównie badań mikrologicznych [4].
b) Diagnostyka bakteriologiczna [1,,5,6,7]
Wszyscy pacjenci u których podejrzewany jest VAP powinni mieć pobrany materiał z dróg
oddechowych na badanie mikrobiologiczne , które obejmuje: aspirat tchawiczy lub BAL lub
szczoteczkowanie chronione
W przypadku braku klinicznego podejrzenia VAP lub tracheobronchitis pobieranie materiału z
dróg oddechowych nie jest zalecane
Jałowy posiew z dróg oddechowych pobrany od pacjenta, u którego w ciągu ostatnich 3 dni nie
był wdrażany nowy antybiotyk w rzeczywistości wyklucza obecność bakteryjnego zapalenia płuc z
wyjątkiem Legionella sp. oraz zakażeń wirusowych
Pozycja aspiratu tchawicznego
o Aspirat tchawiczy jest podobnie wiarygodnym materiałem mikrobiologicznym jak BAL
o Preparat bezpośredni barwienia metodą Grama aspiratu tchawicznego może służyc do
ukierunkowania terapii empirycznej VAP
o Ujemny wynik badania preparatu bezpośredniego aspiratu tchawiczego (brak obecności
drobnoustrojów i komórek zapalanych) u pacjent u którego w ciągu ostatnich 72 godz.
nie stosowano antybiotyku ma silna negatywną wartość przewidywalna (94%) dla
wykluczania VAP i powinien prowadzić do poszukiwania innych przyczyn gorączki
Nie wykazano aby metody inwazyjne (metody bronchoskopowe) pobierania materiału na
badanie mikrobiologiczne wpływały na poprawę rokowań pacjenta i z tego powodu ich
wykonywanie nie jest zalecane z wyjątkiem pacjentów z niedoborami odporności
Wystarczające jest wykonywane badania jakościowego, a nie ilościowego: metaanaliza
Cochrane z 2009 roku na 5 randomizowanych badaniach (1367 pacjentów): nie wykazano
różnicy w śmiertelności, czasie hospitalizacji w OIT, częstszej zmiany antybiotykoterapii badań
diagnostycznych inwazyjnych i nieinwazyjnych oraz badań ilościowych i jakościowych [8]
Uwaga: drobnoustroje które nie powodują zapalenia płuc: Enterococcus spp., gronkowce
koagulazo-ujemne, Candida spp (wyizolowanie Candida z dróg oddechowych w ogromnej
większości przypadków oznacza jedynie kolonizację
Leczenie
Wybór leczenia początkowego musi brać pod uwagę różnicowanie VAP na wczesny i późny.
U chorych z wczesnym VAP najczęstszymi czynnikami ryzyka są S. aureus, S. pneumoniae,
H. influenzae i bardziej wrażliwe na antybiotyki pałeczki Gram ujemne
Wybór antybiotykoterapii empirycznej późnego VAP powinien być oparty o miejscowe dane
epidemiologiczne; dane z OAiIT WCPiT za rok 2011
Odsetki wszystkich izolacji z dróg
Drobnoustrój
oddechowych
39
pałeczki z rodziny Enterobacteriaceae
Acinetobacter baumannii
52,5 %
w tym ESBL 21,4%
12,5 %
Pseudomonas aeruginosa
12,5 %
Stenotrophomonas maltophilia
Staphylococcus aureus
10,0%
6,3 %
w tym MRSA 20,0 %
6,3 %
wszystkie PNSP
6,3 %
Streptococcus pneumoniae
Haemophilus influenzae
-
-
-
wybór antybiotyku w terapii VAP-u wczesnego (< 4 dni hospitalizacji w OIT) u pacjenta bez
czynników ryzyka do zakażenia wieloopornym drobnoustrojem: cefriakson 1 x 2 g iv lub
lewofloksacyna 1 x 750 mg iv
wybór antybiotyku w VAP późnym lub u pacjenta z czynnikami ryzyka do zakażenia
drobnoustrojem wieloopornym
o czynniki ryzyka do zakażenia wieloopornym drobnoustrojem: czas hospitalizacji > 5
dni, leczenie antybiotykami w ciągu ostatnich 90 dni, hospitalizacja w ciągu ostatnich
90 dni, pacjent z domu opieki, przewlekła hemodializa, domowa terapia dożylna,
pacjent z przewlekłymi zmianami skórnymi, immunosupresja
o wybór antybiotyku:
ceftazydym: 3 x 2 g lub piperacylina z tazobaktamem 4 x 4,5 g
stan bardzo ciężki imipenem 4 x 0,5g lub meropenem 3 x 1 g , uwaga : jeżeli
w preparacie bezpośrednim widocznie głównie bakterie Gram dodanie
należy dodać wankomycynę
czas leczenia: 8 dni; dłuższa kuracja jeżeli etiologię zakażenia stanowią Pseudomonas
aerugionsa i Staphylococcus aureus
Respiratorowe tracheobronchitis VAT
Kryteria diagnostyczne [9]
Kryterium kliniczne: pojawienie się nowej wydzieliny ropnej z dróg oddechowych lub zmiana lub
zwiekszenie objętości wydzieliny z dróg oddehowywch oraz co najmniej jeden z następująych :
gorączka > 380C, leukcyotoza < 12000/mm3 lub leukopenia < 4000/mm3
oraz
Kryterium mikrobiologiczne: w badaniu ilościowym aspiratu tchawiczego izolacja drobnoustroju
chorobotwórczego w mianie ≥ 106 kolonii/ml
oraz
W badaniu radiologicznym nie stwierdzono odychleń wskazujących na zapalenie płuc
Leczenie
Brak wyników badań, które wykazywały by wyraźną przewagę antybiotyku nad placebo [10]
W leczeniu można rozważyć nebulizację z zastosowaniem kolistyny lub krótkotrwałą
antybiotykoterapię dożylną [11]; kolistyna wziewnie podawna jest w dawce 1-2 mln co 12
godz.
40
Piśmiennictwo
1. Johanson WG Jr, Pierce AK, Sanford JP, Thomas GD: Nosocomial respiratory infections with
gram-negative bacilli. The significance of colonization of the respiratory tract. Ann Intern Med
1972, 77:701-706
2. American Thoracic Society (2005) Guidelines for the management of adults with hospitalacquired, ventilator-associated, and health- care associated pneumonia. Am J Respir Crit Care
Med 171:388–416
3. Fa`bregas N, Ewig S, Torres A, et al: Clinical diagnosis of ventilator associated pneumonia
revisited: Comparative validation using immediate post-mortem lung biopsies. Thorax 1999;
54:867–873
4. Wunderink R.: Clinical criteria in the diagnosis of ventilator associated pneumonia. Chest
2000; 117:191S-194S
5. Masterton R, Galloway A, French G, Street M, Armstrong J, Brown E, Cleverley J P. Dilworth8,
C. Fry9, A. D. Gascoigne10, Alan Knox11, Dilip Nathwani12, Robert Spencer13 and Mark
Wilcox14 2008 Guidelines for the management of hospital-acquired pneumonia in the UK:
Report of the Working Party on Hospital-Acquired Pneumonia of the British Society for
Antimicrobial Chemotherapy Journal of Antimicrobial Chemotherapy 2008
6. Rotstein C. Clinical practice guidelines for hospital acquired pneumonia and ventilator
acquired pneumonia in adults. Can J INfec Dis Med Microbiol 2008;19:19-53
7. Torres A, Ewig S, Lode E, Carlet J For The European HAP working group (2009)Defining,
treating and preventing hospital acquired pneumonia: European perspective, Intensive Care
Med 35:9–29
8. Berton DC, Kalil AC, Cavalcanti M, Teixeira PJZ. Quantitative versus qualitative cultures of
respiratory secretions for clinical outcomes in patients with ventilator-associated
pneumonia. Cochrane Database of Systematic Reviews 2008, Issue 4. Art. No.:CD006482.
DOI: 10.1002/14651858.CD006482.pub2
9. Craven DE, Chroneou A, Zias N, et al. Ventilator-associated tracheobronchitis: the impact of
targeted antibiotic therapy on patient outcomes. Chest 2009; 135:521–528.
10. Wunderink R.: Ventilaotr associated tracheobronchitis: public reporting scan or important
clinical infection. Chest 2011;139:485-8
11. Craven T.: Ventilator-Associated Tracheobronchitis, Chest 2009;135:521-8
8. Wykonywanie mikrobiologicznych badań przesiewowych u pacjentów
OAiIT
Badanie przesiewowe są to badania wykonywane u pacjenta, u którego nie są stwierdzane cechy
zakażenia, a których celem jest identyfikacja drobnoustrojów kolonizujących pacjenta.
Badania przesiewowe mogą być wykonywane w celach:
w ramach nadzoru epidemiologicznego, w celu identyfikacji niebezpiecznych drobnoustrojów w
ujęciu epidemiologicznym
41
jako wsparcie wyboru terapii empirycznej tzn. sytuacji gdy w przypadku powstania zakażenia
lekarz w wyborze terapii empirycznej opiera się na wcześniejszych posiewach wykonanych jako
badanie przesiewowe
Zlecenia na badanie mikrobiologiczne powinno umożliwić Laboratorium Mikrobiologiczne
identyfikację czy pobrany materiał pobierany jest jako badanie grzesiowego i oceny w kierunki jakich
drobnoustrojów
Badania przesiewowe prowadzone przy przyjęciu do OAiIT
1. Nie jest zalecane prowadzenie rutynowych badan przesiewowych u przyjmowanych
pacjentów do OIT
2.
Zalecane jest wdrożenie wykonywania badań przesiewowych w kierunku MRSA i VRE u
przyjmowanych pacjentów z czynnikami ryzyka do kolonizacji tymi drobnoustrojami
definiowanymi jako:
o
przyjęcie z oddziału/ośrodka o częstym występowaniu MRSA lub VRE
o
stwierdzenie zakażenia lub kolonizacji MRSA w ciągu ostatniego roku
o
Leczenie powtarzana hemodializą
o
Przyjęcie z domu opieki lub z innego szpitala
o
Ekspozycja na dwa lub więcej antybiotyków w ciągu ostatnich 30 dni
o
Hospitalizacja w ciągu ostatniego roku
3. Zalecane jest prowadzenie badania przesiewowego przy przyjęciu do OIT w kierunku KPC u
pacjenta przyjmowanego ze szpitala o rozpoznanym występowaniu tego drobnoustroju lub
wg aktualnych zaleceń Ministerstwa Zdrowia u pacjenta, który był hospitalizowany w
warszawskim szpitalu
4.
Nie jest zalecane prowadzenie badań przesiewowych przy przyjęci wobec innych
drobnoustrojów Gram ujemnych
Badania przesiewowe prowadzone w trakcie hospitalizacji w OAiIT
1. Nie jest zalecane rutynowe prowadzenie badan przesiewowych w celach nadzoru
epidemicznego w trakcie hospitalizacji w OIT, z wyjątkiem sytuacji powstania ogniska
epidemicznego
2. Nie jest zalecane rutynowe prowadzenie badania przesiewowego w celu podejmowaniu
decyzji dotyczącej stosowania terapii empirycznej zakażenia
3. Prowadzenie badania przesiewowego w celu podejmowania decyzji o terapii empirycznej
zakażenia można rozważyć w następujących sytuacjach
Wysokiej zapadalności na zakażenia o etiologii lekoopornych drobnoustrojów, w
szczególności Psedomonas aeruginosa i Acinetobacter Baumanie
Gdy wrażliwość na antybiotyki stosowane w terapii empirycznej zaakzeń szpitalnych
wynosi < 80 %
4. W powyższych sytuacjach prowadzenie badania przesiewowego jest prowadzone za pomocą
badania ilościowego aspiratu tchawicznego pobieranego dwa razy w tygodniu i brana jest
42
pod uwagę wynik badania pobranego w ciągu < 72 godz. uwagę od postawienia diagnozy lub
podejrzenia VAP
Piśmiennictwo
1. Muto CA, Jernigan JA, Ostrowsky BE, Richet HM, Jarvis WR, Boyce JM, Farr BM; SHEA. SHEA
guideline for preventing nosocomial transmission of multidrug-resistant strains of
Staphylococcus aureus and enterococcus. Infect Control Hosp Epidemiol. 2003 May;24(5):362-86.
2. SHEA 2007
3. Furuno JP, McGregor JC, Harris AD, et al. Identifying groups at high risk for carriage of antibioticresistant bacteria. Arch Intern Med 2006; 166:580-585.
4. Haley CC, Mittal D, Laviolette A, Jannapureddy S, Parvez N, Haley RW. Methicillin resistant
Staphylococcus aureus infection or colonization present at hospital admission: multivariable risk
factor screening to increase efficiency of surveillance culturing. J Clin Microbiol 2007; 45:30313038.
5. Zalecenia Ministerstwa Zdrowia
6. Baba H., Nimmo G., Allworth A.The role of surveillance cultures in the prediction of susceptibility
patterns of Gram-negative bacilli in the intensive care unit. Eur J Clin Microbiol Infect Dis (2011)
30:739–744
7. Jung B, Sebbane M, Chanques G, Courouble P, Verzilli D, Perrigault PF, Jean-Pierre H, Eledjam JJ,
Jaber S. Previous endotracheal aspirate allows guiding the initial treatment of ventilatorassociated pneumonia. Intensive Care Med. 2009 Jan;35(1):101-7.
8. Sanders K., Adhikari N., Friedrich J., i wsp.: Previous cultures are not clinically useful for guiding
empiric antibiotics in suspected ventilator-associated pneumonia: Secondary analysis from a
randomized trial, J Crit Care 2008; 23: 58–63.
9. Papadomichelakis E, Kontopidou F, Antoniadou A, Poulakou G, Koratzanis E, Kopterides P,
Mavrou I, Armaganidis A, Giamarellou H. Screening for resistant gram-negative microorganisms
to guide empiric therapy of subsequent infection. Intensive Care Med. 2008; 34(12):2169-75.
10. Michel F, Franceschini B, Berger P, Arnal JM, Gainnier M, Sainty JM, Papazian L. Early antibiotic
treatment for BAL-confirmed ventilator-associated pneumonia: a role for routine endotracheal
aspirate cultures. Chest. 2005 Feb;127(2):589-97.
11. Hayon J, Figliolini C, Combes A, Trouillet JL, Kassis N, Dombret MC, Gibert C, Chastre J. Role of
serial routine microbiologic culture results in the initial management of ventilator-associated
pneumonia. Am J Respir Crit Care Med. 2002 Jan 1;165(1):41-6.
9. ZAPALENIE PŁUC U PACJENTÓW Z NIEDOBORAMI ODPORNOŚCI
Uwagi ogólne
Etiologia zapaleń płuc u pacjentów z niedoborami odporności jest niezwykle szeroka i może być
zupełnie odmienna od drobnoustrojów powodujących zakażenia u pacjentów bez niedoborów
odporności
43
Wcześnie wdrożona diagnostyka ukierunkowana również na drobnoustroje oportunistyczne jest
kluczowa do wdrożenia skutecznego leczenia oraz zmniejszeni śmiertelności
Opóźnienie identyfikacji etiologii zakażenia o 5 dni zwiększa 3-krotnie śmiertelność [2]
Badania mikrobiologiczne mało przydatne w diagnostyce zakażeń oportunistycznych obejmują
posiew plwociny oraz badania serologiczne gdyż pacjenci z niedoborami odporności mogą nie
reagować na zakażenia odpowiedzią immunologiczną obejmującą przeciwciała
W ocenie potencjalnych drobnoustrojów należy brać pod uwagę profilaktykę stosowaną przez
pacjenta np. biseptol jest wysoce aktywny w profilaktyce zakażeń Pneumocystis jirovecii
W ocenie przyczyn zmian zapalnych należy brać pod uwagę również przyczyn nie-infekcyjne:
zator płucny, guz, powikłania po-radiacyjne lub po chemioterapii, krwotok pęcherzykowy
Badanie radiologiczne klatki piersiowej może nie wykazywać odchyleń natomiast w badanie KT
może wykazywać zmiany zapalne wskazujące na prawdopodobną grupę drobnoustrojów
Zakres wdrażanej diagnostyki oraz wybór terapii empirycznej zależy od rodzaju niedoboru
odporności, szybkości ewolucji objawów (proces ostry, przewlekły, podostry) oraz od wyniku
badania KT
Ponieważ w większości przypadków leczenie oportunistycznego zapalenia płuc może odbywać się
jako terapia empiryczna to w określaniu potencjalnych drobnoustrojów, które mogą stanowić
etiologię zakażenia należy opierać się na następujących [3]
o Rodzaj niedoboru odporności
o Ewolucja objawów klinicznych: obraz ostrego/ podostrego/przewlekłego zakażenia
o Obraz tomografii komputerowej
Tabela. Etiologia oportunistycznych zapaleń płuc wg rodzaju niedoboru odporności [3,4]
Rodzaj niedoboru odporności
Neutropenia
Niedobór odporności komórkowej związanej z
Główne przyczyny zapalenia płuc
Bakterie Gram-ujemne, również Pseudomonas
aeruginosa, Aspergillus sp. i inne grzyby
pleśniowe
Mycobacterium sp., Legionella
44
limfocytami T: sterydoterapia , przeszczep
narządu litego stosowanie czynników
biologicznych: anty-TNF alfa, zakażenie wirusem
HIV
Niedobory związane z limfocytami B: Szpiczak
mnogi, marskość wątroby, splenektomia,
enteropatie
Zakażenia wirusowe
Cryptococcus sp.
Pneumocystis jirovecii
Streptococcus pneumoniae, Haemophilus
influenzae
W przypadku stosowania sterydów ryzyko zakażenia wzrasta o 50% gdy dawka dobowa przewlekle
stosowanego prednizonu wynosi 10 mg/dobę i 800% gdy dawka wynosi 40 mg/dobę [5,6].
W przypadku neutropenii ryzyko zakażenia inwazyjnej aspergilozy płucnej znacząco wzrasta gdy
liczba granuloctyów jest < 100/mm3 i czas trwania neutropenii przekracza 10 dni [7].
Przebieg kliniczny: ewolucja objawów klinicznych a etiologia zakażenia [3]
ostry przebieg kliniczny: zakażenie bakteryjne, Pneumocystis jirovecii, Legionella sp.,
obraz kliniczny zakażenia podostrego lub przewlekłego: Aspergillus sp., wirusy : RSV, CMV,
gruźlica lub prątki atypowe, Nocardia sp., Cryptococcus sp.
Znaczenie obrazu KT w identyfikacji etiologii zakażenia u pacjentów z niedoborami odporności
1. Obraz matowego szkła [8]: Pnemocystis jirovecii, CMV, HSV, RSV, inne wirusy
2. Obraz typu halo [9]: Aspergillus sp. – najczęściej, zdecydowanie rzadziej: towarzyszący
septycznej zatorowości, Mycobacterium avium, Coxiella burnetti, , wirusy HSV, VZV, CMV,
3. Obraz jamy: Mycobacterium sp., Nocardia sp., Cryptococcus p., Aspergillus sp., Pseudomonas
aeruginosa, Klebsiella sp., [10]
Diagnostyka zakażenia oportunistycznego
Badanie tomografii komputerowej powinno być wykonane u każdego pacjenta
Z podejrzeniem oportunistycznego zapalenia płuc, gdyż lepiej niż badanie radiologiczne klatki
piersiowej może wskazywać na przyczynę zakażenia [11] oraz wykazuje zmiany, które nie są
widoczne a badaniu rtg np. u 80% pacjentów zakażonych wirusem HIV badanie KT wykazuje
zmiany, które nie były uwidocznione w badaniu RTG [12]
U każdego pacjenta z gorączką neutropeniczną który nie zareagował na leczenie
antybiotykami pierwszego rzutu ( tj. około 5 doby leczenia): w około 50% przypadków cechy
aspergilliozy płucnej są widoczne w KT, które nie były zauważone w badaniu RTG klatki
piersiowej [13]
Rola bronchoskopii w diagnostyce zakażenia oportunistycznego
Badanie bronchoskopowe powinno być niezwłocznie wykonane u pacjenta z niedoborami
odporności z podejrzeniem oportunistycznego zapalenia płuc, u których stan kliniczny
pozwala na jego wykonanie, gdyż [14]
Etiologia zakażenia jest bardzo szeroka i trudna do przewidzenia
Opóźnienie identyfikacji etiologii zakażenia o 5 dni zwiększa 3-krotnie śmiertelność [2]
Analiza skuteczności badania bronchoskopowego wykonywanego u pacjentów z niedoborami
odporności i naciekiem płuca [15]
45
Badanie objęło 104 pacjentów z niedoborami odporności innymi niż zakażenie wirusem HIV
(schorzenia hematologiczne, sterydoterapia, przeszczep narządu litego) ze zmianami
ogniskowym lub rozsianymi
U 104 pacjentów postawiono ostatecznie 128 diagnoz zmian w płucach
Wykonanie BAL-u umożliwiło postawienie diagnozy w 56% a BAL-u z wykonaniem biopsji
przezoskrzelowej w 70%
Czułości BAL-u był zdecydowanie większa dla identyfikacji przyczyn infekcyjnych (81%) niż
nie-infekcyjnych (56%)
Postawione diagnozy
o zakażenie 47 z 128 diagnoz
bakteryjne 23, z tego Mycobacterium sp. =5 , Legionella sp.=2
grzybicze 10 , z tego Aspergillus sp.=8
wirusowe 12, z tego CMV=9 , HSV=3
Pneumocystis jirovecii 2
o Nieinfekcyjne:
Rozlany krwotok pęcherzykowy = 19
ARDS = 11
Pneumonitis po-radiacyjne lub zwiane z chemioterapia = 5
Naciek niejasnego pochodzenia = 23
Inne = 23 ( chłoniak 3, ziarniniakowatość Wegenera 3, rozstrzenia 3, BOOP
2)
Badania mikrobiologiczne, których wykonanie należy rozważyć u pacjenta z podejrzeniem
oportunistycznego zapalenia płuc [16]
Płukanie nosogardła lub wymaz z nosa w kierunku wirusów grypy, w okresach zwiększonych
zachorowań na grypę
Badanie moczu na antygen Legionella sp. i antygen Streptococcus pneumoniae
Krew, surowica: PCR dla CMV, antygen Aspergillus galactomannan
Materiał bronchoskopowy
o Flora nieswoista
o Flora swoista oraz PCR dla Mycobacterium tuberculosis
o Pneumocystis jirovecii PCR i barwienie
o PCR dla CMV
o Antygen galaktomannan dla Aspergillus
o PCR dla Chlamydia pneumoniae
o PCR dla Mycoplasma pneumonia
Leczenie empiryczne
Optymalnie gdy leczenie może być zastosowane niezwłocznie po pobraniu materiał droga
bronchoskopii.
Wybór terapii empirycznej
Zapalenie płuc przebiegające z gorączką neutropeniczną [3]: antybiotyk beta-laktamowy
działający na Pseudomonas aerugionsa: ceftazydym 3 x 2 g iv lub piperacylina z
tazobaktamem 4 x 4,5 g iv; w zależności od czasu trwania neutropenii, obrazu klinicznego i
badania KT należy rozważyć dodanie lub wczesne włączenie worikonazolu
46
Zapalnie płuc z obrazem mlecznej szyby: biseptol w dawce dla Pneumocystis jiroveci ±
ganycklowir 2 x 5 mg/kg iv
Niedobór odporności związany z limfocytami T i w badaniu RTG/KT zmiany zapalenie
wieloogniskowe, bez mlecznej szyby: lewofloksacyna 1 x 750 mg
Niedobór oporności związany z limfocytami B: ceftriakson 1 x 2 g iv ± lewofloksacyna lub
makrolid (klarytromycyna, azytromycyna)
Leczenie celowane: patrz rozdział: leczenie zapalenia płuc wg zidentyfikowanej przyczyny
Piśmiennictwo
1. Fishman J.: Approach to the immunocompromised patients with fever and pulmonary
infiltrates. UpToDate 2012
2. Rano A, Agusti C, Banito N, et al. Prognostic factors of non-HIV immunocompromised
patients with pulmonary infiltrates. Chest 2002; 122:253–261
3. Cunha B.: Infections In the compromised host. Infect Dis Clin Norh Am 2001;15;2
4. Glauser M., Pizzo P.: management of infections in immunocompromised patients. WB
Saunders 2000
5. Stuck AE, Minder CE, Frey FJ. Risk of infectious complications in patients taking
glucocorticosteroids. Rev Infect Dis 1989; 11:954.
6. Ginzler E, Diamond H, Kaplan D, et al. Computer analysis of factors influencing frequency of
infection in systemic lupus erythematosus. Arthritis Rheum 1978; 21:37.
7. Segal B.: Current Approaches to Diagnosis and Treatment of Invasive Aspergillosis, Am J
Respir Crit Care Med 2006; 173:707–717
8. Miller W.: Review Isolated Diffuse Ground-Glass Opacity in Thoracic CT: Causes and Clinical
Presentation, Am J Radiology 2005;184:613
9. Lee R.: CT halo sign: the spectrum of pulmonary diseases. British J Radiology 2005;78:862-5
10. Gadkowski L.: Cavitary Pulmonary Disease, Clin Microbiol Rev 2008;21:305-33
11. Gulati M, Kaur R, Jha V, et al. High-resolution CT in renal transplant patients with suspected
pulmonary infections. Acta Radiol 2000; 41:237–241
12. Nyamande K. Comparison of plain chest radiography and high-resolution CT in human
immunodeficiency virus infected patients with community- acquired pneumonia: a subSaharan Africa study. Brit J Radiol 2007;80:302-6
13. Heussel CP, Kauczor HU, Heussel G, et al. Early detection of pneumonia in febrile neutropenic
patients: use of thin-section CT. AJR Am J Roentgenol 1997; 169:1347–1353
14. Shorr A.: Pulmonary infiltrates in the non-HIV infected immunocompromised patients:
etiologies, diagnostic strategies, and outcome. Chet 200;125:260-71
15. Jain P.: Role of Flexible Bronchoscopy in Immunocompromised Patients With Lung Infiltrates.
Chest 2004;125:712-22
16. Diagnosis and antimicrobial therapy of lung infiltrates in febrile neutropenic patients:
Guidelines of the infectious diseases working party of the German Society of Haematology
and Oncology, Eur J Cancer 2009;45:2462-72
10. Interpretacja wyników badań mikrobiologicznych z materiału pobranego
drogą bronchoskopii
47
Rekomendacje American Thoracic Society dotyczące interpretacji wyników badań mikrobiologicznych
BAL [1]
1. Wynik dodatni oznacza obecność zakażenia:
Legionella pneumophila
Cryptococcus neoformans
Mycobacterium tuberculosis
Mycoplasma pneumoniae
Grypa
RSV
2. Kiedy konieczne jest różnicowanie między kolonizacją, kontaminacją a zakażeniem
Bakterie
Herpes, CMV
Aspergillus sp.
Candida sp.
Prątki atypowe
Kolonizacja dróg oddechowych drobnoustrojami potencjalnie chorobotwórczymi jest często
spotykana u osób z przewlekłymi schorzeniami dróg oddechowych i nie powinna być powodem do
wdrożenia leczenia antybiotykami
Na próbie 77 pacjentów z rozstrzeniami u których BAL był wykonany w okresie stabilnym
choroby, drobnoustroje chorobotwórcze identyfikowano u 64%, głównie Haemophilus
influenzae i Pesudomonas aerugionsa [2]
U pacjentów z POCHP w okresie stabilnym kolonizacja dróg oddechowych stwierdzana jest u
25-63% chorych [3,4]
Kolonizacja górnych i dolnych dróg oddechowych drobnoustrojami chorobotwórczymi jest
stwierdzana u 36%- 59% chorych z rakiem płuca [5]
Kolonizacja dolnych dróg oddechowych potencjalnie chorobotwórczymi bakteriami jest
stwierdzana u 10-83% pacjentów z rakiem płuca, u których wykonywany jest zabieg
operacyjny, nie stwierdzono korelacji między kolonizacją a ryzykiem pooperacyjnego
zapalenia płuc [5]
Znaczenie izolacji Candida sp. z dróg oddechowych
Kolonizacja dróg oddechowych Candida sp. występuje bardzo często, w szczególności u osób
leczonych antybiotykami i jest postrzegana jako normalna flora bytująca na błonach
śluzowych jamy ustnej, pochwy czy w przewodzie pokarmowym wg niektórych badań aż u
80% społeczeństwa [6,7]; kolonizacja dróg oddechowych Candida sp. jest równie częsta u
pacjentów leczonych na respiratorze. W jednym badaniu stwierdzana była u 8% chorych i w
92% przypadków była oceniana jako kolonizacja, w 3% przypadków jako przyczyna zakażenia
i w 5% interpretacja była niejasna [8]
Zapalenie płuc o etiologii Candida sp. jest skrajnie rzadkim zakażeniem [9,10], które może być
rozważane w trzech następujących przypadkach: u pacjentów ze skrajną, długotrwałą
neutropenią lub jako wyraz zakażenia krwiopochodnego lub zachłystowego zapalenia płuc
[11,12]
Zapalenie płuc o etiologii Candida sp. nie powinno być rozpoznawane bez
histopatologicznego udokumentowania [12]
Piśmiennictwo
1. Rekomendacje American Thoracic Society dotyczące interpretacji wyników badań
mikrobiologicznych BAL
48
2. Angrill J.: Bacterial colonistaion In patients with bronchiectaisis: microbiolgoica pat tern and
risk fator. Thorax 2002;57: 15-9
3. Monso E.: Baterial infection In chronic obstructive pulmonary disease. A study of stable and
exacerbated outpatients using the protected specimen brush. Am J Respir Crit Care
1995;152:1316-20
4. Riise G.: The intrabronchial microbial flora In chronic 49ronchitis patients: a targeted for Nacetylocysteine therapy ? Eur Respir J 1994;7:94-101
5. D’Journo X.: Airways colonization in ptainets undergoing lung cancer surgery. Eue J
Cardiothorac Surg 2011; 40: 309-19
6. Gorbach SL, Nahas L, Lerner PI, Weinstein L. Studies of intestinal microflora. I. Effects of diet,
age, and periodic sampling on numbers of fecal microorganisms in man. Gastroenterology
1967; 53: 845–855.
7. Baum GL. The significance of Candida albicans in human sputum. N Engl J Med 1960; 263:
70–73
8. Wood GC, Mueller EW, Croce MA, Boucher BA, Fabian TC. Candida sp. isolated from
bronchoalveolar lavage: clinical significance in critically ill trauma patients. Intensive Care
Med 2006; 32: 599–603.
9. el-Ebiary M, Torres A, Fa`bregas N, de la Bellacasa JP, Gonza´ lez J, Ramirez J et al.
Significance of the isolation of Candida species from respiratory samples in critically ill, nonneutropenic patients. An immediate postmortem histologic study. Am J Respir Crit Care Med
1997; 156: 583–590.
10. Rello J, Esandi ME, Diaz E, Mariscal D, Gallego M, Valles J. The role of Candida spp. isolated
from bronchoscopic samples in non-neutropenic patients. Chest 1998; 114: 146–149.
11. Pagani JJ, Libshitz HI. Opportunistic fungal pneumonias in cancer patients. AJR Am J
Roentgenol 1981; 137: 1033–1039.
12. Pappas P.Clinical Practice Guidelines for the Management of Candidiasis: 2009 Update by the
Infectious Diseases Society of America. Clin INfect Dis 2009;48:503-35
13. De Pauw B.: Revised Definitions of Invasive Fungal Disease from the European Organization
for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the
National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG)
Consensus Group
11. LECZENIE ZAPALEŃ PŁUC WG ZIDENTYFIKOWANEJ ETIOLOGII
Drobnoustrój
Leczenie z wyboru
Streptococcus
pneumoniae
Amoksycylina 3 x 1 g p/o
Penicylina i/v w zależności od MIC
≤ 0,5µg/ml: 2 mln co 6 godz.
0,5-1µg/ml: 4 mln co 6 godz.
lub 2 mln co 4 godz.
2 µg/ml : 4 mln co 4 godz.
Haemophilus
influenzae
Amokysyclina 3 x 0,5 g
Amoksycylina z klawulaninem 3 x 625
mg
Moraxella catarrhalis
Amoksycylina z klawulanienm
Staphylococcus ureus
MSSA
MRSA
Kloksacylina 4-6 x 1-2 g iv
Cefazolina 3-4 x 1 g iv
wankomycyna
Teikoplanina
49
Leczenie alternatywne ( w przypadku oporności na lek
z wyboru, uczulenia)
Lewofloksacyna 1 x 750 mg
Ceftriakson 1 x 2 g iv
Cefotaksym 1-2 g co 8 godz.
Linezolid 2 x 600 mg iv lub po
Wankomycyna 2 x 1 g iv
Teikoplanina pierwsza dawka 1 x400 mg i następnie 1x
200 mg/dobe
W Polsce ok. 10% szczepów produkuje beta-laktamzy
Inne skuteczne leki: ciprofloksacyna, klarytromycyna,
azytromycyna, cefuroksym Ciężkie zakażenia o etiologii
H. influenzae typu B jak zapalenie nagłośni powinno
być leczone ceftriaksonem 2 x 2 g iv
Prawie wszystkie szczepy produkuja beta-laktamazy
Inne skuteczne leki: kotrimoksazol, doksycyklina,
ceflaopsotyny I-III genracji, makrolity, cirpofloksacyna
linezolid
Azytromycyna 1 x 500 mg
Legionella
pneumophilia
Lewofloksacyna 1 x 750 mg
Mycoplasma
pneumoniae
Klarytromycyna 2 x 500 mg
Azytroimycyna 1 x 500 mg
Doksycklina 1 doba 2 x 100 mg i następnie 1 x 10 mg
Pseudomonas
aeruginosa
Acineobcater
baumanii
Enterobacteriacae
Ceftazydym 2-3 x 1-2 g iv
Piperacylina± tazobactam 3-4 x 4,5 g
Wg antybiogramu, lekowrażliowość
trudna do przewidzenia
Ceftriakson 1 x 2 g , ciprofloksacyna 2-3
x 200-400 mg iv lub 2 x 500 mg p/o
Cefepim , ciprofloksacyna
Imipenem, meropenem
Imipenem, mero penem, ertapenem
12. ROPNIAK OPŁUCNEJ
Etiologia
Pozaszpitalny ropniak opłucnej: paciorkowce (ok. 52%) , gronkowiec złocisty (11%,
beztlenowce (20%,), bakterie Gram-ujemne 9% [1]
Szpitalny ropniak opłucnej: etiologia bardzo zróżnicowana, trudna do przewidzenia, oporna
na antybiotyki [2]
Identyfikacja drobnoustrojów z płynu z opłucnej w WCPiT w 2011 roku
Wykonano posiew 251 płynów
171 (68,1%) – hodowla ujemna w warunkach tlenowych i beztlenowych
80 (31,9%) – hodowla dodatnia, w tym: 66 – izolacja 1 drobnoustroju 14 – izolacja 2
drobnoustrojów.
Drobnoustroje wg częstości występowania:
gronkowce koagulazo-ujemne – 36 (14,3% ogółu i 45% z dodatnich posiewów)
enterokoki – 11 (4,4% ogółu i 13,8% dodatnich)
paciorkowce grupy viridans – 10 (4% ogółu i 12,5% dodatnich)
Escherichia coli - 8 (3,2% ogółu i 10% dodatnich)
Staphylococcus aureus (w tym 2 MRSA) - 7 (2,8% ogółu i 8,8% dodatnich)
Diagnostyka mikrobiologiczna
Posiewy krwi w kierunku tlenowców i beztlenowców powinny być wykonane u każdego pacjenta z
podejrzeniem ropniaka opłucnej i objawami ogólnymi zakażenia.
Badanie mikrobiologiczne płynu z opłucnej: badanie mikrobiologiczne wykonywane jest z nakłucia
opłucnej ewentualnie w trakcie pierwszych 24 godzin od założenia drenażu: 10 ml płynu do jałowej
próbówki, 5 ml do butelki na posiew w warunkach tlenowych i 5 ml do butelki na posiew w
warunkach beztlenowych
Badanie analityczne płynu z opłucnej
Badanie analityczne: pH, rozmaz, białko, LDH, glukoza, równocześnie we krwi: LDH, białko
różnicowanie przesięku z wysiękiem kryteria wg Light [3]
50
Parametr
Przesięk
Wysięk
Wygląd
surowiczy
mętny
Liczba leukocytów
< 10000/mm3
>10000 mm3
pH
> 7,2
< 7,2
Białko
< 3,0 g/dL
> 3,0 g/dL
Stosunek białka płyn-surowica
< 0,5
> 0,5
LDH
< 200 IU/L
> 200 IU/L
Stosunek LDH płyn-surowica
< 0,6
> 0,6
Glukoza
≤ 60 mg/dL
> 60 mg /dL
Znaczenie parametrów płynu w terapii ropniaka opłucnej
Znaczenie pH: wartość pH < 7,2 jest najlepszym parametrem laboratoryjnym wskazującym
na konieczność drenażu [4,5] ; pH < 6 wskazuje na pękniecie przełyku [6]
Leczenie antybiotykami
Ropniak pozaszpitalny: etiologia nieznane: amoksycylina z klawulanianem tak aby dawka
amoksycyliny wyniosła 3 x 1 g po
nie należy stosować aminoglikozydów i makrolidów
czas leczenia antybiotykami: co najmniej 3 tygodnie, zależny od odpowiedzi klinicznej,
radiologicznej i CRP
Piśmiennictwo
1.
2.
3.
4.
5.
6.
BTS Management of pleural infection in adults: British Thoracic
Society pleural disease guideline 2010, Thorax 2010; 65;supl 2:41-53
Maskell N.: The bacteriology of pleural infection by genetic and
standard methods and its mortality significance. Am J Respir Crit Care Med 2006;174: 817-823
Light R.: Pleural effusion. N Engl J Med 2002;346:1971-7
Heffner JE, Brown LK, Barbieri C, et al: Pleural fluid chemical
analysis in parapneumonic effusions: A meta-analysis. Am J Respir Crit Care
Med 1995; 151:1700-1708.
Colice GL, Curtis A, Deslauriers J, et al: Medical and surgical
treatment of parapneumonic effusions: An evidence-based guideline. Chest 2000; 118:11581171.
Good Jr JT, Taryle DA, Maulitz RM, et al: The diagnostic value of
pleural fluid pH. Chest 1980; 78:55-59
13. ROPIEŃ PŁUCA
51
Pierwotny ropień płuca
Ropień, do którego doszło u osoby predysponowanej do aspiracji lub u osób bez innych schorzeń
towarzyszących
Etiologia: beztlenowce jamy ustnej, rzadziej paciorkowce [1]
Diagnostyka mikrobiologiczna: nie jest zalecane rutynowe pobieranie jako materiału na badanie
mikrobiologiczne plwociny lub popłuczyn oskrzelowych: bakterie beztlenowe są bardzo rzadko
hodowane a materiał jest zanieczyszczony florą bakteryjną jamy ustnej; materiał na badanie
mikrobiologiczne może być pobierany jedynie jako aspiracja przeztchawicza, biopsja
przezklatkowa lub BAL ilościowy [2]
Znaczenie bronchoskopii w pierwotnym ropniu płuca [3]: na próbie 52 pacjentów z diagnozą
ropnia płuca była wykonana bronchoskopia. U 19 pacjentów (36,5%) stwierdzono raka płuca;
następujące odchylenia najsilniej wskazywały na obecność ropnia bez zmian nowotworowych:
czynniki ryzyka do zachłyśniecia, bardziej zaznaczone ostre objawy ogólne w tym gorączka,
wyższa leukocytoza (14,2 vs 10,9 x 103 /mm3), w rtg zdecydowanie większy naciek zapalny
dookoła jamy ropnia
Leczenie:
1) Klindamycyna 600 mg iv co 8 godz. i następnie 150-300 mg co 6 godz. doustnie
2) Ampicylina z sulbaktamem 4 x 3 g iv i następnie doustnie amoksycylina z klawulanianem 3 x
625 mg
3) Amokyscylina z klawulanianem 3 x 2,2 g iv i następnie 1g/125 mg amoksycyliny z
klawulanianem doustnie [1]
Czas kuracji: optymalny czas kuracji nie został określony, raczej jest indywidualnie
dostosowywany od 3 tygodni do kilku miesięcy aż w badaniu rtg nie dojdzie do zniknięcia zmiany
lub uzyskania stabilnej, resztkowej zmiany
Wtórny ropień płuca
Wtórnie do nowotworu płuca, niedoborów odporności, powikłania zabiegu operacyjnego
U pacjentów z niedoborami odporności etiologia jest niemożliwa do przewidzenia i może
obejmować Pesudomonas aerugionsa, inne pałeczki Gram-ujemne, Nocardia sp., Aspergillus,
Crytpococcus sp., Mycobacterium tuberculosis.
Leczenie empiryczne:
Klindamycyna + ciprofloksacyna
Piperacylina/tazobaktam 4 x 4,4 g iv
Imipenem, meropenem
Klindamycyna + ceftazydym
Piśmiennictwo
1. Bartlett JG, Gorbach SL, Tally FP, Finegold SM. Bacteriology and treatment of primary lung
abscess. Am Rev Respir Dis 1974; 109:510.
2. Mandell
3. Sosenko A.:Fiberoptic bronchoscopy in the evaluation of lung abscess. Chest 1985;87:489-94
52
4. Fernandez –Sabe N.: Efficacy and Safety of Sequential Amoxicillin-Clavulanate in the
Treatment of Anaerobic Lung Infections. Eur J Clin Microbiol Infect 2003;22:185-7
14. Diagnostyka zakażeń układu oddechowego w WCPIT
Etiologia
Typowe patogeny
bakteryjne patogeny
(m.in. Str.
pneumoniae, H.
influenzae, M.
catarrhalis)
Str. pneumoniae
Legionella
pneumophila
serogrupa 1 i 6
Mycoplasma spp.
Grzyby
drożdżopodobne i
pleśniowe
Mycobacterium
tuberculosis
Metoda
posiew
Materiał
plwocina, aspirat
tchawiczy,
popłuczyny
oskrzelowe, BAL
Komentarz
Wykonanie posiewu plwociny
uzależnione od wyniku
cytologicznego badania
jakości materiału
immunochromatografia
immunochromatografia
mocz
czułość 86%
swoistość 94%
czułość 94% swoistość 100%
ELISA
posiew
krew
plwocina, aspirat
tchawiczy,
popłuczyny
oskrzelowe, BAL
plwocina,
popłuczyny
oskrzelowe
w przypadku
niewielkiego
podejrzenia
gruźlicy
wszystkie
materiały
skąpoprątkowe,
materiały
uzyskane od
posiew metodą
konwencjonalną
posiew metodą
automatyczną
mocz
53
czułość 95% swoistość 95%
Wykonanie posiewu plwociny
uzależnione od wyniku
cytologicznego badania
jakości materiału
czas oczekiwania do uzyskania
wyniku ujemnego – 10
tygodni. Wyniki dodatnie – od
3 tygodnia.
czas oczekiwania do uzyskania
wyniku ujemnego – 6 tygodni.
Wyniki dodatnie – od 3 dnia.
dzieci
Prątki atypowe
posiew metodą
automatyczną
krew
badanie molekularne
metodą real-time PCR
plwocina,
popłuczyny
oskrzelowe,
aspirat tchawiczy,
BAL, płyn
mózgowordzeniowy, mocz
QuantiFERON
krew
posiew metodą
konwencjonalną lub
automatyczną
j.w.
posiew krwi w kierunku
gruźlicy należy każdorazowo
uzgadniać z laboratorium
potwierdzenie gruźlicy w
przypadku materiałów AFBdodatnich, sytuacje
wymagające szybkiej i czułej
diagnozy.
Czułość metody w przypadku
materiałów AFB-ujemnych –
80%, AFB-dodatnich – 98%.
Czas wykonania – 24 godziny,
w sytuacjach cito – 4 godziny.
Badanie wykonywane w
określone dni tygodnia
w każdym przypadku
podejrzenia mykobakteriozy
należy uprzedzić o tym
laboratorium
15. Diagnostyka zakażeń układu oddechowego poza WCPiT
Etiologia
Wirusy
CMV
Metoda
Materiał
Miejsce wykonania
PCR
Surowica
BAL
Zakład Diagnostyki Medycznej ul Dobra 38
Tel. 616630781
HSV
PCR
Zakład Diagnostyki Medycznej ul Dobra 38
Tel. 616630781
Grzyby
Aspergillus sp.
Galaktomannan
Surowica
BAL
Centrum Onkologii, Zakład Mikrobiologii, Pracownia
Mikologii
Specyficzne IgE,
IgG
Candida sp.
Pneumocystis
jirovecii
Bakterie
Mycoplasma
pneumoniae
Histopatologia
PCR oraz odczyn BAL
immunofluorescencji pośredniej
PCR
Laboratorium Mikrobiologiczne szpitala Klinicznego
Przemienia Pańskiego UM w Poznaniu ul.Dluga 1/2
Tel. 8549225
BAL
Państwowy Zakład Higieny , Zakład Parazytologii
Lekarskiej
Warszawa Ul. Chocimska 24
tel 22-5421220
Centrum Badań DNA1
ul. Mickiewicza 31, Poznań
54
Tel 6468585
Centrum Badań DNA
ul. Mickiewicza 31, Poznań
Tel 6468585
1
Ceny i formularz skierowania dostępny na stronie: www.cbdna.pl
Chlamydia
pneumoniae
PCR
BAL
U pacjentów z niedoborami odporności i nieznaną etiologią zakażenia należy rozważyć zlecenie
jednego z badań o szeroki zakresie w Centrum Badań DNA:
panel PNEUMO-VIRUS 12 - identyfikacja 12 wirusów: AdV, MPV, Coronavirus 229E,
PIV1, PIV2, PIV3, FluA, FluB, RSVA, RSVB, Rhino, Coronavirus OC43, test jakościowy,
multiplex PCR
panel PNEUMO-TOTAL 18 - identyfikacja 12 wirusów i 6 bakterii: grypa A, grypa B,
RSVA, RSVB, Coronavirus OC43/HKU1, Coronavirus 229E/NL63, Rhinowirus, AdV,
MpV, paragrypa 1, paragrypa 2, paragrypa 3, Mycoplasma pneumoniae, Haemophilus
influenzae, Streptococcus pneumoniae, Chlamydophila pneumoniae, Legionella
pneumophila, Bordetella pertussis - test jakościowy multiplex PCR z rozdziałem w
wysokiej rozdzielczości
16. Szczepienia pacjentów hospitalizowanych w WCPiT
Zalecenia dotycząc szczepień pacjentów hospitalizowanych w WCPIT opracowano na podstawie
kalendarza szczepień na rok 2102 tj. szczepienie zalecane przez Ministerstwo Zdrowia,
niefinansowane z budżetu państwa oraz wg wytycznych European Respiratory Society i European
Society for Clinical Microbiology and Infectious Diseases z 2011 roku.
Pacjenci, u których stwierdzane są wskazania do sczepienia przeciwko grypie i pneumokokom
powinni otrzymać stosowne zalecenia zawarte w karcie informacyjnej.
1. Zalecenia Ministerstwa Zdrowia
Grypa: Wskazania do szczepienia
Ze wskazań klinicznych i indywidualnych:
przewlekle chorym (astma, cukrzyca, niewydolność układu krążenia, oddychania, nerek)
w stanach obniżonej odporności
osobom w wieku powyżej 55 lat.
Ze wskazań epidemiologicznych:
-
pracownikom ochrony zdrowia, szkół, handlu, transportu oraz innym osobom narażonym na
kontakty z dużą liczbą ludzi
dla dzieci zdrowych od 6 miesiąca życia do 18 roku życia.
-
Streptococcus pneumoniae: wskazania do szczepienia
55
a) Szczepionka nieskoniugowana (polisacharydowa):
osobom w wieku powyżej 65 roku życia,
dzieciom powyżej 2 roku życia
dorosłym z grup ryzyka : chorującym na przewlekłe choroby serca i płuc, cukrzycę, chorobę
alkoholową, nabyte zaburzenia odporności, osobom po splenektomi
Rodzaje szczepionek polisacharydowych dostępnych w Polsce:
Pneumo 23: producent Sanofi-Pasteur, cena ok. 70 zł ; dawkowanie 1 dawka 0,5 mln podana
podskórnie lub domięśniowo; ponowne podanie szczepionki powinno być rozważone u osób z
aspelnią (anatomiczna lub czynnościową), marskością wątroby, przewlekłą niewydolnością nerek
lub zespołem nerczycowym, zakażeniem HIV, innymi niedoborami odporności, anemią
sierpowatą; druga dawka podawana jest po 5 latach u osób, u których 1 dawka była podana
powyżej 10 roku życia i i po 3 latach u osób poniżej 10 roku życia
Pneumovax 23: producent MSD, dawkowanie 1 dawka 0,5 mln podana podskórnie lub
domięśniowo
b) Szczepionka skoniugowana:
dzieciom od 2 miesiąca życia do 5 roku życia,
dzieciom w wieku od 2 miesiąca życia do 5 roku życia z grup ryzyka np. uczęszczające do żłobka,
przedszkola lub z chorobami przewlekłymi, w tym zaburzenia odporności
2. Zalecenia European Respiratory Society
Grypa
Szczepienia przeciwko grypie powinny być prowadzone co roku u osób wysokiego ryzyka do powikłań
tego zakażenia.
Szczepienia przeciwko grypie powinny być przeprowadzona u osób bez niedoborów odporności w w
następujących grupach:
powyżej 65 roku życia
osób przebywających w domach opieki i innych skupiskach
przewlekłe choroby serca
przewlekłe schorzenia płucne
cukrzyca
przewlekła niewydolność nerek
hemoglobinoptaie
kobiety, które będą w II lub III trymestrze ciąży w okresie zwiększonych zachorowań na grypę
Szczepienie prowadzone co roku powinny być prowadzone wśród personelu medycznego w
szczególności, który ma kontakt z pacjentami wysokiego ryzyka do powikłań grypowych
Streptococcus pneumoniae
56
Szczepionka polisacharydowa, 23-walentna zapobiega inwazyjnej chorobie pneumokokowej i
powinna być proponowana wszystkim osobom z czynnikami ryzyka do inwazyjnej choroby
pneumkokowej.
Czynniki ryzyka do choroby pneumokokowej obejmują:
wiek powyżej 65 roku życia
pobyt w domach opieki
demencja
choroby padaczkowe
zastoinowa niewydolność serca
choroby krążenia mózgowego
POChP
W wywiadzie przebyte zapalenie płuc
Przewlekłe schorzenia wątroby
Cukrzyca
Spalenia anatomiczna lub funkcjonalna
Przelękły wyciek płynu mózgowo-rdzeniowego
Ponowne sczepienie , nie wcześniej niż 5 lat od poprzedniego, powinno być przeprowadzone u osób z
asplenią i powinno być rozważone w grupach z innymi czynnikami ryzyka.
Piśmiennictwo
1. Szczepienie zalecane przez Ministerstwo zdrowia, niefinansowane z budżetu państwa, wg
kalendarza Szczepień na rok 2012
2. European Respiratory Society and European Society for Clinical Microbiology and Infectious
Diseases Guidelines for the management of adult lower respiratory tract infections, Clin
Microbiol Infect 2011; 17(Suppl. 6): E1–E59
III. GRUŹLICA I INNE MYKOBAKTERIOZY
1. ZAKAŹNOŚĆ GRUŹLICY
Prątek gruźlicy przenoszony jest drogą oddechową (powietrzną) tzn . drobnoustrój porusza się
wraz z ruchami powietrza i istnieje możliwość zakażenia na większą odległość niż w trakcie
kontaktu twarzą w twarz z osobą chorą , nie mniej ryzyko zakażenia znacząco spada wraz z
odległością od chorego [1]
Zakaźna postać gruźlicy oznacza zakażenie w obrębie dróg oddechowych (postać płucna,
krtaniowa) [2]
Zakaźność oceniana jest jako odsetek pacjentów, u których po kontakcie dochodzi do powstania
formy latentnej (utajonej) diagnozowanej poprzez konwersję odczynu tuberkulinowego lub w
badaniu IGRA (ang. Interferon-Gamma Release Assays)
Ryzyko zakażenia jest zależne od czynników osoby chorej na gruźlicę oraz od bliskości i czasu
trwania kontaktu; największe ryzyko zakażenia występuje gdy u osoby chorej stwierdzana jest
57
postać krtaniowa lub płucna z wytworzeniem jamy oraz gdy u osoby chorej prątki stwierdzane są
w preparacie mikroskopowym materiału pobranego z dróg oddechowych [3,4]; dla porównania
ryzyko zakażenia osób pozostających w kontakcie domowym z osobą chorą, u której preparat
bezpośredni jest dodatni wynosi ok. 45% a w przypadku gdy preparat jest ujemny a dodatnia
jedynie hodowli spada do ok. 12-15% [5]
Przykłady zakaźności gruźlicy w przypadku gdy osoba chora jest dodatnia w preparacie
mikroskopowym w zależności od rodzaju kontaktu:
o Kontakt domowy ok. 30-45% [6]
o Dzieci w kontakcie domowy 45-60% [5,7]
o Dzieci korzystające z autobusu szkolnego gdy kierowca jest chory na gruźlicę ok. 30% [8]
o Kontakt z chorym na szpitalnym oddziale ratunkowym przebywającym ok. 4. godz.
zakażenie stwierdzono u 14% personelu (16 ze 112 osób) [9]
o Praca w chórze z osobą chorą: ok. 60% [10]
o Lot tym samym samolotem trwającym 8 godz.:, ok. 30% u osób siedzących w odległości
dwóch rzędów [11]
o Kontakt w pubie ok. 10% [6]
o Szkoła, miejsce w pracy, zależne od intensywności i bliskości kontaktu, w przedziale 230% [6]
Progresja zakażenia latentnego w postać aktywną gruźlicy
Postać latentna czyli utajone zakażenie jest definiowane jako domniemane zakażenie przez kompleks
Mycobaterium tuberculosis, które można rozpoznać na podstawie dodatniego wyniku próby
tuberkulinowej (w populacji nieszczepionej BCG) i/lub test IGRA, równocześnie nie stwierdza się
objawów klinicznych i radiologicznych gruźlicy [12,13,14]
Ryzyko progresji formy latentnej w postać aktywną gruźlicy wynosi średnio ok. 3-4% w ciągu
pierwszego roku i następnie ok. 5% [15,16].
W jednym badaniu na próbie ok. 13000 młodych dorosłych, u których stwierdzono zakażenie
prątkiem gruźlicy progresja w formę aktywną gruźlicy wystąpiła w 10,4% przypadków, w tym w 54%
przypadków w ciągu 1 roku i w 78% przypadków w ciągu 2 pierwszych lat od zakażenia [17]
Ryzyko zależne od wieku [16,18,19]
- największe < 5 rok życia: w kontakcie domowym ok. 34% zachoruje
- 5-15 rok życia bardzo rzadko dochodzi do przejścia formy latentnej w aktywną
- 15-19: 23%
- 20-25: 13%
- 25-29: 4%
- > 30 : 2%
Czynniki ryzyka do przejścia zakażenia latentego w gruźlicę w zależności od schorzeń towarzyszących
[2]
Schorzenie lub sytuacja kliniczna
OR (1)
HIV
50-110
AIDS
110-170
Przeszczep narządu litego
20-74
Leczenie anty-TNFalfa
1,5-17
Sterydoterapia (równoważnik > 15 mg 4,9
prednizolonu/dobę przez > 2-4 tygodnie)
Choroby rozrostowe układu krwiotwórczego
16
58
Rak płuca, głowy, szyi
Gastrectomia
Bypass jelito czcze-kręte
Silikoza
Niewydolność nerek/hemodializa
Cukrzyca
Nikotynizm
Alkoholizm
Nieodżywienie
Wiek < 5 roku życia
2,5-6,3
2,5
27-63
30
10-25
2-3,6
2-3
3
2-3,6
2-5
(1) OR (odds ratio, iloraz szans): Iloraz szansy wystąpienia określonego stanu klinicznego w
grupie eksponowanej na dany czynnik lub interwencję i szansy wystąpienia tego stanu w
grupie nieeksponowanej (kontrolnej).
2. POSTĘPOWANIE PO EKSPOZYCJI NA GRUŹLICĘ I BADANIE OSÓB Z
KONTAKTU
Decyzja o badaniu osób z kontaktu zależy od oceny ryzyka do zachorowania na postać aktywną
gruźlicy osób z kontaktu z chorym na gruźlicą, do których należą:
zakaźność osoby chorej na gruźlicę
czas i bliskość ekspozycji osób z kontaktu
ryzyko przejścia formy latentnej w postać aktywną gruźlicy u osób z kontaktu tzn. głównie w
zależności od wieku oraz schorzeń towarzyszących osób z kontaktu
Kontakty wysokiego ryzyka [2]
1) osoby pozostające w kontakcie domowym z chorym na gruźlicę dróg oddechowych
2) inne osoby, definiowane jako kontakt wysokiego ryzyka na podstawie poniższych kryteriów:
a) Krótki czas ekspozycji, w trakcie którego dochodzi do generowania aerozoli przy kontakcie
twarzą w twarz np. bronchoskopia wykonywana bez ochrony maski, badanie laryngologiczne
a u chorego pacjenta stwierdzane są prątki w preparacie mikroskopowym
b) Przebywanie w tym samym pomieszczeniu (sypialnia, samochód , pokój do pracy) przez czas
przyjęty arbitralne (czas kumulatywny)
o > 8 godz. gdy osoba chora jest dodatnia w preparacie mikroskopowym
o > 40 godz. jeżeli tylko dodatnia jest hodowla
c) Osoby, które spędziły mniej czasu, niż określone powyżej, z osobą chorą na gruźlicę dróg
oddechowych (np. osoby często odwiedzające), ale a u których stwierdzane są czynniki
ryzyka do przejścia formy latentej w aktywną postać gruźlicy, w szczególności dzieci < 5 roku
życia i osoby z niedoborami odporności
59
Postępowanie po ekspozycji u osób zdefiniowanych jako kontakty wysokiego ryzyka [2,12,20]
I krok: identyfikacja osób z kontaktu wysokiego ryzyka
W tym celu należy określić okres, przez który osoba chora stanowiła źródło zakażenia:
Chory na gruźlicę płuc z dodatnim wynikiem bakterioskopii, czyli z dodatnim rozmazem plwociny
lub popłuczyn oskrzelowo-pęcherzykowych (BAL), stanowi źródło zakażenia od chwili pojawienia
się kaszlu; zakaźność jest większa, gdy w badaniu radiologicznym stwierdza się jamę w płucu;
jeżeli chory nie kaszle, to według ekspertów można uznać, że był zakaźny przez 3 miesiące przed
wykryciem gruźlicy.
Chory z dodatnimi wynikami posiewów plwociny i ujemnym wynikiem bakterioskopii (dwa
badania) był zakaźny miesiąc przed rozpoznaniem gruźlicy; występowanie kaszlu lub jamy
zwiększa domniemany stopień zakaźności.
Chorych na gruźlicę płuc wywołaną przez prątki wrażliwe na leki przestaje się uważać za
zakaźnych po co najmniej 2 tygodniach od rozpoczęcia standardowego leczenia, jeśli nastąpiła
poprawa kliniczna i nie podejrzewa się gruźlicy wielolekoopornej (multidrug-resistant
tuberculosis - MDR-TB); w przypadku oporności na leki okres zakaźności jest dłuższy.
II krok : wywiad z osobami w kontakcie wysoko ryzyka
Wywiad z osobami w kontakcie wysoko ryzyka w celu określenia:
obecności czynników ryzyka do przejścia formy latentnej w aktywną
i/lub
obecności objawów, które wskazują na gruźlicę
III krok: wdrażanie postępowania diagnostycznego wobec osób w kontaktcie wysokiego ryzyka
1. Wywiad ujemny:
brak objawów wskazujących na gruźlicę, brak czynników ryzyka progresji formy latentnej w
gruźlicę: w tej sytuacji zlecane jest wykonanie testu QuantiFERON ok. 8 tygodni od ostatniego
dnia ekspozycji
2. Wywiad dodatni:
obecne czynniki ryzyka do progresji formy latentnej w aktywną (wiek < 5 roku życia, niedobory
odporności): niezwłocznie zlecane jest wykonanie testu QuantiFERON i badanie radiologiczne
klatki piersiowej
obecność objawów: zalecane jest badania radiologiczne klatki piersiowej, QuantiFERON i
ewentualna dalsza diagnostyka gruźlicy
IV krok: decyzja o wdrożeniu leczenia postaci latentnej
Leczenie jako tzw. profilaktyka pierwotna oznacza wdrożenie terapii, której celem jest
zapobieganie rozwinięcia aktywnej postaci gruźlicy bez uzyskania dowodów na obecność
zakażenia latnetego (pierwsze oznaczenie QuantiFERON-u ujemne lub nieprzeprowadzone) –
patrz leczenie postaci latentnej gruźlicy
60
Jest wskazane u osób kontaktu wysokiego ryzyka z większym ryzykiem progresji postaci aktywnej
w latentną tj. co najmniej dzieci < 5 roku życia, osoby z niedoborami odporności, z rozważeniem
również u osób z innymi istotnymi czynnikami ryzyka (patrz tabela wyżej)
V krok: ponowna ocena osób kontaktu wysokiego ryzyka
1. Osoby, u których podano leczenie profilaktyczne pierwotne
Dzieci < 5 roku życia, po 8 tygodniach od ostatniego dnia kontaktu wykonywane jest
ponowne badania QFT; leczenie może być zakończone jeżeli ponowne badanie jest ujemne
i nie są stwierdzane objawy; nie dotyczy dzieci < 6 miesiąca życia, u których należy
zastosować pełne leczenie profilaktyczne lub prowadzone do 6 miesiąca życia, co nastąpi
wcześniej
Osoby z niedoborami odporności: po dwóch miesiącach leczenia profilaktycznego powinien
być przeprowadzony wywiad, badanie przedmiotowe i wykonane kontrolne badanie
radiologiczne klatki piersiowej, jeżeli nie wskazują na gruźlicę należy przeprowadzić pełne
leczenie jako profilaktyka pierwotna
W drugim badania po ok 8 tygodniach od ostatniego dnia ekspozycji ponowne badanie
radiologiczne klatki piersiowej wykonywane jest u dzieci < 6 miesiąca życia , osób z
niedoborami odporności oraz u osób z objawami
2. Osoby, u których nie wdrażano leczenia profilaktycznego pierwotnego
Oceniany jest wynik testu QuantiFERON wykonanego po 8 tygodniach od ostatniego dnia
ekspozycji lub wykonywane jest ponownie badanie QuantiFERON jeżeli pierwsze badanie
zostało przeprowadzone < 8 tygodnia od ostatniego dnia ekspozycji; jeżeli badanie jest
dodatnie wykonywane jest badanie radiologiczne klatki piersiowej i ocena obecności
objawów zakażenia
Jeżeli wynik testu QuantiFERON jest dodatni należy rozważyć jedno z dwóch postępowań:
1) Wdrożenie leczenia formy latentnej – patrz dalej
2) Edukację pacjenta dotyczącą szybkiego kontaktu z lekarzem w przypadku objawów,
które mogą wskazywać na gruźlicę lub ponownej oceny wdrożenia leczenia formy
latentnej w przypadku pojawienia się choroby które może powodować niedobór
odporności
Uwaga I
Jeżeli stwierdzono przeniesienie zakażenia na osoby z kontaktu wsyokiego ryzyka należy
rozważyć poszerzenie kręgu osób z kontaktu, u których będzie przeprowadzone dociekanie
3. DIAGNOSTYKA I LECZENIE FORMY LATENTNEJ
Diagnostyka
61
Diagnoza postaci latentnej gruźlicy stawiana jest gdy stwierdzono dodatni test QuantiFERON lub
próba tuberkulinowna w populacji nieszczepionej jest ≥ 5 mm (populacja szczepiona, patrz tabela
poniżej) i brak jest objawów klinicznych zakażenia oraz badanie radiologiczne nie wykazuje odchyleń
[2].
Prowadzenie diagnostyki formy latentej należy przeprowadzać w 2 sytuacjach [2]:
1) Gdy stwierdzone zostaną wskazania do wdrożenia leczenia
2) Gdy należy zalecić dalszą obserwację pacjenta, gdy leczenie jest przeciwwskazane
Diagnostyka formy latentej jest uzasadniona u osób z kontaktu wysokiego ryzyka z gruźlicą oraz
u osób, u których pojawiły się schorzenia lub planowane jest wdrożenie leczenie, które znacząco
zwiększa ryzyko przejścia formy latentnej w aktywną gruźlicy np. przeszczep narządu, przed
wdrożeniem leczenia antyTNF-alfa [21,22]
Znaczenie prób tuberkulinowej w diagnostyce formy latentnej gruźlicy w populacji polskiej
(szczepionej BCG)
Szczepienie BCG indukuje odpowiedź na tuberkulinę w bardzo szerokim zakresie: od braku odczynu
aż do 19 mm, która to wartość zmniejsza się wraz z czasem jaki upłynął od zaszczepienia [23].
W metaanalizie obejmującej 26 badań wykazano, że w populacji szczepionej 2 do 3-krotnie częściej
stwierdzany jest zwiększony odczyn, oraz że w populacji szczepionej dopiero odczyn powyżej 15 mm
wskazuje bardziej na zakażenie niż efekt szczepienia [24]. Większość z badań poddanych metaanalizie
dotyczyła jednakże populacji szczepionych jednokrotnie.
Reaktywność próby tuberkulinowej jest silnie zależna od wieku, w którym dokonywano zaszczepienia
oraz od czasu jaki upłynął od jego wykonania [25]. Jeśli szczepienie było dokonywane w okresie
noworodkowym i niemowlęcym to po roku odczyn tuberkulinowy nie przekraczał 10 mm [26,27].
Natomiast szczepienie duńskich dzieci w wieku 6 lat oraz, w sposób zbliżony do polskiego, dzieci w
Singapurze skutkowało zdecydowanie dłużej utrzymującym sie wpływem na próbę tuberkulinową
oraz wyższym progiem wartości różnicującej
między zachorowaniem na gruźlicę a efektem
szczepienia, wynoszącym 16 mm [28,29]
Próba tuberkulinowa wykrywa aktywną postać gruźlicy z czułością 80-100% w zależności od
przyjmowanej wartości progowej 5 lub 10 mm, jednakże badania były wykonywane jedynie na
populacji nieszczepionej [30,31] .
Wykres. Rozkład wyników tuberkulinowego testu skórnego uzyskanych w grupie chorych na gruźlicę ,
potwierdzoną mikrobiologicznie (114 pacjentów) oraz w grupie kontrolnej , którą stanowili studenci I
roku medycyny (110 osób) – wielokrotnie szczepieni przeciwko gruźlicy, badanie wykonane w WCPiT
[32]
62
Interpretacja wyniki próby tuberkulinowej u osób z kontaku – kryteria wyniku dodatniego [2,12]
Śerdnica OT
≥ 15 mm
≥ 10 mm
≥ 5 mm
≥ 15 mm
≥ 10 mm
Grupa osób
Bliski kontakt
Osoby bez zaburzeń odporności szczepione po 12 m.ż.
Osoby bez zaburzeń odporności, nieszczepione BCG lub szczepione przed
12 m.ż.
Osoby z czynnikami ryzyka zachorowania na gruźlicę z wyłaczeniem HIV i
innych ciężkich zaburzeń odporności, bez względu na szczepienie BCG
Dalszy kontakt
Osoby bez zaburzeń odporności, nieszczepione BCG lub szczepione po 12
m.ż.: u szczepionych po 12 m.ż., nie zaleca się wykonywaniea próby
tuberkulinowej
Osoby z czynnikami ryzyka zachorowania na gruźlicę z wyłaczenienm HIV i
innych ciężkich zaburzeń odporności, bez względu na szczepienie BCG
Wskazania do leczenia formy latentnej
Decyzja o wdrożenie leczenia profilaktycznego formy latentej powinna być oparta o następujące
1) Ryzyko progresji formy latentnej w aktywną postać gruźlicy
2) Ryzyko wystąpienia objawów ubocznych leków
3) Ryzyka ponownego zakazane
4) Podatności na leczenie
63
W minimalnym zakresie powinna dotyczyć dzieci < 5 roku życia oraz osób z niedoborami odporności
lub innymi istotnymi czynnikami ryzyka do progresji w postać aktywną.
Indywidualnie należy rozpatrywać wdrażanie leczenie u pozostałych osób u których rozpoznawana
jest postać latentna gruźlicy, w szczególności w oparciu o interpretację kiedy mogło dojść do
zakażenie
Nie należy wdrażać leczenia u osób z dodatnim testem IGRA, u których ryzyko progresji w formę
aktywną gruźlicy jest niskie , dotyczy w szczególności osób u których stwierdzono dodatni test IGRA i
nie jest możliwe ustalenie kiedy mogło dojść do zakażenia [2,33,34]
Formy leczenia formy latentnej [2,35,36]
1) Izoniazyd codziennie przez 9 miesięcy w dawce
o Dorośli 5 mg/kg maksymalnie 300 mg/dobę
o Dzieci 10-20 mg/kg, maksymalnie 30 mg/dobę
2) Rifapentina 1 x 900 mg na tydzień + izoniazyd 1 x 900 mg na tydzień: przez 12 tygodni:
łącznie 12 podań (uwaga: rifapentina aktulanie jest sprowadzana na import docelowy)
3) Rifampicyna 10 mg/kg/dobę , maksymalnie 600 mg, przez 4 miesiące, leczenie przeznaczone
dla osob które, nie będą podatne na leczenie przy zastosowaniu izoniazydu
4. DIAGNOSTYKA GRUŹLICY PŁUC
Materiałem diagnostycznym w przypadku gruźlicy płuc mogą być:
1.
plwocina
2. popłuczyny oskrzelowe, BAL
3. popłuczyny żołądkowe (u dzieci)
4. płyn z jamy opłucnej
5. bioptaty tkanki płuc
Plwocina
Plwocinę do diagnostyki gruźlicy chory powinien odkrztusić rano, bezpośrednio po przebudzeniu
i wypłukaniu jamy ustnej przegotowaną wodą. W przypadku trudności z odkrztuszeniem należy użyć
środków wykrztuśnych lub zastosować inhalację roztworem NaCl. Należy pacjenta pouczyć o różnicy
między plwociną (wydzieliną
dolnych dróg oddechowych)
a śliną (pochodzącą z jamy ustnej
wydzieliną ślinianek). Zanieczyszczenie plwociny śliną obniża wartość diagnostyczną badanego
materiału. W przypadku zastosowania plwociny jako materiału diagnostycznego należy bezwzględnie
wykonać dwukrotnie badanie używając materiału pobranego w dwóch kolejnych dniach. Materiał,
którego nie można dostarczyć natychmiast do laboratorium należy przechowywać w lodówce.
64
Badanie obejmuje ocenę preparatu mikroskopowego na obecność prątków kwasoopornych oraz
posiew. W przypadku diagnostyki plwociny zaleca się wykonanie posiewu metodą konwencjonalną
(na podłoża L-J). Współczesne standardy rekomendowane przez WHO i ERS zalecają wykonanie
badania molekularnego zawsze w przypadku stwierdzenia dodatniego wyniku bakterioskopii.
Pozostałe materiały
W przypadku materiałów pobieranych z użyciem technik inwazyjnych należy stosować czułe metody
hodowlane, tzn. posiew na podłoża płynne w automatycznych systemach detekcji wzrostu prątków
(wyjątkiem są popłuczyny oskrzelowe pobrane w sytuacji znikomego podejrzenia gruźlicy – do
diagnostyki takiego materiału wystarczająca jest metoda konwencjonalna). Stosowany w naszym
laboratorium system to MB/Bact (Bio-Merieux).
Uwaga:
popłuczyny żołądkowe ze względu na destrukcyjny wpływ środowiska soku żołądkowego na
prątki należy dostarczyć na laboratorium natychmiast po pobraniu,
materiał, którego badanie zlecono do wykonania w systemie MB/BacT zawsze jest posiewany
równolegle z użyciem metody konwencjonalnej – nie ma potrzeby wystawiania dwóch
odrębnych zleceń.
Diagnostyka pozapłucnych postaci gruźlicy
Materiałem do diagnostyki postaci pozapłucnych są materiały pobierane z miejsc adekwatnych dla
toczącego się procesu chorobowego.
Mogą to być:
płyn z jamy opłucnej
Płyn mózgowo-rdzeniowy
Płyn osierdziowy
Płyn z jamy otrzewnej
Płyn stawowy
Mocz
Wydzieliny z ran
Tkanki i bioptaty
Wszystkie te materiały
są a priori uważane za skąpoprątkowe i z tego powodu powinny
bezwzględnie być diagnozowane wyłącznie na podłożach płynnych w czułych systemach detekcji
wzrostu prątków. W przypadku moczu wymagane jest minimum 3-krotne wykonanie posiewu próbek
65
pobranych w kolejnych dniach, po przebudzeniu, począwszy od pierwszej mikcji. Płyn mózgowordzeniowy powinien, a mocz może być badany metodami molekularnymi.
Uwaga:
w przypadku podejrzenia gruźlicy jelit materiałem diagnostycznym są bioptaty jelit. Kał
nie jest materiałem stosowanym w diagnostyce gruźlicy
w przypadku konieczności pobrania materiału na pałeczkę do wymazów nie należy
stosować podłóż transportowych; wskazane pobranie materiału na kilka pałeczek
materiałów tkankowych nie wolno utrwalać w alkoholu i formalinie, należy je
transportować w minimalnej – zabezpieczającej przed wysuszeniem – ilości soli
fizjologicznej
Krew
Krew stanowi specyficzny materiał w diagnostyce gruźlicy, zarówno ze względu na jego miejsce w
schematach diagnostycznych, jak i ze względu na wymagania dotyczące metod hodowlanych.
Sytuacje, w których należy rozważyć posiew krwi na obecność prątków:
Gruźlica prosowata
Pacjent HIV-pozytywny
Pacjent w immunosupresji
Posiew krwi wykonać można tylko na specjalne podłoża płynne. Pobranie odbywa się przyłóżkowo.
Aby wykonać taki posiew należy skontaktować się z laboratorium aby ustalić przewidywany czas
pobrania krwi. Laboratorium przygotowuje wówczas podłoże, określając czas, w którym musi ono
zostać wykorzystane (trwałość podłoża – 24 godziny od przygotowania).
Podsumowanie:
Plwocina – 2 x metoda konwencjonalna, dodatni wynik bakterioskopii – badanie molekularne.
Materiały skąpoprątkowe – metoda automatyczna, ewentualnie badanie molekularne (tylko dla
popłuczyn oskrzelowych i BAL), dodatni wynik bakterioskopii – badanie molekularne.
Płyn mózgowo-rdzeniowy – badanie molekularne + metoda automatyczna.
Mocz – minimum 3 x metoda automatyczna, ewentualnie metoda molekularna.
Krew – metoda automatyczna, bezwzględnie po kontakcie z laboratorium.
Badania genetyczne w diagnostyce gruźlicy
66
W WCPiT badania diagnostyczne gruźlicy za pomocą metod genetycznych są wykonywane w trzech
celach
Zwiększenie prawdopodobieństwa potwierdzenia gruźlicy w przypadku dodatniego preparatu
mikroskopowego
Przyspieszenie postawienia diagnozy
Zwiększenie czułości diagnostyki gruźlicy
Określenia wrażliwości prątków na rifampicynę
Badanie genetyczne powinno być rutynowo wykonywane przynajmniej na jednym materiale z dróg
oddechowych u każdego pacjenta [37]:
u którego podejrzewana jest gruźlica płucna a diagnoza nie została jeszcze postawiona
gdy wynik dodatni badania genetycznego wpłynie na postępowanie z pacjentem lub będzie
skutkować innymi działania np. związanymi z kontrolą zakażeń
a
w szczególności
postępowanie z osobami z kontaktu
Wskazania do wykonania badania genetycznego w toku diagnostyki gruźlicy płucnej
co najmniej na jednym materiale pobranym z dróg oddechowych,w celu diagnostyki
gruźlicy, najlepiej na materiale pobranym jako pierwszy
na materiale, w którym stwierdzono prątki w mikroskopowym preparacie bezpośrednim,
Zwiększenie prawdopodobieństwa potwierdzenia gruźlicy w przypadku dodatniego preparatu
mikroskopowego
Badanie genetyczne powinno być wykonane u pacjenta, u którego preparat mikroskopowy jest
dodatni i jest zalecane jako test potwierdzenie gruźlicy różnicując między gruźlicą a dodatnim
preparatem mikroskopowym z powodu obecności prątków środowiskowych; dodatni test
genetyczny u pacjenta preparatem bezpośrednim dodatnim, charakteryzuje się wysoką dodatnią
wartością predykcyjną ( > 95%) i pozwala założyć, że u pacjenta występuje gruźlica i wdrożyć
leczenie jak również wdrożyć działania dotyczące kontroli zakażeń [37,38]; w przypadku gdy
preparat bezpośredni jest dodatni a badanie genetyczne jest ujemne należy pobrać kolejny
materiał na badanie genetyczne.
Przyspieszenie postawienia diagnozy
67
Wynik badania genetycznego jest dostępny w ciągu 24 godz. od przesłania plwociny/popłuczyn
do laboratorium; przyspieszenie diagnozy w stosunku do wyniku hodowli , dotyczy sytuacji gdy
preparat bezpośredni jest ujemny a badanie genetyczne jest dodatnie; w przypadku gdy preparat
bezpośredni jest ujemny badanie genetyczne umożliwia identyfikację 50-80% przypadków, które
będą dodatnie w hodowli [39,40]; jednakże gdy badanie genetyczne jest dodatnie a preparat
mikroskopowy ujemny decyzja o wdrożeniu leczenia powinna wynikać z analizy obrazu
klinicznego; należy pobrać ponownie materiał na badanie genetyczne; jeżeli badanie genetyczne
jest dodatnie w drugim badaniu można założyć, że u pacjenta występuje gruźlica [37]
Zwiększenie czułości diagnostyki gruźlicy
Czułość badania genetycznego do wykrywania gruźlicy może być jedynie porównywana z gruźlicą
potwierdzoną mikrobiologicznie
Czułość do wykrycia gruźlicy płucnej potwierdzonej mikrobiologicznie wynosi dla metod
genetycznych 80-90% [37,38,40,41]
Inne istotne uwagi dotyczące badania genetycznego [37]
Badanie genetyczne jest dodatkiem do diagnostyki opartej na hodowli
Ujemny wynik badania genetycznego i preparatu bezpośredniego nie pozwala na wykluczenie
gruźlicy płucnej
Bardzo rzadko możliwy jest wynik fałszywie dodatni badania genetycznego – metoda
charakteryzuje się wysoką swoistością
Nie należy zlecać badania genetycznego gdy podejrzenie gruźlicy jest niskie, ponieważ w
tych sytuacjach dodatnia wartość predykcyjna jest < 50% [38]
Nie należy wykonywać badań genetycznych jako kontroli skuteczności leczenia gdyż wyniki
mogą być dodatnie dłużej niż konwersja preparatu bezpośredniego i negatywizacji hodowli wynik nie ma znaczenia w ocenie skuteczności leczenia
Ograniczone badania opisują wiarygodność badań genetycznych w diagnostyce gruźlicy
pozapłucnej oraz gruźlicy płucnej u pacjenta, który otrzymywał wcześniej leczenie;
zdecydowanie więcej wyników fałszywie dodatnich w porównaniu z hodowlą dotyczy badań
wykonanych na płynie z opłucnej i płynie mózgowo-rdzeniowym
5. Rola testów IGRA w diagnostyce gruźlicy
68
W WCPiT stosowany jest test IGRA QuantiFERON-TB GOLD (QFT).
1. Rola IGRA w diagnostyce aktywnej postaci gruźlicy [43]
Czułość QFT do wykrywania aktywnej postaci gruźlicy płucnej potwierdzonej mikrobiologiczne
wynosi 81%-84% [42], wg badań własnych wykonanych na populacji pacjentów WCPiT – 82%.
Swoistość metody w stosunku do aktywnej postaci gruźlicy wg badań własnych wykonanych na
populacji pacjentów WCPiT – 65%
Badanie IGRA nie może zastępować diagnostyki gruźlicy za pomocą standardowych metod
diagnostycznych obejmujących hodowlę i badania genetyczne
Rola badań IGRA jako wsparcie procesu diagnostycznego gruźlicy: w większości sytuacji
klinicznych IGRA nie wnosi dodatkowo korzyści w stosunku do standardowych metod
diagnostycznych; jednakże można rozważyć ich stosowanie w następujących sytuacjach:
gruźlicy pozapłucnej,
pacjenci z ujemnymi badania mikrobiologicznych plwociny lub innego materiału z
dróg oddechowych, diagnostyki u dzieci,
w różnicowaniu z prątkami niegruźliczymi;
należy pamiętać, że ujemny test IGRA nie wyklucza gruźlicy
Wniosek
W WCPiT nie jest zalecane stosowanie testów IGRA w toku rutynowej diagnostyki do potwierdzania
czynnej postaci gruźlicy u dorosłych
2. Znaczenie IGRA w wykrywaniu formy latentnej
Wykonanie badania należy rozważyć u osób, u których do zakażenia mogło dojść niedawno np. u
osób z kontaktu wysokiego ryzyka z osobą chorą na gruźlicę oraz u osób wysokiego ryzyka do
przejścia formy latentnej w postać aktywną gruźlicy np. osoby z niedoborami odporności [44,46]
W przypadku osób z kontaktu wysokiego ryzyka z osobą chorą na gruźlicę, testy IGRA
charakteryzują się bardzo wysoką ujemną wartością predykcyjną u osób bez niedobór odporności
tzn. ujemny test u osób z kontaktu oznacza, że ryzyko progresji w formę aktywną gruźlicy jest
bardzo niskie [45]; w przypadku dodatniego testu u osób z niedawnym kontaktem, ryzyko
progresji w formę aktywną w ciągu 2 lat wynosi 8-15% [45]
69
Wykonywanie testów IGRA nie należy wykonywać jako badanie przesiewowe u osób, u których
w przypadku dodatniego badania nie można określić kiedy mogło dojść do zakażenia i u osób,
u których nie są stwierdzane czynniki ryzyka do przejścia formy latentnej w aktywną [42]
3. Znaczenie testów IGRA w różnicowanie miedzy formą latentną i aktywną gruźlicy [43]
Testy IGRA nie różnicują między postacią latentną i aktywną gruźlicy
6. Leczenie gruźlicy
Podstawowe zasady leczenia gruźlicy płucnej wg WHO z 2010 roku u pacjent z nowo rozpoznaną
gruźlica płucną [47]:
Dwa pierwsze miesiące : rifampicyna +izoniazyd +pyrazynamid + ethambutol
Cztery kolejne miesiące: rifampicyna + izoniazyd
Uwaga : schemat leczenia należy zmienić
w trakcie oczekiwania na wynik badania
mikrobiologicznego jeżeli do zakażenia doszło w wyniku kontaktu z pacjentem z udokumentowanym
zakażeniem prątkiem opornym na leki
Dawkowanie leków w leczeniu gruźlicy
Lek
Zalecane dawkowanie
Codziennie
3 razy w tygodniu
Dawka i zakres Maksymalna
Dawka i zakres (
(mg/kg)
dawka dobowa mg/kg)
(mg)
Izoniazyd
5 (4-6)
300
10 (8-12)
Rifampicyna
10 (8-12)
600
10 (8-12)
Pyrazynamid
25 (20-30)
35 (30-40)
Ethabmutol
15 (15-20)
30 (25-35)
Streptomycyna1
15 (12-18)
15 (12-18)
1
Pacjenci > 60 roku życia mogą nie tolerować dawki większej niż 500-750
niektórych wytycznych dopuszczalna jest dawka 10 mg/kg w tej grupie wiekowej
Maksymalna
dawka dobowa
(mg)
900
600
1000
mg/dobę więc wg
Uwaga: jeżeli to możliwe to należy wybierać schemat leczenia w opraciu o codzienne podawanie
leku, inny schemat dawkowania może być rozważony alternatywnie w następujących sytuacjach:
codziennie podawanie czterech leków przez dwa pierwsze miesiące i następnie podanie
dwóch leków 3 razy w tygodniu przez kolejne cztrey miejsca , jednakże jedynie w sytuacji
gdy może być prowadzone nadzorowane leczenie (DOTS)
70
podawanie od początku schematu dawkowania 3 razy w tygodniu pod warunkiem gdy
może być prowadzone nadzorowane leczenie (DOTS) i pacjent nie mieszka/przebywa w
bliskości z pacjentem zakażonym wirusem HIV
Leczenie gruźlicy w szczególnych sytuacjach
Pacjenci z niewydolnoscią nerek [48]
u pacjentów z klirensem kreatyniny > 30 ml/min należy stosować standardowe dawki leków
przeciw-gruźliczych ( z wyjątkiem aminoglikozydów)
dawkowanie leków u pacjentów z klirensem kreatyniny < 30 ml/min lub leczonych hemodializą:
nie jest zalecane zmniejszanie dawki, należy zwiekszyć odstępy między kolejnymi dawkami:
izoniazyd: bez zmiany
rifampicyna: bez zmiany
pirazynamid: 25-35 mg/kg na dawkę, podawany trzy razy w tygodniu
etambutol: 15-25 mg/kg na dawkę, podawany trzy razy w tygodniu
Pajcenci z chorobami wątroby [47]
pacjenci z następującymi chorobami wątroby mogą otrzymać standardowe leczenie, pod
warunkiem, że obraz kliniczny nie wskazuje na przewlekle schorzenie wątroby: nosicielstwo
wirusów hepatotropowych, przebyte ostre zapalenie wątroby, aktualne nadmierne spożywanie
alkoholu; hepatotoksyczne efekty leków u tych pacjentów mogą występować częściej
u pacjentów z niestabilym przewlekłym schorzeniem wątroby należy rozważyć jeden z poniższych
schematów- im cięższe schorzenie tym mniej leków hepatotoksycznych należy użyć:
1) dwa leki hepatotoksyczne:
a. 9 miesięcy: izoniazyd, rifampicyna i etambutol
b. 2 miesiące izoniazyd, rifampicyna i streptomycyna i następnie przez 6 miesięcy
izoniazyd i rifapmicyna
c. 6-9 miesiecy: rifampicyna, pirazynamid, etambutol
2) Jeden lek hepatotoksyczny
a. 2 miesiące izoniazyd, etambutol, streptomycna i następnie przez 10 miesięcy
izoniazyd i etambutol
3) Bez leków hepatotoksycznych:
a. 18-24 miesiące etambutol i fluorochninolon
Leczenie gruźlicy wielolekoopornej
Wybór leczenia jest zależny od oceny lekowrażliwości i szerzej omawiany jest w wytycznych
towarzystw naukowych lub wytycznych WHO [47,48]
7. Inne mykobakteriozy
71
Diagnostyka
Kryteria diagnostyczne rozpoznania zakażenia układu oddechowego
o etiologii prątków
niegruźliczych [49]:
Aby rozpoznać zakażenia muszą być spełnione kryteria kliniczne, radiologiczne i mikrobiologiczne
1) Kliniczne: objawy ze strony układu oddechowego
2) Radiologiczne: zagęszczenia w badaniu radiologicznym z obrazem guzków lub jamy, lub w
badaniu tomografii komputerowej wysokiej rozdielczości widoczne wieloogniskowe
rozstrzenia z wieloma małymi guzkami i wykluczenie innych przyczyn
3) Mikrobiologiczne:
o dodatni posiew w co njamniej dwóch oddzielnie pobranych próbkach plwociny
lub
o dodatni posiew w co najmniej jednej próbie popłuczyn oskrzelowych
lub
o w biopsji płuc lub biopsji przezoskrzelowej obraz histopatologiczny wskazuje na
mykobakteriozę i dodatni posiew w kierunku prątków niegruźliczych lub obraz
histopatologiczny wskazuje na mykobakteriozę a prątki niegruźlicze wyhodowano w
jednym lub więcej materiałów takich jak plwocina lub popłuczyny oskrzelowe
Uwaga:
W przypadku identyfikacji rzadko spotykanego gatunku prątków niegruźliczych lub gatunku, który
może wskazywać na kontaminację, konieczne jest przeprowadzenie konsultacji z kierownikiem
laboratorium mikrobiologicznego
Pacjenci, u których podejrzewane jest zakażenie prątkami niegruźliczymi a nie spełniają kryteriów
powinni być dalej diagnozowani lub obserwowani aż zakażenie zostanie potwierdzone lub
wykluczone
Leczenie
Zakażenia układu oddechowego o etiologii Mycobacterium avium complex
o obraz zakażenia z rozstrzeniami i guzkami: trzy razy w tygodniu klarytromycyna 2 x
500 mg po (lub azytromycynma 1 x 500 mg) +rifampicyna (600 mg) + ethambutol
25mg/kg;
o w ciężkiej postaci lub przebiegającej z wytworzeniem jamy: leki wymienione powyżej
należy podawac codzinnie
Leczenie zakażenia o etiologii M. kansaii:
o Izoniazyd 300 mg/dobę +rifampicyna 600 mg/dobę + etambutol 15 mg/kg
8. Piśmiennictwo:
72
1. Centers for Diseases Control: Guideline for Isolation Precautions: Preventing Transmission of
Infectious Agents in Healthcare Settings, 2007
2. Erkens C.: Tuberculosis contact investigation in low prevalence countries: a European Consensus
Eur Respir J 2010; 36: 925–949
3. Hertzberg G. The infectiousness of human tuberculosis. An epidemiological investigation. Acta
Tuberc Scand 1957; 38: 1–146.
4. Bailey WC, Gerald LB, Kimerling ME, et al. Predictive model to identify positive tuberculosis skin
test results during contact investigations. JAMA 2002; 287: 996–1002.
5. Grzybowski S, Barnett GD, Styblo K. Contacts of cases of active pulmonary tuberculosis. Bull Int
Union Tuberc 1975;50:90–106
6. Musher D.: How Contagious Are Common Respiratory Tract Infections? N Engl J Med
2003;348:1256-66.
7. Shaw JB, Wynn-Williams N. Infectivity of pulmonary tuberculosis in relation to sputum status. Am
Rev Tuberc 1954;69:724-32
8. Mahady SCF. An outbreak of primary tuberculosis in school children: clinical aspects. Am Rev
Respir Dis 1961;84:348-58.
9. Haley C. Infect Control Hosp Epidemiol 1989;10:204
10. Bates JH, Potts WE, Lewis M. Epidemiology of primary tuberculosis in an industrial school. N Engl
J Med 1965;272:714-7.
11. Kenyon TA, Valway SE, Ihle WW, Onorato IM, Castro KG. Transmission of multidrug- resistant
Mycobacterium tuberculosis during a long airplane flight. N Engl J Med 1996;334:933-8.
12. Korzenioswka –Koseła M.: Postępowanie wobec osób z kontaktu z chorym na gruźlicę- aktulane
zalecnia dl akrajów o małej częstości wystepwoania gruźlicy i polska peresptwa. Medycyna
Praktyczna 2011;2:
13. American Thoracic Society, Centers for Disease Control and Prevention. Targeted tuberculin
testing and treatment of latent tuberculosis infection. Am J Respir Crit Care Med 2000; 161:
S221–S247.
14. Mack U, Migliori GB, Sester M, et al. LTBI: latent tuberculosis infection or lasting immune
responses to M. tuberculosis? A TBNET consensus statement. Eur Respir J 2009; 33: 956–973.
15. Horsburgh Jr CR: Priorities for the treatment of latent tuberculosis infection in the United
States. N Engl J Med 2004; 350:2060-2067.
16. Fitzgerald D.: Mycobacterium tuberculosis in Mandell L. Principles and practice of infectious
diseases. Churchill Livingstone 2010
17. Styblo K: Recent advances in epidemiological research in tuberculosis. Adv Tuberc
Res 1980; 20:1-63.
18. Gedde-Dahl T: Tuberculous infection in the light of tuberculin matriculation. Am J
Hyg 1952; 56:139-214
19. Comstock . The prognosis of a positive tuberculin reaction in childhood and adolescence. Am J
Epidemiol 1974; 99: 131–138
20. Guidelines for the Investigation of Contacts of Persons with Infectious Tuberculosis
Recommendations from the National Tuberculosis Controllers Association and CDC MMWR 2005;
54(RR-15):1-37
21. Linas B, Freedberg K, Horsburgh C. Revisiting the effectiveness of LTBI screening in the United
States. Am J Respir Crit Care Med 2009;179:A5283. Abstrakt
22. National Institute for Health and Clinical ExcellenceNICE clinical guidelineTuberculosis Clinical
diagnosis and management of tuberculosis, and measures for its prevention and control, 2011
23. Centers for Disease Control and Prevention. The role of BCG vaccine in the prevention and
control of tuberculosis in the United States. MMWR Morb Mortal Wkly Rep 1996; 45(RR-4):1–18.
73
24. Wang L. i wsp. A meta-analysis of the effect of Bacille Calmette Guerin vaccination on tubreculin
skin test measurments. Thorax 2002;57:804-9
25. Menzies S. What dose tuberkulin reactivity after Bacille Calmette-Guerin vaccination tell us ? Clin
Infect Dis 2000; 32 suppl 3:S71-4
26. Lifschitz M. The value of the tuberculin skin test as a screening test for tuberculosis among BCGvaccinated children. Pediatrics 1965; 36:624–7.
27. Joncas J. i wsp. Interpretation of the PPD skin test in BCG-vaccinated children. Can Med Assoc J
1975; 113:127–8
28. Chee C., i wsp. Interpretation of the tuberkulin skin test In Mycobacterium bovis BCG-vaccinated
Singaporean children. Am J Respir Cit. Care Med. 2001;164:958-61
29. Horwitz O. i wsp. Correlation between tuberculin sensitivityafter 2 months and 5 years among
BCG vaccinated subjects. Bull World Health Organ 1972; 47:49–58
30. Huebner R. i wsp. The tuberculin skin test. Clin Infect Dis. 1993;17:968–975,
31. Duchlin J. i wsp. Comparison of sensitivities to two commercially available tuberculin skin test
reagents in persons with recent tuberculosis. Clin Infect Dis 1997;25:661-3
32. Gruszczyński P., Ozorowski T.: Znaczenie diagnostyczne próby tuberkulinowej w populacji
szczepionej BCG, Pol. Merk. Lek., 2010, XXIX, 171, 162
33. Cook VJ, Herna´ndez-Gardun˜ o E, Elwood RK. Risk of tuberculosis in screened subjects without
known risk factors for active disease. Int J Tuberc Lung Dis 2008; 12: 903–908.
34. Landry J, Menzies D. Preventive chemotherapy.Where has it got us? Where to go next? Int J
Tuberc Lung Dis 2008; 12: 1352–1362
35. ATS/CDC/IDSA.
Treatment
of
tuberculosis.
MMWR
2003;52
(No.
RR-11).
http://www.cdc.gov/mmwr/PDF/rr/rr5211.pdf
36. Sterling T.: Three Months of Rifapentine and Isoniazid for Latent Tuberculosis Infection N Engl J
Med 2011; 365:2155-2166
37. CDC updated guidelines for the use of nucleic acid amplicication tests in the diagnosis of
tuberculosis. MMWR 2009;
38. Dinnes J, Deeks J, Kunst H, et al. A systematic review of rapid diagnostic tests for the detection of
tuberculosis infection. Health Technol Assess 2007;11:1--196.
39. Moore DF, Guzman JA, Mikhail LT. Reduction in turnaround time for laboratory diagnosis of
pulmonary tuberculosis by routine use of a nucleic acid amplification test. Diagn Microbiol Infect
Dis 2005;52:247—54
40. Guerra RL, Hooper NM, Baker JF, et al. Use of the Amplified Mycobacterium tuberculosis Direct
Test in a public health laboratory: test performance and impact on clinical care. Chest
2007;132:946--51.
41. Flores LL, Pai M, Colford JM Jr, Riley LW. In-house nucleic acid amplification tests for the
detection of Mycobacterium tuberculosis in sputum specimens: meta-analysis and metaregression. BMC Microbiol 2005;5:55
74
42. Mazurek GH, Jereb J, Vernon A, LoBue P, Goldberg S, Castro K. Updated guidelines for using
interferon gamma release assays to detect Mycobacterium tuberculosis infection – United
States, 2010. MMWR Recomm Rep 2010; 59 (RR-5): 1–25.
43. European Center for Disease Prevention and Control. Use of interferon-gamma release assays in
support of TB diagnosis. Stockholm. 2011. Available at:
http://ecdc.europa.eu/en/publications/Publications/ 1103_GUI_IGRA.pdf (last accessed 18
March 2011).
44. Herrera V.: Clinical Application and Limitations of Interferon-g Release Assays for the Diagnosis of
Latent Tuberculosis Infection. Clin Infect Dis 2011;52:1031-7
45. Diel R.:Interferon-c release assays for the diagnosis of latent Mycobacterium tuberculosis
infection: a systematic review and meta-analysis, Eur Respir J 2011; 37: 88–99
46. Mack U.: LTBI: latent tuberculosis infection or lasting immune responses to M. tuberculosis? A
TBNET consensus statement Eur Respir J 2009; 33: 956–973
47. WHO: Treatment of tuberculosis: guidelines – 4th ed., 2010
48. American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases
Society of America: Treatment of Tuberculosis Am J Respir Crit Care Med Vol 167. pp 603–662,
2003
49. An Official ATS/IDSA Statement: Diagnosis, Treatment, and Prevention of Nontuberculous
Mycobacterial Diseases Am J Respir Crit Care Med Vol 175. pp 367–416, 2007
IV. Zakażenia inne
1. ZAKAŻENIA UKŁADU MOCZOWEGO LECZONE W SZPITALU
Ostre niepowikłane odmiedniczkowe zapalenie nerek
Diagnostyka
Badanie ogólne moczu
Posiew moczu
Posiew krwi w zakażeniach o ciężkim przebiegu
Badanie USG z obrazowaniem dróg moczowych
Antybiotykoterapia
W przypadku ciężkiego zakażenia gdy pacjent nie może przyjmować leku doustnie
75
o ciprofloksacxyna 2 x 400 mg iv: jeżeli pacjent nie otrzymywał fluorochinlonów w
ciągu ostatnich 2-3 miesięcy
o cefriakson 1 x 2 g iv
o w przypadku pacjenta z czynnikami ryzyka do zakażenia lekoopornym
drobnoustrojem i bez niewydolnośći nerek należy rozważyć dodanie aminoglikozydu
przez okres pierwszych 3 dni (gentamycyna 1 x 5 mg/kg, amikacyna 1 x 15 mg/kg)
Po stabilizacji stanu pacjenta , po ok. 72 godz., przejście na forme doustną antybiotyku,
wybór zależny od otrzymanego antybiogramu
Czas kuracji 10 dni jeżeli stosowana ciprofloksacyna , 14 dni gdy stosowany biseptol
Nie jest zalecane rutynowe wykonywanie kontrolnego badania ogólnego i posiewu moczu u
pacjenta, który zareagował na leczenie
Bezobjawowa bakteriuria
1. Definicja:
- bezobjawowa bakteriuria jest rozpoznawana gdy u kobiety stwierdzane jest co najmniej 105
CFU/ml moczu tego samego drobnoustroju w dwóch próbach właściwie pobranego moczu
natomiast u mężczyzn wystarczające jest jednorazowe badanie
2. Częstość występowania asymptomatycznej bakteriurii w wybranych grupach pacjentów
- Chorzy na cukrzycę: kobiety z cukrzycą 9-27%, mężczyźni 1-10%
- Osoby zawansowane wiekiem przebywające w domach opieki: 15-50%
- Pacjenci hemodializowani ok. 30%
3. Postępowanie :
- Bezobjawowa bakteriuria nie jest wskazaniem do leczenia antybiotykami z wyjątkiem dwóch
sytuacji: u kobiety ciężarnej , u pacjenta przed zabiegiem urologicznym
- brak jest danych dotyczących postępowania u osób z ciężkimi niedoborami odporności takim jak
stan po przeszczepie narządu litego i szpiku kostnego
- Wdrożenie badania przesiewowego i leczenie bezobjawowej bakteriurii jest zalecane u kobiet w
ciąży oraz u pacjentów przed zabiegami urologicznymi
- Można rozważyć leczenie u kobiet, u których bezobjawowa bakteriuria utrzymuje się > 48 godz.
od usunięcia cewnika do pęcherza moczowego
Zakażenia układu moczowego związane z cewnikiem do pęcherza moczowego
1. Epidemiologia
- Zakażenie układu moczowego jest najczęstszym zakażeniem szpitalnym a 80% z nich jest
związana z cewnikiem do pęcherza moczowego
- W ciągu 2 pierwszych miesięcy u prawie wszystkich pacjentów jest stwierdzana bakteriuria a
głównym ryzykiem do jej powstania jest czas cewnikowania i średnio wynosi 3-7% na każdy dzień
cewnikowania;
znamienna bakteriuria najczęściej jest rozpoznawana gdy liczba kolonii
bakteryjnych przekracza wartość 105/ml jednakże pojawienie się nawet niewielkiej ilości bakterii
76
lub grzybów powoduje, że w zdecydowanej większości przypadków w ciągu 3 dni jest osiągana
wartość 105 CFU/ml
2. Objawy kliniczne
- Objawy zakażenia występują u nie więcej niż 10 % pacjentów ze znamienna bakteriurią
- 0bjawy zakażenia układu moczowego u pacjentów cewnikowanych są niespecyficzne: ból
podbrzusza i objawy dyzuryczne; objawy występują równie często u pacjentów cewnikowanych
z i bez zakażenia układu moczowego i są związane z samą obecnością cewnika
- Bakteriemia wywodząca się z dróg moczowych występuję u zaledwie 2% pacjentów ze
znamienna bakteriurią ; jednakże zablokowanie odpływu moczu u pacjentów bakteriurią szybko
może prowadzić do rozwinięcia objawów urosepsy a nawet wstrząsu septycznego
- Inne czynniki ryzyka do powstania zakażenia to zabiegi na drogach moczowych, usuwanie lub
wymiana cewnika, wyrwanie cewnika przez pacjenta
- Przy wymianie cewnika długoterminowego częstość bakteriemii dochodzi 4- 10% jednakże mają
one charakter przejściowe, często bez wyraźnych objawów i ustępujący samoistnie
- w trakcie diagnostyki nowej gorączki u pacjentów zaawansowanych wiekiem i cewnikowanych w
większości przypadków stwierdzana jest znamienna bakteriuria, która jednakże najczęściej nie
jest przyczyna gorączki w związku z tym rozpoznanie zakażenia układu moczowego u pacjenta
gorączkującego najczęściej odbywa się poprzez wykluczenie innych przyczyn gorączki
3. Diagnostyka
- Wykonywanie badan mikrobiologicznych moczu nie jest zalecane u pacjenta bez objawów
zakażenia z wyjątkiem kobiet w ciąży i pacjentów przed zabiegiem urologicznym
- większość pacjentów z bezobjawową bakteriurią ma również ropomocz (> 5 leukocytów w polu
widzenia mikroskopu o wysokim powiększeniu, lub > 10/µl) i większe znaczenie diagnostyczne
ma prawidłową wartość leukocytów gdyż pomaga wykluczyć zakażenie układu moczowego jako
przyczynę gorączki; natomiast obecność ropomoczu mniej jest przydatne w różnicowaniu między
objawowym i bezobjawowym zakażeniem
- przyczyną ropomoczu może być nie tylko zakażenie ale również podrażnienie prze obecność
cewnika
- wielkość ropomoczu bardziej koreluje z zakażeniem powodowanym przez bakterie Gram ujemne
a mniejszym przez enterokoki, gronkowce koaugulazo ujemne i grzyby
- przed przystąpieniem do leczenia zalecane jest wykonanie posiewu moczu
4. Wskazania do leczenia
- ze względu na niespecyficzny obraz kliniczny oraz najczęściej trudny do zebrania wywiad,
zalecane jest wykluczenie innych przyczyn gorączka poza zakażeniem układu moczowego
- u osób zaawansowanych wiekiem i przewlekle cewnikowanych wskazaniem do podania
antybiotyku może być stwierdzenie co najmniej jednego
z następujących bez innej
zidentyfikowanej przyczyny : gorączka > 37,9oC, tkliwość w okolic lędźwiowej, dreszcze, splatanie
; wskazania powinny zostać uzupełnione brakiem objawów oraz odchyleń wskazujących na
zakażenie w innych miejscach oraz w posiewie moczu co najmniej 105 CFU/ml; przy cięższym
obrazie klinicznym zlecenie antybiotyku w oczekiwaniu na wynik posiewu
5. Antybiotykoterapia
a) asymptomatyczna bakteriuria u pacjenta cewnikowanego
- asymptomatyczna bakteriuria u pacjentów cewnikowany mych z reguły nie wymaga
leczenia a stosowanie antybiotyków zarówno terapeutycznie jak i profilaktycznie w tej
77
grupie chorych przyczynia się jedynie do selekcji wieloopornych drobnoustrojów w
drogach moczowych pacjenta
- podawanie celowanego antybiotyku jest zalecane w znamiennej bakteriurii przed
zabiegami urologicznymi
b) leczenie zakażenia objawowego
- Wymiana cewnika w momencie rozpoczęcia kuracji przyspiesza ustępowanie objawów
oraz zmniejsza ryzyko nawrotów i jest zalecane na początku kuracji jeżeli cewnik był
obecny wcześniej przez okres > 2 tygodni i jest nadal potrzebny
- czas kuracji : 10 dni jeżeli doszło do szybkiej rezolucji objawów i 14 dni jeśli następowała
wolniej
- nie jest zalecane wykonywanie kontrolnych posiewów moczu jako ocena skuteczności
leczenia
Profilaktyczne podawanie leków antybakteryjnych u pacjentów cewnikowanych
u pacjentów przewlekle cewnikowanych nie jest zalecane podawanie leków antybakteryjnych
jako profilaktyka zakażenia [8]
u pacjentów krótkotrwale cewnikowanych (np. do zabiegu operacyjnego ) nie należy
podawać profilaktycznie leków antybakteryjnych [9,10]
profilaktyczne podanie antybiotyku należy rozważyć u pacjentów po zabiegach urologicznych
z bakteriurią; w tych sytuacjach zalecane jest jednorazowe podanie ceftriaksonu 1g iv 1- 2
godz. przez usunięciem cewnika [11]
Piśmiennictwo
1. Nicolle L., AMMI Canada Guidelines Committee. Complicated urinary tract infection in adults.
Can J Infect Dis Med Microbiol 2005;16(6):349-360
2. European Association of Urology: Guidelines on the management of urinary and male genital
tract infections, 2008
3. SIGN Guidelines, Management of suspected bacterial urinary tract infections in adults, 2006.
4. Guay D., Contemporary management of uncomplicated urinary tract infections, Drugs 2008, 68:
11691205.
5. Liu H., Appropriate antibiotic treatment of genitourinary infections in hospitalized patients, Am J
Med 2005, 118 (7A): 14S20S.
6. Hooton T., Diagnosis, prevention, and treatment of catheter-associated urinary tract infection in
adults: 2009 International Clinical Practice Guidelines from the Infectious Diseases Society of
America, Clin Infect Dis 2010, 50: 62563.
7. Gupta K. International Clinical Practice Guidelines for the Treatment of Acute Uncomplicated
Cystitis and Pyelonephritis in Women: A 2010 Update by the Infectious Diseases Society of
America and the European Society for Microbiology and Infectious Diseases. Clin Infect Dis
2011;52: e103-120
8. Niël-Weise BS, van den Broek PJ. Urinary catheter policies for long-term bladder drainage.
Cochrane Database of Systematic Reviews 2005, Issue 1. Art. No.: CD004201. DOI:
10.1002/14651858.CD004201.pub2.
9. CDC Healthcare Infection Control Practices Advisory Committee GUIDELINE FOR PREVENTION OF
CATHETER-ASSOCIATED URINARY TRACT INFECTIONS 2009
78
10. Hooton T., Bradley S., Cardenas D., i wsp.: Diagnosis, prevention, and treatment of catheterassociated urinary tract infection in adults: 2009 International Clinical Practice Guidelines from
the Infectious Diseases Society of America, Clin Infect Dis 2010; 50: 6256
11. Grabe M., Forsgren A., Hellsten S.: A short antimicrobial course given in conjunction with and
after catheter removal consecutive to transurethral prostatic resection, Scand J Urol Nephrol
1984; 18: 193
2. ZAKAŻENIA TKANEK MIĘKKICH I SKÓRY
Zakażenia rany pooperacyjnej
antybiotyk najczęściej nie jest konieczny jeżeli: obszar objęty procesem zapalnym (obrzęk,
stwardnienie) nie przekracza 5 cm i pacjent nie prezentuje lub prezentuje łagodne objawy ogólne
zakażenia (temperatura < 380C, puls < 100/min)
jeżeli pacjent prezentuje objawy > 38OC, puls > 100/min zalecane pobranie materiału z rany
(wymaz z brzegów z rany i aspirat treści ropnej) i włączenie antybiotyku na okres ok. 48 godz.;
wybór antybiotyku może wynikać z obrazu mikroskopowego w barwieniu metoda Grama ( 2
godz. od przesłania do Laboratorium)
w terapii empirycznej zalecane
- jeżeli
zabieg
z
otwarciem
przewodu
pokarmowego,
dróg
rodnych:
amokysycylina/klawulanian 3x1,2g iv
- jeżeli zabieg na kończynach, brzuchu bez otwarcia przewodu pokarmowego: cefuroksym
3 x 1,5 g iv
Liszajec
etiologia: głównie Streptococcus pyogenes, Staphylococcus aureus
leczenie: cefaleksyna p/o, amoksycylina/klawulanian p/o; jeżeli zmiana niewielka możliwe
alternatywne leczenie miejscowe przy zastosowaniu mupirocyny
Róża
etiologia: paciorkowce beta-hemolityczne głównie Streptococcus pyogenes, Staphylococcus
aureus
leczenie: penicylina iv ; jeżeli podejrzenie S. aureus: kloksacylina lub cefazolina
Zakażenie tkanek miękkich (cellulitis)
najczęstsza etiologia: Streptococcus pyogenes, Staphylococcus aureus; inna etiologia możliwa
jeżeli zakażenie jest skutkiem kontaktu z drobnoustrojami wodnymi lub do zakażenia doszło
u pacjenta z niedoborem odporności, ukąszenie zwierzęcia
diagnostyka: powinna być wdrożona zawsze gdy jest podejrzenie że eiologia zakażenia może być
inna niż typowa
- posiew krwi: czułość ok. 5%, zalecane wykonanie u gorączkujących pacjentów z ciężkim
zakażeniem
- aspiracja igłowa: czułość 5-40%
79
biopsja: czułość ok. 30%
leczenie:
- jeżeli etiologia prawdopodobnie tradycyjna Streptococcus pyogenes, Staphylococcus aureus:
cefazolina 3 x 1 g iv, jeżeli możliwa kontynuacja doustnie : cefaleksyna; jeżeli zakażenie
S. pyogenes: penicylina iv 4-6 x 3 mln; zakażenie S.aureus: kloksacylina 4-6 x 2 g iv
- jeżeli zakażenie ciężkie u pacjenta z niedoborem odporności: pipercylina/tazobaktam 4 x 4,5
g + amikacyna 1 x 15mg/kg/doba
Czyrak, czyrak mnogi
większość czyraków może być wyleczona poprzez zastosowanie wilgotnego ciepła
wskazania do zastosowania antybiotyku:
a) czyrak mnogi, lub czyrak z objawami miejscowego zapalenia tkanek miękkich i gorączka
b) lokalizacja w środkowym piętrze twarzy
- leczenie: kloksacylina 4 x 0,5-1g
- jeżeli uczulenie na antybiotyki beta-laktamowe: klindamycyna 4 x 150-300 mg,
- nawracająca czyraczność
a) identyfikacja czynników predysponujących: choroba wpływająca na zaburzenia odporności,
nosicielstwo Staphylococcus aureus w nozdrzach przednich
b) leczenie rzutu choroby antybiotykiem przez 10-14 dni
c) kąpiele profilaktyczne przy zastosowaniu 4% chlorheksydyny
d) w okresie zaostrzenia codziennie nowe ubranie przylegające do ciała natomiast jako
profilaktyka częste pranie w wyższych temperaturach
e) drenujące zmiany powinny zostać pokryte opatrunkiem
f) po każdym kontakcie ze zmianą higiena rak
g) profilaktyka nawrotów: do rozważenia jeżeli nosicielstwo Staphylococcus aureus: mupirocyna
donosowo 2 x dziennie przez 5 dni każdego miesiąca ( zalecana weryfikacja wrażliwości na
mupirocynę) lub klindamycyna 1 x 150 mg na dobę przez 3 miesiące po wyleczeniu rzutu
zaostrzenia (konieczna weryfikacja wrażliwości na klindamycynę)
Stopa cukrzycowa
Diagnoza zakażenia tkanek miękkich stopy cukrzycowej stawiana jest na podstawie obrazu
klinicznego
Diagnoza zakażenia kości stopy cukrzycowej stawiana jest na podstawie badania rezonansu
magnetycznego lub badania histopatologicznego kości
Badanie mikrobiologiczne wykonywane jest w celu identyfikacji etiologii zakażenia stopy
cukrzycowej a nie stanowi kryterium rozpoznania zakażenia
Materiał na badanie mikrobiologiczne pobierany jest w sposób umożliwiający identyfikację
bakterii powodujących zakażenie a nie jedynie kolonizację
80
Nie jest zalecane stosowanie ogólnoustrojowe antybiotyków
miejscowo jako profilaktyka zakażenie stopy cukrzycowej
Nie jest zalecane stosowanie ogólnoustrojowe antybiotyków oraz środków działających
miejscowo po stwierdzeniu bakteryjnej kolonizacji rany bez cech klinicznych zakażenia lub
odchyleń w badaniach obrazowych wskazujących na zakażenie kości
W leczeniu zakażenia stopy cukrzycowej jest zalecane stosowanie antybiotyków ogólnoustrojowo
Wybór antybiotyku jest zależny od ciężkości zakażenia , czasu trwania owrzodzenia, ryzyka
zakażenia drobnoustrojami lekoopornymi oraz wyników badań klinicznych potwierdzających
skuteczność w leczeniu tego zakażenia
Nie jest zalecane stosowanie miejscowe antybiotyków oraz środków antyseptycznych w leczeniu
zakażenia stopy cukrzycowej
W łagodnych zakażeniach, bez wcześniejszej antybiotykoterapii, antybiotyk powinien obejmować
swym działaniem Gram-dodatnie ziarniaki ; mogą to być następujące antybiotyki:
-
oraz środków działających
cefaleksyna 4 x 500 mg po
amoksycylina z klawulanianem 2 x 875/125 mg po
klindamycyna 3 x 300 mg p/o
lewofloksacyna 1 x 750 mg
W ciężkich zakażeniach zagrażający życiu należy stosować:
- piperacylina z tazobaktamem 4 x 4,5 g iv
- imipenem 4 x 500 mg iv
- lewofloksacyna ( 1 x 750 mg iv) lub ciprofloksacyna (2 x 400 mg iv ) z klindamycyną (3 x 600
mg iv)
- wankomycyna ( 2 x 15 mg/kg iv) z ceftazydymem (3 x 2 g iv) i metronidazolem (3 x 500 mg iv)
Czas leczenia :
umiarkowane zakażenie: 12 tygodnie
ciężkie zakażenie: 34 tygodnie
zakażenia kości i stawów:
o po amputacji, bez resztkowego zakażenia: do 5 dni
o zakażenie kości bez resztkowych martwaków: 46 tygodni
o zakażenie kości z pozostałością martwaków po leczeniu operacyjnym: > 3 miesięcy
Przewlekłe zmiany skórne o charakterze odleżyn i owrzodzeń żylnych
Diagnoza zakażenia odleżyny lub przewlekłego owrzodzenia żylnego stawiana jest na podstawie
obrazu klinicznego
Diagnoza zakażenia kości stawiana jest na podstawie obrazu rezonansu magnetycznego lub
badania histopatologicznego kości
81
Diagnoza krytycznej kolonizacji rany stawiana jest gdy po oczyszczeniu rany, w biopsji tkanki
stwierdzane jest ≥ 106 kolonii bakteryjnych na 1 g tkanki
Podanie antybiotyku ogólnoustrojowo jest zalecane gdy zakażeniu przewlekłej zmiany skórnej
towarzyszą następujące: objawy ogólne zakażenia, cellulitis dookoła rany, zakażenie kości i
szpiku, zakażenie w obrębie mięśni i powięzi oraz zapalenie naczyń chłonnych
Nie jest zalecane miejscowe stosowanie antybiotyków z wyjątkiem metronidazolu w przypadku
klinicznych objawów wskazujących na zakażenie o etiologii bakterii beztlenowych
Nie jest zalecane stosowanie miejscowe środków antyseptycznych w trakcie oczyszczania rany
Miejscowe stosowanie środków antyseptycznych należy rozważyć gdy po oczyszczeniu rany w
ciągu 2 tygodni nie są stwierdzane cechy gojenia rany gdy po jej oczyszczeniu stwierdzono
krytyczną kolonizację
Wybór środa antyseptycznego obejmuje: povidone iodine, cadexomer iodine lub związki srebra
Środki antyseptyczne nie powinny być stosowane dłużej niż przez okres 2 tygodni
Piśmiennictwo
1.
2.
3.
4.
Stevens D., Bison A., Chambers F. at al: Practice Guidelines for the Diagnosis and Management
of Skin and Soft – Tissue Infections. Clin Infect Dis 2005;41:1373-406
Lipsky B., Berendt A., Deery G. et al: Diagnosis and Treatment of Diabetic Foot Infections. Clin
Infec Dis 2004;39;885-910
Mandell G., Bennett J., Dolin R: Principles and Practice of Infectious Diseases. 6-ed. Churchill
Livingstone 2005
Lipsky B., Diagnosis and treatment of diabetic foot infections, Clin Infect Dis 2004, 39:885–910.
3. ZAKAŻENIA W OBRĘBIE JAMY BRZUSZNEJ: ZAKAŻENIE CLOSTRIDIUM
DIFFICILE, ERADYKACJA HELICOBACTER PYLORI
ZAKAŻENIA CLOSTRIDIUM DIFFICILE
Objawy
początek 5-10 dni od wdrożenia antybiotyku (od 1 dnia od włączenia do 10 tygodni od
odstawienia antybiotyku)
biegunka krótka i samoograniczająca do 20 stolcy/dzień
82
gorączka 30-50%
bóle brzucha 20-35%
możliwe: nudności, wymioty, krew w stolcu, odwodnienie
możliwe: toksyczne megakolon bez biegunki
Diagnostyka
badanie na obecność toksyny A i B ; dodatni test oznacza, że najprawdopodobniej przyczyną
objawów jest zakażenie Clostridium difficile natomiast ujemny test ze względu na nieoptymalną
czułość (80-90%) nie wyklucza obecności zakażenia
Leczenie
Odstawienie antybiotyku: odstawienie antybiotyku jest wystarczające do ustąpienia objawów u
23% pacjentów w ciągu 48-72 i może być wystarczające u pacjentów z łagodną postacią
zakażenia
Lekami I rzutu w leczeniu CZDC powinny być metronidazol a w cięższych postaciach
wankomycyna podawane doustnie
Dawkowanie i okres leczenia:
- metronidazol 4 x 250 mg lub 3 x 500 mg przez 10-14 dni
- wankomycyna 4 x 125- 500mg przez 10-14 dni
- W leczeniu bardzo ciężkiej postaci CZDC, przebiegającej z niedrożnością jelit należy
podawać wankomycynę doustnie 4 x 500 mg i metronidazol dożylnie 3 x 500 mg; w
przypadku niedrożności wankomycyna może być ponadto podawana przez cewnik
bezpośrednio do jelita grubego 500 mg w 100 ml lub przez cewnik foleya przez 60 min,
co 6 godz.
Ocena skuteczności leczenia : przy skutecznym leczeniu czas trwania objawów wynosi przy
leczeniu metronidazolem średnio 4,6 dnia i wankomycyną średnio 3 dni
Powikłania zakażenia
Bardzo ciężka postać CZCD (megacolon toxicum, wstrząs, kolektomia, zgon) występuje u do
3 % chorych i aż u 11% zakażonych hiperwirulentnym szczepem NAP1
Rzekomobłoniaste zapalenie jelita grubego występuje u ok. 25% pacjentów z ciężkim
przebiegiem; kolonoskopia jest mało czułym badaniem do diagnozowania CZDC, ale
identyfikacja błon rzekomych jest wysoce specyficzna
Niepowodzenia przy leczeniu metronidazolem stwierdzane są w 16-38%
Nawroty występują u ok. 20% chorych
I nawrót choroby
do nawrotu dochodzi średnio w 20% przypadków
z reguły następuje w ciągu 3-21 dni od zakończenia leczenia (aż do 4-8 tygodni od zakończenia
leczenia)
nawrót nie wynika z oporności C. difficle na zastosowany wcześniej lek
nawrót w połowie przypadków jest powodowany przez ten sam szczep
Czynniki ryzyka nawrotów:
- Przebyty już wcześniej nawrót – ryzyko wzrasta wraz z kolejnym nawrotem: 15-35% po 1
epizodzie vs. 33-65% po > 2 epizodach
83
- słaba odpowiedź układu odpornościowego pacjenta i zbyt mały poziom wytwarzanych
przeciwciał pełniących funkcję anty-toksyn, przede wszystkim zauważalne u osób w
podeszłym wieku
leczenie nawrotu
- zastosowanie tego samego leku
- zastosowanie innego leku jeżeli nawrót ma ciężki przebieg
II. Postępowanie z pacjentem z zakażeniem Clostridium difficile
Wdrożenie izolacji kontaktowej, ewentualnie kohortacja kilku chorych z tym samym zakażeniem na
tej samej sali
Piśmiennictwo
1. Clinical practice guidelines for Clostridium difficile Infection in adults: 2010 update by the Society
for Healthcare Epidemiology of America (SHEA) and the Infectious Diseases Society of America
(IDSA), Infection Control and Hospital Epidemiology 2010, 31: 431455.
Eradykacja Helicobacter pylori
Leczenie pierwszego rzutu
Jeżeli dostępne są sole bizmutu należy wybierać jako leczenie I rzutu: sole bizmutu + inhibitor
pompy protonowej + klarytromycyna 2 x 500 mg + metronidazol 2 x 500 mg; metronidazol może
być zastąpiony amoskycyliną w dawce 2 x 1 g; czas kuracji 10- 14 dni
jeżeli sole bizmutu nie są dostępne: inhibitor pompy protonowej +klarytromycyna
+metronidazol; metronidazol może być zastąpiony amoksycyliną w dawce 2 x 1 g czas kuracji 14
dni;
Leczenie drugiego rzutu
inhibitor pompy protonowej + amoksycylina + metronidazol
Piśmiennictwo
1. The European Helicobacter Study GroupCurrent concepts in the management of Helicobacter
pylori infection: the Maastricht III Consensus Report Gut 2007;56:772–781
2. Chey W. American College of Gastroenterology Guideline on the Management of
Helicobacter pylori Infection. Am J Gastroenterol 2007;102:1808–1825
4. Zakażenia związane z linią naczyniową
Zakażenie związane z linia żylną obwodową
-
w każdym przypadku odczynu w okolicy wenflonu należy wdrożyć kliniczną diagnostykę
różnicową między reakcją uboczna na ciało obce a powstaniem zakażenia
na zakażenie wskazuje: powstanie odczyny powyżej 24 godz. od założenia linii, wyciek ropny,
gorączka
84
-
w przypadku podejrzenia zakażenia związanego z linią obwodową należy pobrać krew na posiew,
usunąć linię i wysłać końcówkę (ok.2-4cm) na badanie mikrobiologiczne; wdrożenia antybiotyku:
kloksacylina 4 x 1g iv lub cefazolina 3x1 g iv
Zakażenie związane z linia naczyniową centralną krótkoterminową (LNC)
-
-
-
u każdego pacjenta z LNC, który zagorączkował i istnieje podejrzenie zakażenia należy pobrać
jednoczasowo krew na posiew z co najmniej z 2 miejsc: bezpośrednio z żyły oraz z LNC o
jeżeli zaistniało podejrzenie zakażenia związanego z LNC i stan pacjenta pogorszył się
(niestabilność hemodynamiczna) należy usunąć LNC i założyć nową w tym samym lub innym
miejscu
jeżeli LNC jest usuwana z powodu podejrzenia zakażenia, końcówka jest przesyłana na badanie
mikrobiologiczne (ok. 4 cm)
LNC powinna zostać usunięta w następujących sytuacjach
a) jeżeli stwierdzane są miejscowe cechy zakażenia
b) jeżeli doszło do zakażenia krwi związanego z LNC – w każdym przypadku; można rozważyć
pozostawienie LNC w szczególnych przypadkach, gdy z krwi wyhodowano gronkowca
koagulazo ujemnego
c) leczenie zakażenia krwi związanego z LNC:
empiryczne: wankomycyna 2 x 1 g + ceftazydym 3 x 1 g iv (lub amikacyna 1 x 15mg/kg);
modyfikacja wynikiem antybiogramu
czas leczenia: jeżeli brak powikłań 1—14 dni a w przypadku zakażenia powodowanego przez
gronkowca koagulazo-ujemnego 7 dni
Piśmiennictwo
1. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related
infection. 2009 Update by the Infectious Diseases Society of America, Clin INfect Dis 2009, 49:
145
5. Profilaktyka bakteryjnego zapalenia wsierdzia
Wskazania do stosowania profilaktyki antybiotykowej:
- wszystkie procedury stomatologiczne związane z naruszeniem dziąseł oraz okołoszczytowych
regionów zębów lub perforacją błony śluzowej jamy ustnej oraz w zabiegach nacięcia błony
śluzowej dróg oddechowych (np. tonsillektomia), które wykonywane są u pacjentów:
z wcześniejszym epizodem bakteryjnego zapalenia wsierdzia, protezą zastawki serca, wadą
wrodzoną serca (nieskorygowane wady przebiegające z sinicą, wady serca leczone poprzez
wszczepienie ciała obcego - w ciągu 6 miesięcy od zabiegu, skorygowane wady wrodzone z
resztkowym defektem pozostającym przy miejscu wszczepienia ciała obcego, przeszczep
serca przebiegający z wadą zastawkową)
Dawkowanie amoksycyliny: 2 g lub 50 mg/kg u dzieci ok. 2 godz. przed zabiegiem; dopuszczalne
jest podawanie jednej dawki po zabiegu, jeżeli pacjent nie otrzymał jej wcześniej
Piśmiennictwo
85
1.
Prevention of infective endocarditis. Guidelines from American Heart Association, Circulation
2007, 116: 173654.
6. GORĄCZKA NEUTROPENICZNA
Gorączka neutropeniczna: jednorazowy wzrost temperatury mierzonej w jamie ustnej powyżej
38,3C lub 38C utrzymującą się ponad 1 godzinę u chorych w okresie głębokiej granulocytopenii oraz
u chorych, u których przewiduje się obniżenie liczby neutrofili poniżej 0,5 G/l w ciągu 48 godzin
1.
2.
Diagnostyka
badanie fizykalne
posiewy krwi i wszystkich miejsc zmienionych zapalnie lub podejrzanych o takie zmiany
Leczenie pierwszego rzutu
Najczęściej: cefepim 3 x 2g iv lub piperacylina z tazobaktamem 4 x 4,5 g, ceftazydym 3 x
2 g iv ; lek pierwszego rzutu powinien obejmować w spektrum działania Pseudomonas
aeruginosa oraz wynikać z analiz etiologii bakteryjnych powodujących zakażenia w
oddziale
Należy dodać wankomycynę lub teikoplaninę jeżeli:
- uzasadnia to wynik badania mikrobiologicznego
- kolonizacja MRSA
- objawy zakażenia w loży cewnika centralnego
- znaczne uszkodzenie śluzówek jamy ustnej
- gorączka z dreszczami, spadek RR; wstrząs septyczny
3. Brak reakcja na antybiotyk
Jeżeli stan pacjenta stabilny i brak reakcji na antybiotyk przez pierwsze 5 dni należy rozważyć
następujące opcje: 1) wykonanie badan obrazowych : TK klatki piersiowej oraz oznaczenie
galaktomanianu, 2) utrzymanie dotychczasowych antybiotyków, 3) zastosowanie leków
przeciwgrzybiczych
Jeżeli w ciągu pierwszych dni stan pacjenta pogarsza się należy zmienić antybiotykoterapię:
poszerzyć spektrum na bakterie Gram ujemne (karbapenem) + glikopeptyd + lek przeciwgrzybiczy
U pacjentów niskiego ryzyka można rozważyć leczenie gorączki neutropenicznej ambulatoryjnie przy
zastosowaniu doustnych antybiotyków: amoksycyliny z klawulanianem z ciprofloksacyną
Pacjentci niskiego ryzyka, są definiowani jako pacjenci, u których neutropenia będzie trwała < 7 dni, z
prawidłową czynnością nerek i wątroby i wg kryterium MASCC stwierdzane jest ≥ 21 punktów:
Obraz kliniczny towarzyszące gorączce neutropenicznej:
o Bez innych objawów = 5
o Nieznaczne objawy = 3
o Ciężkie objawy towarzyszące =0
Brak spadków ciśnienia = 5
86
Brak POChP = 4
Guz lity lub schorzenia hematologiczne bez wcześniejszych zakażeń grzybiczych = 4
Brak objawów odwodnienia = 3
Pacjent poza szpitalem= 3
Wiek < 60 lat =2
Piśmiennictwo:
1. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer:
2010 update by the Infectious Diseases Society of America, Clinical Infectious Diseases
2011,52:e56–e93.
7.LECZENIE ZAKAŻEŃ GRZYBICZYCH
Candida spp.
1) Asymptomatyczna zakażenie układu moczowego
Terapia zwykle nie jest konieczna; eliminacja czynników ryzyka do wystąpienia zakażenia
z reguły konieczna m.in. zakończenie antybiotykoterapii, usunięcie lub wymiana cewnika
do pęcherza moczowego
Terapia zalecani u noworodków, pacjentów z głęboką neutropenią lub poddawani
zabiegom urologicznym
Jeżeli leczenie konieczne: flukonazol 1 x 200-400 mg/doba
Jeżeli szczep oporny na flukonazol zalecany kontakt z lekarzem ds. kontroli zakazen
szpitalnych
2) Obajowe zapalenie pęcherza moczowego
Flukonazol 1 x 200 mg przez 2 tygodnie
Jeżeli szczep oporny na flukonazol zalecany kontakt z lekarzem ds. kontroli zakażeń
szpitalnych
3) Vulvovaginitis
W zakażeniach niepowikłanych zalecane stosowanie środków miejscowo lub
jednorazowe podanie flukonazolu 150 mg
4) Zakażenie błony śluzowej jamy ustnej i gardła
Zalecane stosowanie miejscowe klotrimazolu lub nystatyny, ewentualnie flukonazolu 1 x
100-200 mg/doba; stosowanie flukoanzolu zalecane w cięższych zakażeniach
Czas leczenia 7-14 dni
5) Zakażenie przełyku
Flukonazol 1 x 200-400 mg
Czas leczenia 14-21 dni
W przypadku izolacji Candida sp. opornych na flukonazol zalecany kontakt z lekarzem ds.
kontroli zakażeń szpitalnych
6. Kandydemia ( zakażenie krwi ) u pacjenta bez neutropenii
Flukonazol dawka nasycająca, 1 doba 800 mg i następnie 1 x 400 mg/doba
Jeżeli do zakażenie doszło u pacjenta wcześniej otrzymującego flukonazol lub
kolonizowanego przez Candida sp. opornym na flukonazol lub ciężki stan chorego należy
podać echinokandynę lub amfo tercynę B do czasu weryfikacji mykogramem
Zalecane usuniecie lub wymiana linii naczyniowej centralnej
87
Czas leczenia > 14 dni od ustąpienia objawów
Zalecane przynajmniej jednokrotne badanie dna oka
7. Izolacja Candida sp. z dróg oddechowych
W zdecydowanej większości przypadków oznacza kolonizację i nie powinno być leczone
8. Profilaktyczne stosowanie leków przeciw-grzybiczych
Należy stosować u pacjentów z neutropenią < 0,5G/L i trwającą dłużej niż 7 dni (flukonazol 1
x 400 mg/doba)
Piśmiennictwo
1. Clinical Practice Guidelines for the Management of Candidiasis: 2009 Update by the
Infectious Diseases Society of America Clinical Infectious Diseases 2009; 48:503–3
Aspergillus sp.
Interpretacja hodowli Aspergillus sp. w plwocinie lub materiale bronchoskopowym
U pacjentów bez zidentyfikowanych niedoborów odporności izolacja Aspergillus sp. prawie
zawsze oznacza kolonizację a nie zakażenie [1]
U pacjentów z niedoborami odporności, w szczególności chorobami rozrostowym układu
krwiotwórczego, izolacja Aspergillus sp. z materiału z dróg oddechowych silnie wskazuje na
inwazyjną aspergilozę płucną [2]
Inwazyjna apsergilloza płucna (IAP)
Diagnostyka
U pacjentów z niedoborami odporności krytycznie istotne jest szybkie rozpoznanie IAP i
niezwłoczne wdrożenie leczenia
Czułość i specyficzność badania bronchoskopowego BAL dla IAP wynosi odpowiednio ok.
50% i ok. 97% [3]
Diagnostyka inwazyjnej IAP opiera się na kombinacji czynników ryzyka do zakażenia
klinicznych tj. identyfikacji niedoborów odporności, wyników badań tomografii
komputerowej oraz badniach, których celem jest identyfikacja drobnoustroju poprzez
badanie histopatologiczne, oznaczanie galaktomanianu , badanie mikroskopowe lub hodowlę
[4]:
1) IAP- zakażenie pewne
o stwierdzenie strzępek grzyba w histopatologicznym lub cytopatologicznym badaniu
tkanki płucnej, pobranej poprzez biopsje lub aspirację igłową z wykładnikami
niszczenia tkanki
lub
o dodatni posiew z próbki pobranej w sposób sterylny (nie poprzez bronchoskopię a
biopsję płuca) i radiologiczne cechy1 zbieżne z zakażeniem
2) IAP: zakażenie prawdopodobne
o Obecne czynniki ryzyka2 pacjenta do zakażenia i dodatni wynik w kierunku
Aspergillus sp. ( w badaniu mikrospowym, hodowli, galaktomanian)
i
88
radiologiczne kryteria1 zbieżne z zakażeniem
3) IAP: zakażenie możliwe
o Czynniki ryzyka2 do zakażenia
i
kliniczne kryteria1 zbieżne z zakażeniem
1
Radiologiczne kryteria: obecność jednego z trzech w badaniu KT: 1) gęsta dobrze ograniczona
zmiana z halo, 2) widoczny obraz półksiężyca, 3) jama
2
Czynniki ryzyka do zakażenia: w wywiadze stwierdzane : 1) neutropenia < 500/mm3i trwająca dłużej
niż 10 dni w czasowym związku z początkami zakażenia, 2) przeszczep allogeniczny szpiku, 3)
dlugotrwała sterydoterapia ( ekiwalent minimum 0,3 mg /kg prednizonu podawanego przez > 3
tygodnie, 4) leczenie czynnikam biologicznymi anty-TNF alfa, cyklosporyną, specyficznymi
przeciwciałami monoklonalnymi lub analogami nukleozydów w ciagu ostatnich 90 dni
Leczenie [5]
Worikonazol: I doba 2 x 6 mg/kg iv następnie 2 x 4 mg/kg iv z szybkim przejściem na leczenie
doustne 2 x 200 mg/dobę, po stabilizacji stanu klinicznego pacjenta
Czas leczenia nie krócej niż 6 tygodnii, zależny od ustępowania niedoborów odporności
(neutropenii) oraz regresji zmian w KT
Aspergilloma
Diagnostyka
Do rozpoznania konieczne jest stwierdzenie odchyleń radiologicznych z potwierdzeniem
mikrobiologicznym lub serologicznym; posiew plwociny jest dodatni w 50% przypadków
aspergilloma, natomiast przeciwciała są obecne w zdecydowanej większości chorych z
wyjątkiem tych leczonych sterydami [6,7]
Leczenie:
Brak dowodów na skuteczność leków przeciw-grzybiczych [8]; w wyjątkowych sytuacjach
można rozważyc podanie itrakonazolu
Przewlekła martwicza apsergilloza płucna (podostra inwazyjna spergilloza płucna)
Diangostyka
Kryteria diagnostyczne : wszystkie 6 kryteriów musi zostać zidentyfikowane [9]:
1) przewlekłe obajwy ogólne lub ze strony układu oddechowego ( > 3 miesięcy) zbieżne z
tym zakażeniem, obejmujące co najmniej jeden z następujacych: utrata masy ciała,
produktywny kaszel, krwioplucie
2) postać jamista z naciekami wokół jamy, utworzenie nowej jamy lub poszerzanie jamy
3) dodatni jeden z : surowicze precypityny dla Aspergillus sp. lub izolacja Aspergillus sp. z
dróg oddechowych
4) podwyższone markery zapalne ( CRP,OB)
5) wykluczenie innych drobnoustrojów płucnych, które mogą dawac podobny obraz
kliniczny np. gruźlica
6) bez zidentyfikowanego niedoboru odporności
89
Leczenie [8]
itrakonazol 400-600 mg/dobę lub worikonazol 2 x 200 mg p/o; w ciężkiej postaci leczenie
nalezy rozpocząć od dożylnej postaci worikonazolu lub formy lipidowej amfoterycny
czas leczenia: nie określony, indywidualnie dostosowany
Alergiczna postać apsergillozy oskrzelowo-płucnej
Diagnostyka
Minimalne kryteria diagnostyczne obejmują stwierdzenie następująych [10]
Astma
Dodatnia rekacja natychmiatsowej nadwrażliwości skórnej na antygen Aspergillus
Zwiekszenie miana IgG i IgE dla Aspergillus fumigauts
Całkowity poziom IgE w surowicy > 1000 jednostek/ml
Aktulanie obecne lub w przeszłości stwierdzone nacieki płucne
Centralne rozstrzenia
Eozynofilia w surowicy > 1000/l
Leczenie [11]
Sterydoterapia
Leczenie II rzutu: itrakonazol 2 x 200 mg po przez 16 tygodni następnei 1 x 200 mg po przez
16 tygodni; leczenie stosowane po pierwszym nawrocie choroby mimo stosowania
glukortykoidów
Piśmiennictwo
1. Soubani AO, Khanchandani G, Ahmed HP. Clinical significance of lower respiratory tract
aspergillus culture in elderly hospitalized patients. Eur J Clin Microbiol Infect Dis 2004; 23:
491–494
2. Yu VL, Muder RR, Poorsattar A. Significance of isolation of Aspergillus from the respiratory
tract in diagnosis of invasive pulmonary aspergillosis. Results from a three-year prospective
study. Am J Med 1986; 81: 249–254
3. Kousha M.: Pulmonary aspergillosis: a clinical review, Eur Resp Rev 2011;20:156-74
4. de Pauw B., Walsh T.J., Donnelly J.P. i wsp.: Revised Definitions of Invasive Fungal Disease
from the European Organization for Research and Treatment of Cancer/Invasive Fungal
Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases
Mycoses Study Group (EORTC/MSG) Consensus Group. Clin. Infect. Dis., 2008, 46, 1813-1821.
5. Walsh T.: Treatment of Aspergillosis: Clinical Practice Guidelines of the Infectious Diseases
Society of America, Clin INfect Dis 2008;46:327-60
6. Rafferty P, Biggs BA, Crompton GK, et al. What happens to patients with pulmonary
aspergilloma? Analysis of 23 cases. Thorax 1983; 38: 579–583.
7. McCarthy DS, Pepys J. Pulmonary aspergilloma–clinical immunology. Clin Allergy 1973; 3: 57–
70
90
8. American Thoracic Society Documents An Official American Thoracic Society Statement:
Treatment of Fungal Infections in Adult Pulmonary and Critical Care Patients Am J Respir Crit
Care Med 2011; 183: 96–128
9. Denning DW, Riniotis K, Dobrashian R, et al. Chronic cavitary and fibrosing pulmonary and
pleural aspergillosis: case series, proposed nomenclature change, and review. Clin Infect Dis
2003; 37: Suppl. 3, S265–S280
10. Rosenberg M, Patterson R, Mintzer R, et al. Clinical and immunologic criteria for the diagnosis
of allergic bronchopulmonary aspergillosis. Ann Intern Med 1977; 86: 405–414.
11. Agarwal R.: Allergic bronchopulmonary aspergillosis, Chet 2009;135:805-26
8.PROFILAKTYKA OKOŁOOPERACYJNA
Zasady ogólne
Cefazolina jest antybiotykiem stosowanym do profilaktyki okołooperacyjnej
Pierwsza dawka cefazoliny jest podawana na bloku operacyjnym w trakcie wprowadzania do
znieczulenia
Cefazolina na bloku operacyjnym jest podawna w dawce 1 g iv u pacjentów < 80 kg i 2g iv u
pacjentów > 80 kg
Po zabiegu operacyjnym cefazolina nie powinna być podawana dlużej niż 24 godz. tj. dwie dawki
1 g iv w odstępie 8 godz.; nie zostały stwierdzono różnice w skuteczności jednej dawki cefazoliny
vs. podawana przez 24 godz.
U pacjentów uczulonych na antybiotyki beta-laktamowe należy podać wankomycynę 1 g iv tak
aby wlew zakończyć około 1 godz. przed zabiegiem
Wskazania wg rodzaju zabiegu
Stosowanie drenażu jamy opłucnowej: zalecane jest podawanie cefazoliny przez okres do 24
godz. od założenia drenu, gdy przyczyną drenażu jest uraz klatki piersiowej; brak wystarczających
badań, aby formułować zalecenia dotyczące profilaktyki antybiotykowej w drenażu z innych
wskazań
Lobektomia, pneumonektomia, torakoskopia, torakotomia: zalecane jest podanie cefazoliny
przez okres nie dłuższy niż 24 godz.
Przeszczep płuca: profilaktyka powinna odbywać się indusyidaulanie po analize wcześniejszych
zakażeń i kolonizacji u dawcy oraz biorcy: stosowanie profilaktyki okołooperacyjnej w
przeszczepie płuca jest wyjątkową sytuacją, gdyż wg aktualnej wiedzy wybór antybiotyku może
opierać się na analizie badań mikrobiologicznych materiału z dróg oddechowych zarówno dawcy,
jak i biorcy; w profilaktyce stosowane są antybiotyki, które zawsze powinny obejmować
gronkowca złocistego oraz uwzględniać drobnoustroje kolonizujące drogi oddechowe, w
przypadku biorcy chorującego na mukowiscydozę dotyczy to w szczególności MRSA i
Pseudomonas aeruginosa; czas podawania profilaktycznie antybiotyku nie został określony, wg
niektórych źródeł w przypadku kolonizacji P. aeruginosa powinien wynosić 714 dni; nie zaleca
91
się stosowania leków przeciw grzybiczych jako profilaktyki zakażeń Candida sp.; zastosowanie
profilaktyki przeciwko zakażeniom o etiologii Aspergillus sp. jest zależne od wcześniejszej
kolonizacji dróg oddechowych tym drobnoustrojem oraz indywidualnie w zależności od
czynników ryzyka tego zakażenia, związanych z pooperacyjnym niedoborem odporności
Piśmiennictwo
1. Stosowanie antybiotyków w profilaktyce okołooperacyjnej: rekomendacje konsultanta krajowego
ds. mikrobiologii kliniczne i chirurgii ogolnej 2011. www.antybiotyki.edu.pl
2. Aznar R., Mateu M., Miro J., i wsp.: Antibiotic prophylaxis in non-cardiac thoracic surgery: 103
cefazolin versus placebo, Eur J Cardio-thorac Surg 1991; 5: 5158.
3. Boldt J., Piper S., Uphus D. et al. Preoperative microbiologic screening and antibiotic 109
prophylaxis in pulmonary resection operations, Ann Thorac Surg 1999; 68: 20811.
4. Soave R.: Prophylaxis strategies for solid-organ transplantation, Clin Infect Dis. 2001; 33 (suppl.
1): 2631.
5. Avery R.K.: Infections after lung transplantation, Semin Respir Crit Care Med 2006; 27: 544-51.
6. Ruiz I., Gavalda J., Monforte V. , i wsp.: Donor-to-host transmission of bacterial and fungal
infections in lung transplantation, Am J Transplant 2006; 6: 178–182.
7. Pappas P., Silveira F.: AST Infectious Diseases Community of Practice. Candida in solid organ
transplant recipients, Am J Transplant 2009; 9 (suppl. 4): 1739.
8. Singh N. Husain S. AST Infectious Diseases Community of Practice. Invasive aspergillosis in solid
organ transplant recipients, American Journal of Transplantation 2009; 9 (suppl. 4): S180–S191.
92