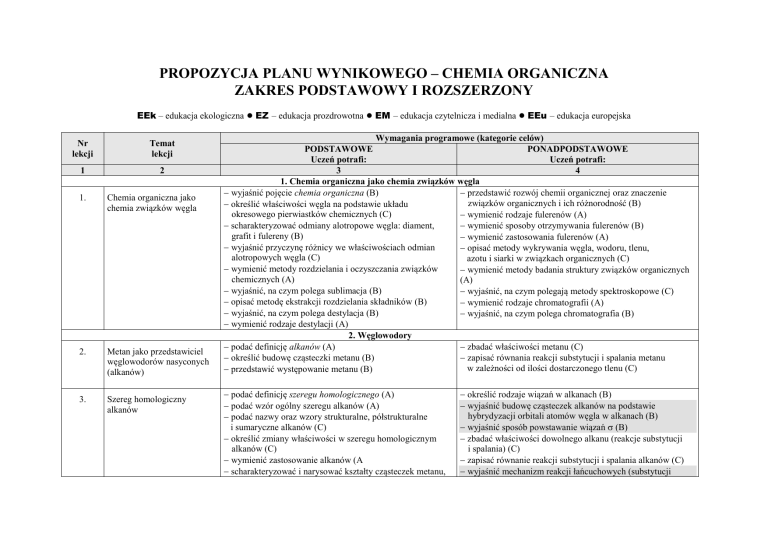
PROPOZYCJA PLANU WYNIKOWEGO – CHEMIA ORGANICZNA
ZAKRES PODSTAWOWY I ROZSZERZONY
EEk – edukacja ekologiczna ● EZ – edukacja prozdrowotna ● EM – edukacja czytelnicza i medialna ● EEu – edukacja europejska
Nr
lekcji
Temat
lekcji
1
2
1.
Chemia organiczna jako
chemia związków węgla
2.
Metan jako przedstawiciel
węglowodorów nasyconych
(alkanów)
3.
Szereg homologiczny
alkanów
Wymagania programowe (kategorie celów)
PODSTAWOWE
PONADPODSTAWOWE
Uczeń potrafi:
Uczeń potrafi:
3
4
1. Chemia organiczna jako chemia związków węgla
wyjaśnić pojęcie chemia organiczna (B)
przedstawić rozwój chemii organicznej oraz znaczenie
związków organicznych i ich różnorodność (B)
określić właściwości węgla na podstawie układu
okresowego pierwiastków chemicznych (C)
wymienić rodzaje fulerenów (A)
scharakteryzować odmiany alotropowe węgla: diament,
wymienić sposoby otrzymywania fulerenów (B)
grafit i fulereny (B)
wymienić zastosowania fulerenów (A)
wyjaśnić przyczynę różnicy we właściwościach odmian
opisać metody wykrywania węgla, wodoru, tlenu,
alotropowych węgla (C)
azotu i siarki w związkach organicznych (C)
wymienić metody rozdzielania i oczyszczania związków
wymienić metody badania struktury związków organicznych
chemicznych (A)
(A)
wyjaśnić, na czym polega sublimacja (B)
wyjaśnić, na czym polegają metody spektroskopowe (C)
opisać metodę ekstrakcji rozdzielania składników (B)
wymienić rodzaje chromatografii (A)
wyjaśnić, na czym polega destylacja (B)
wyjaśnić, na czym polega chromatografia (B)
wymienić rodzaje destylacji (A)
2. Węglowodory
podać definicję alkanów (A)
zbadać właściwości metanu (C)
określić budowę cząsteczki metanu (B)
zapisać równania reakcji substytucji i spalania metanu
w zależności od ilości dostarczonego tlenu (C)
przedstawić występowanie metanu (B)
podać definicję szeregu homologicznego (A)
podać wzór ogólny szeregu alkanów (A)
podać nazwy oraz wzory strukturalne, półstrukturalne
i sumaryczne alkanów (C)
określić zmiany właściwości w szeregu homologicznym
alkanów (C)
wymienić zastosowanie alkanów (A
scharakteryzować i narysować kształty cząsteczek metanu,
określić rodzaje wiązań w alkanach (B)
wyjaśnić budowę cząsteczek alkanów na podstawie
hybrydyzacji orbitali atomów węgla w alkanach (B)
wyjaśnić sposób powstawanie wiązań (B)
zbadać właściwości dowolnego alkanu (reakcje substytucji
i spalania) (C)
zapisać równanie reakcji substytucji i spalania alkanów (C)
wyjaśnić mechanizm reakcji łańcuchowych (substytucji
2
4.
Izomeria łańcuchowa
w alkanach
5.
Eten jako przedstawiciel
węglowodorów
nienasyconych (alkenów)
6.
Szereg homologiczny
alkenów
7.
Otrzymywanie i właściwości
alkenów
8.
Charakterystyka
węglowodorów
nienasyconych (alkinów)
na przykładzie acetylenu
(etynu)
etanu i propanu (C)
podać definicje izomerów i izomerii łańcuchowej (A)
wyjaśnić reguły tworzenia nazw systematycznych izomerów
(B)
budować modele cząsteczek izomerów alkanów (B)
zapisywać wzory strukturalne, półstrukturalne i sumaryczne
oraz podawać nazwy systematyczne izomerów alkanów
(C)
określić rzędowość dowolnego atomu (C)
określić kształt cząsteczki etenu (B)
wymienić zastosowanie etenu
chlorowania i bromowania alkanów) (B)
napisać wzory izomerów alkanów o liczbie atomów węgla
większej od 5 (D)
zastosować zasady nazewnictwa izomerów alkanów o liczbie
atomów większej od 5 (D)
porównać właściwości izomerów (D)
wyjaśnić pojęcie alkeny (B)
wyjaśnić, dlaczego alkeny zalicza się do węglowodorów
nienasyconych (B)
podać nazwy, wzory strukturalne, półstrukturalne
i sumaryczne alkenów oraz wzór ogólny alkenów (C)
podać najważniejsze przykłady zastosowania alkenów (A)
wymienić metody otrzymywania alkenów (A)
wskazać reakcję addycji i eliminacji (A)
podać przykłady reakcji addycji i eliminacji (B)
przewidzieć produkt główny reakcji addycji do
niesymetrycznego alkenu (C)
wymienić reakcje charakterystyczne dla alkenów (A)
omówić właściwości fizyczne alkenów w ich
szeregu homologicznym (B)
wyjaśnić pojęcie alkiny (B)
wyjaśnić, dlaczego alkiny zalicza się do węglowodorów
nienasyconych (B)
podać nazwy oraz wzory strukturalne, półstrukturalne
i sumaryczne alkinów i wzór ogólny alkinów (C)
omówić budowę etynu (B)
określić kształt cząsteczki etynu (B)
wymienić metody otrzymywania alkinów (A)
opisać zastosowania acetylenu (B)
zapisać równania reakcji spalania i addycji dowolnego
alkenu (D)
omówić budowę cząsteczek alkenów na podstawie
hybrydyzacji atomów węgla w alkenach (B)
wyjaśnić sposób powstawanie wiązań (B)
otrzymać eten i zbadać jego właściwości (C)
omówić rodzaje wiązań w cząsteczce etenu (B)
zapisać równania reakcji spalania, addycji i polimeryzacji
etenu (C)
napisać równania reakcji otrzymywania alkenów (B)
zapisać równanie reakcji addycji do symetrycznego alkenu
(C)
wyjaśnić mechanizm reakcji addycji na podstawie reguły
Markownikowa (D)
zaprojektować doświadczenie, za którego pomocą można
odróżnić alkany od alkenów (D)
otrzymać acetylen i zbadać jego właściwości (C)
zapisać równanie reakcji otrzymywania acetylenu (C)
zapisać równania reakcji spalania i addycji acetylenu (C)
zapisać równania reakcji spalania i addycji dowolnego
alkinu (D)
opisać budowę i kształt cząsteczek alkinów na podstawie
hybrydyzacji atomów węgla w alkinach (B)
omówić rodzaje wiązań w cząsteczkach alkinów (B)
zaprojektować doświadczenie wykazujące nienasycony
charakter acetylenu (D)
3
9.
Porównanie budowy
cząsteczek i właściwości
alkanów, alkenów i alkinów
10.
Węglowodory cykliczne
11.
Charakterystyka
węglowodorów
aromatycznych
na przykładzie benzenu
EEk
EZ
12.
Homologi benzenu
i inne węglowodory
aromatyczne
EZ
EEk
13.
Izomeria geometryczna
cis-trans
14.
Źródła węglowodorów
w przyrodzie
EZ
opisać budowę cząsteczek alkanów, alkenów i alkinów (B)
określić rodzaj wiązań w cząsteczkach alkanów, alkenów
i alkinów (B)
podać najważniejsze zastosowania węglowodorów (C)
zaprojektować tabelę zawierającą porównanie budowy
cząsteczek węglowodorów, ich aktywności chemicznej
i właściwości (D)
zaprojektować doświadczenie odróżniające alkany od
węglowodorów nienasyconych (D)
opisać budowę cykloalkanu i cykloalkenu (B)
napisać równania typowych reakcji związków cyklicznych
(C)
podać nazwę węglowodoru cyklicznego na podstawie wzoru
(C)
napisać wzór węglowodoru cyklicznego (C)
napisać wzory izomerów związków cyklicznych (C)
wyjaśnić pojęcie aromatyczność na przykładzie benzenu (B) wyjaśnić budowę cząsteczki benzenu na podstawie
hybrydyzacji atomów węgla w benzenie (B)
zbudować model cząsteczki benzenu (C)
zbadać właściwości benzenu (C)
wyjaśnić pojęcia: elektrony zdelokalizowane, pierścień
aromatyczny (B)
zapisać równanie reakcji otrzymywania benzenu (C)
opisać właściwości fizyczne benzenu (A)
zapisać równania reakcji bromowania benzenu z użyciem
katalizatora oraz po naświetleniu światłem nadfioletowym,
zapisać równania reakcji spalania benzenu (C)
spalania benzenu, nitrowania i sulfonowania oraz
katalitycznego uwodornienia benzenu (C)
wyjaśnić pojęcia: elektrofil, substytucja elektrofilowa (B)
zaprojektować doświadczenia, za którego pomocą można
odróżnić węglowodór aromatyczny od alifatycznego (D)
wymienić homologi benzenu (A)
zbadać właściwości toluenu (C)
zapisać wzory homologów benzenu (B)
zapisać równania reakcji spalania i bromowania toluenu (C)
zastosować w nazewnictwie przedrostki: orto-, meta- i para- wyjaśnić, na czym polega wpływ kierujący podstawników (B)
(C)
wyjaśnić aromatyczny charakter naftalenu (D)
opisać właściwości naftalenu (C)
podać przykłady innych od naftalenu węglowodorów
aromatycznych (A)
omówić budowę i właściwości naftalenu (B)
wyjaśnić różnicę między odmianą cis- a odmianą trans- (B) omówić kształt cząsteczki but-2-enu (D)
narysować wzory cis-trans dla but-2-enu (C)
z podanych wzorów cząsteczek wybrać izomery cis-trans (C)
narysować przykładowe wzory izomerów cis-trans (C)
przewidzieć, które alkeny tworzą izomery cis-trans (D)
wymienić surowce energetyczne (A)
zbadać właściwości ropy naftowej (C)
wymienić produkty destylacji ropy naftowej, podać ich
zbadać właściwości produktów destylacji ropy naftowej (D)
najważniejsze właściwości i zastosowania (C)
wyjaśnić, na czym polega proces destylacji (B)
wymienić rodzaje węgli kopalnych (A)
wyjaśnić pojęcia: kraking i reforming (B)
wyjaśnić, jak powstały złoża węgli kopalnych i ropy
wyjaśnić pojęcie liczba oktanowa (B)
4
EEk
15.
16.
Wyznaczanie wzoru związku
chemicznego
17.
Podsumowanie
wiadomości
o węglowodorach
18.
Sprawdzian wiadomości
i umiejętności
19.
Budowa cząsteczek alkoholi
monohydroksylowych
20.
naftowej (B)
podać definicję procesu pirogenizacji węgla
kamiennego (A)
wymienić produkty pirogenizacji węgla kamiennego, podać
ich najważniejsze właściwości i zastosowania (C)
wskazać na mapie Polski obszary występowania złóż
surowców energetycznych (C)
wskazać na mapie świata obszary występowania
największych złóż surowców energetycznych (C)
napisać równanie reakcji chemicznej podanej w treści
zadania (C)
ustalić wzór związku chemicznego na podstawie równania
reakcji chemicznej podanej w treści zadania (C)
wyjaśnić pojęcia: wzór empiryczny, wzór rzeczywisty (B)
ustalić wzór empiryczny (C)
ustalić wzór sumaryczny (B)
obliczyć skład procentowy pierwiastków w związku
chemicznym (C)
przeprowadzić suchą destylację węgla kamiennego (D)
zbadać właściwości produktów suchej destylacji węgla
kamiennego (D)
zbadać właściwości gazu ziemnego (D)
wyjaśnić pojęcie alternatywne (odnawialne) źródła energii i
dlaczego konieczne jest ich poszukiwanie i stosowanie (B)
przygotować prezentację na temat „Węglowodory w
przyrodzie” (D)
opisać właściwości związku chemicznego na podstawie
ustalonego wzoru (D)
narysować wzór strukturalny związku chemicznego na
podstawie ustalonego wzoru sumarycznego (D)
przeprowadzić obliczenia związane ze stechiometrią równań
reakcji chemicznych z udziałem węglowodorów (D)
3. Jednofunkcyjne pochodne węglowodorów
określić budowę cząsteczki etanolu (C)
napisać nazwy izomerycznych alkoholi monohydroksylowych
(C)
wyjaśnić pojęcie grupa funkcyjna (B)
podać nazwy, wzory strukturalne, półstrukturalne,
określić rzędowość alkoholu monohydroksylowego (B)
sumaryczne alkoholi monohydroksylowych w szeregu
homologicznym oraz wzór ogólny alkoholi
monohydroksylowych (C)
wyjaśnić pojęcie rzędowość alkoholi (B)
opisać właściwości fizyczne niższych alkoholi
zbadać właściwości etanolu i napisać odpowiednie równania
Alkohole monohydroksylowe
monohydroksylowych (A)
reakcji chemicznych (C)
na przykładzie etanolu
wymienić reakcje charakterystyczne dla alkoholi (A)
wykryć obecność alkoholu (D)
napisać równanie reakcji alkoholu z sodem (B)
napisać równanie reakcji hydrolizy alkoholanu (B)
EZ
napisać równanie reakcji alkoholu z chlorowodorem (B)
uzasadnić odczyn zasadowy alkoholanów (C)
5
21.
Alkohole polihydroksylowe
– glikol i glicerol
EZ
22.
Charakterystyka fenoli
EZ
23.
Porównanie alkoholi i fenoli
24.
Sprawdzian wiadomości
o alkoholach i fenolach
25.
26.
Otrzymywanie i właściwości
aldehydów
EZ
napisać równanie reakcji eliminacji wody z alkoholu (B)
napisać równania reakcji spalania alkoholu (B)
podać nazwy alkoholanów (A)
ocenić wpływ alkoholu na organizm człowieka (D)
– wyjaśnić, co to są alkohole polihydroksylowe (B)
podać nazwy systematyczną i zwyczajową glicerolu
i glikolu (A)
scharakteryzować właściwości glikolu i glicerolu (A)
wymienić zastosowania glikolu i glicerolu (A)
wyjaśnić pojęcie fenole (B)
rozróżniać alkohole od fenoli (B)
podać nazwy systematyczne i zwyczajowe homologów
fenolu (C)
opisać właściwości fizyczne fenoli (A)
wymienić reakcje charakterystyczne fenoli (B)
wymienić zastosowania fenoli (A)
wymienić metody otrzymywania fenoli (A)
porównać metody otrzymywania alkoholi i fenoli (C)
porównać właściwości alkoholi i fenoli (C)
wymienić zastosowania alkoholi i fenoli (A)
wyjaśnić, co to są aldehydy (B)
napisać grupę funkcyjną aldehydów (C)
podać nazwy systematyczne aldehydów (A)
podać wzory strukturalne i półstrukturalne aldehydów (B)
napisać wzór ogólny szeregu homologicznego aldehydów
(C)
przewidzieć właściwości alkoholu na podstawie jego
wzoru (C)
podać nazwę systematyczną dowolnego alkoholu
polihydroksylowego (C)
zbadać właściwości glicerolu i napisać odpowiednie równania
reakcji chemicznych (spalania, z sodem i z wodorotlenkiem
miedzi(II)) (C)
zaprojektować doświadczenie, za którego pomocą można
odróżnić alkohol monohydroksylowy od polihydroksylowego
(D)
napisać równania reakcji otrzymywania fenolu (B)
zbadać właściwości hydroksybenzenu i zapisać odpowiednie
równania reakcji: zobojętniania, bromowania, nitrowania (C)
ocenić wpływ pierścienia benzenowego na charakter
chemiczny fenoli (D)
opisać doświadczenie wykrywania fenolu za pomocą chlorku
żelaza(III) (B)
wyjaśnić wpływ grupy –OH na aktywność pierścienia
benzenowego w fenolu (C)
napisać równanie reakcji fenolu z chlorkiem żelaza(III) (B)
odróżnić alkohol monohydroksylowy od polihydkoksylowego
(C)
odróżnić alkohol od fenolu (C)
zaprojektować tabelę umożliwiającą porównanie budowy
cząsteczek oraz właściwości alkoholi i fenoli (D)
otrzymać aldehyd i zapisać odpowiednie równanie reakcji
chemicznej (D)
przeprowadzić próbę Tollensa i próbę Trommera dla
formaldehydu (C)
zapisać odpowiednie równanie reakcji chemicznej (C)
przeprowadzić reakcję formaldehydu z fenolem (C)
6
27.
Ketony
28.
29.
Otrzymywanie i właściwości
kwasów karboksylowych
na przykładzie kwasu
octowego
EZ
30.
Wyższe
kwasy karboksylowe
(tłuszczowe)
podać metody otrzymywania aldehydów (A)
podać wzór alkoholu, z którego powstał aldehyd (A)
wymienić właściwości aldehydów (A)
wymienić właściwości metanalu (A)
wyjaśnić, co to są ketony (B)
wskazać grupę karbonylową (C)
podać nazwy systematyczne ketonów alifatycznych (A)
wyjaśnić zasadę tworzenia nazw ketonów aromatycznych
(B)
podać nazwy strukturalne i półstrukturalne ketonów (B)
napisać wzór ogólny szeregu homologicznego ketonów (C)
wymienić metody otrzymywania ketonów (A)
napisać wzór alkoholu, z którego powstał keton (A)
wymienić właściwości ketonów (A)
wymienić właściwości acetonu (A)
wymienić zastosowania acetonu (A)
wyjaśnić pojęcie kwasy karboksylowe (B)
wskazać grupę funkcyjną kwasów karboksylowych (C)
podać nazwy oraz wzory strukturalne, półstrukturalne
i sumaryczne kwasów karboksylowych (C)
nazwać typ reakcji otrzymywania kwasów karboksylowych
(A)
podać nazwy zwyczajowe kwasów karboksylowych (A)
napisać wzory alkoholi i aldehydu, z którego można
otrzymać kwas karboksylowy (B)
podać wzór ogólny kwasów karboksylowych (A
wymienić właściwości kwasów karboksylowych (A)
napisać równania reakcji kwasów z metalami, tlenkami
metali i wodorotlenkami (C)
wyjaśnić, co to są wyższe kwasy karboksylowe (B)
podać wzory i nazwy kwasów tłuszczowych (A)
wymienić właściwości wyższych kwasów tłuszczowych (B)
podać zastosowania kwasów tłuszczowych (A)
zapisać odpowiednie równanie reakcji chemicznej (C)
wyjaśnić, na czym polegają reakcje polimeryzacji
i polikondensacji (B)
opisać różnice w budowie aldehydów i ketonów (C)
wykazać różnice we właściwościach aldehydów i ketonów
(C)
zaprojektować doświadczenie, za którego pomocą można
odróżnić aldehydy od ketonów (D)
doświadczalnie zbadać właściwości kwasu octowego i zapisać
odpowiednie równania reakcji chemicznych (C)
przeprowadzić fermentację octową i zapisać równanie
odpowiedniej reakcji chemicznej (C)
zaproponować sposób otrzymywania kwasów
karboksylowych (D)
zbadać właściwości wyższych kwasów karboksylowych
i zapisać równania reakcji chemicznych, którym te kwasy
karboksylowe ulegają (C)
ocenić wpływ obecności wiązania podwójnego w cząsteczce
na właściwości kwasu tłuszczowego (D)
zaprojektować doświadczenie, za którego pomocą można
wykryć charakter nienasycony kwasu oleinowego (D)
7
31.
Mydła
– mechanizm mycia i prania
EZ
32.
Reakcja estryfikacji i jej
produkty
33.
Tłuszcze i ich rola
w organizmie
EZ
34.
35.
wyjaśnić, co to są mydła (B)
podać podział mydeł (A)
opisać budowę cząsteczek mydeł i jej wpływ na mechanizm
mycia i prania (C)
opisać mechanizm prania (B)
opisać budowę cząsteczek estrów (B)
podać nazwę estru (A)
wskazać grupę funkcyjną estrów (A)
przeprowadzić reakcję otrzymywania octanu etylu (C)
opisać właściwości estrów (A)
wymienić zastosowania estrów (A)
zbadać właściwości tłuszczów (C)
określić rolę tłuszczów w organizmie (C)
podzielić tłuszcze stosując odpowiednie kryteria (D)
opisać budowę tłuszczu (B)
wymienić właściwości fizyczne tłuszczu (A)
EZ
przedstawić podział tłuszczów złożonych (A)
wyjaśnić, co to są woski (B)
wyjaśnić rolę cholesterolu (B)
Aminy jako przykład
związków organicznych
wyjaśnić budowę amin (B)
wskazać grupę funkcyjną amin (A)
Tłuszcze złożone
otrzymać mydło sodowe i zbadać jego zachowanie w wodzie
twardej (C)
zapisać odpowiednie równania reakcji chemicznej (C)
wyjaśnić pojęcie twardość wody (B)
zanalizować wpływ jonów wapnia i magnezu na proces mycia
i prania (D)
napisać równanie hydrolizy mydła (C)
zbadać odczyn mydła (C)
wyjaśnić, co to jest detergent (B)
wyjaśnić mechanizm reakcji estryfikacji (B)
opisać warunki, w jakich zachodzi reakcja estryfikacji (B)
zapisać równanie reakcji estryfikacji (C)
przeprowadzić reakcje hydrolizy estrów i zapisać ich
równania (C)
wyjaśnić różnicę między reakcją zobojętniania a reakcją
estryfikacji (B)
napisać wzór tłuszczów nasyconych i nienasyconych (C)
przeprowadzić reakcję zmydlania tłuszczów i zapisać
odpowiednie równanie reakcji chemicznej (C)
wyjaśnić, na czym polega zmydlanie tłuszczu (B)
udowodnić, na podstawie reakcji zmydlania tłuszczu,
do jakiej grupy związków chemicznych zaliczają się tłuszcze
(D)
zapisać równanie reakcji hydrolizy tłuszczów (C)
wyjaśnić, na czym polegają hydroliza kwasowa i hydroliza
zasadowa tłuszczu (B)
zaproponować doświadczenie, za którego pomocą można
odróżnić tłuszcz nasycony od tłuszczu nienasyconego (D)
opisać metodę otrzymywania margaryny z oleju
roślinnego w przemyśle (B)
zdefiniować fosfolipidy(A)
- opisać skład fosfoglicerydów (B)
opisać skład glikolipidów (B)
opisać, jaką rolę odgrywa cholesterol w organizmach żywych
(B)
zbadać właściwości aniliny (C)
napisać równania reakcji chemicznych, jakim ulegają aminy
8
zawierających azot
36.
37.
38.
39.
40.
Lekcja powtórzeniowa
podać nazwy amin (A)
napisać wzory strukturalne i półstrukturalne amin (B)
napisać wzór ogólny amin (B)
określić rzędowość wybranych amin (B)
zapisywać wzory związków chemicznych należących do
odpowiedniego szeregu homologicznego (B)
zapisać równania reakcji chemicznych przebiegających
z udziałem jednofunkcyjnych pochodnych węglowodorów
(C)
(C)
udowodnić doświadczalnie charakter zasadowy amin (D)
porównać właściwości metyloaminy i aniliny (C)
przeprowadzić obliczenia związane ze stechiometrią równań
reakcji chemicznych, którym ulegają jednofunkcyjne
pochodne węglowodorów (D)
Sprawdzian wiadomości i
umiejętności
4. Wielofunkcyjne pochodne węglowodorów
wyjaśnić, czym są aminokwasy (B)
zbadać doświadczalnie właściwości aminokwasu (glicyny) i
Aminokwasy jako przykład
zapisać odpowiednie równania reakcji chemicznych (C)
wskazać
i
nazwać
grupy
funkcyjne
aminokwasów
(C)
dwufunkcyjnych pochodnych
określić
charakter chemiczny aminokwasów (C)
wyjaśnić
pojecie
aminokwas
białkowy
(C)
węglowodorów
wyjaśnić pojęcie jon obojnaczy (B)
napisać wzory glicyny i alaniny (A)
zapisać równania reakcji powstawania di- i tripeptydów (D) napisać równanie reakcji jonu obojnaczego w środowiskach
EZ
kwasowym i zasadowym (B)
napisać wzory peptydów zbudowanych z glicyny i alaniny
wyjaśnić pojęcie punkt izoelektryczny (B)
(C)
napisać równanie reakcji glicyny i alaniny z NaOH i HCl (C)
wyjaśnić tworzenie się wiązań peptydowych (D)
Białka i ich rola
w organizmie
EZ
zbadać skład pierwiastkowy białek (C)
zbadać wpływ różnych czynników na białko (C)
wyjaśnić rolę białek w organizmie (B)
wyjaśnić, na czym polegają I- rzędowa, II- rzędowa,
III-rzędowa struktura białka (C)
opisać właściwości białek (A)
zbadać właściwości roztworów białek (C)
wyjaśnić pojęcia: koagulacja, wysalanie, peptyzacja,
denaturacja (B)
wyjaśnić różnice miedzy denaturacją a wysalaniem białka (B)
zaprojektować doświadczenie pozwalające zidentyfikować
białko (D)
przeprowadzić reakcje charakterystyczne na wykrywanie
białek (reakcje biuretową i ksantoproteinową) (D)
wymienić rodzaje oddziaływań stabilizujących I- rzędową,
II-rzędową i III-rzędową strukturę białka (B)
41.
Glukoza jako przykład
monosacharydu (cukru
prostego)
wyjaśnić pojęcie związek wielofunkcyjny (B)
dokonać podziału sacharydów (A)
wymienić rodzaje grup funkcyjnych w sacharydach (A)
wyjaśnić pojęcia: monosacharydy, oligosacharydy
wyjaśnić pojęcie cukier redukujący (B)
napisać wzór Fischera i Hawortha glukozy i fruktozy (B)
wyjaśnić pojęcie anomery i (B)
wymienić sacharydy szeregu D i L (A)
9
EZ
42.
Sacharoza jako przykład
disacharydu (dwucukru)
EZ
30.
Skrobia i celuloza
jako przykłady
polisacharydów
(wielocukrów)
EZ
31.
Nukleozydy i nukleotydy
EZ
i polisacharydy oraz aldoza i ketoza (B)
zbadać skład pierwiastkowy sacharydów (C)
opisać budowę cząsteczki glukozy (B)
zbadać właściwości glukozy i zapisać odpowiednie
równania reakcji chemicznych (C)
opisać właściwości glukozy i fruktozy (A)
wyjaśnić rolę glukozy w organizmie (B)
podać inne przykłady monosacharydów (A)
wyjaśnić pojęcia: trioza, pentoza, heksoza itp. (B)
wyjaśnić przebieg procesu fermentacji alkoholowej i zapisać
równanie reakcji chemicznej (B)
wyjaśnić pojęcia: disacharyd (dwucukier), wiązanie
glikozydowe (B)
opisać budowę cząsteczki sacharozy (B)
napisać wzór sacharozy (A)
zbadać właściwości sacharozy (C)
opisać właściwości sacharozy (A)
przeprowadzić hydrolizę sacharozy i zbadać właściwości
produktów tej hydrolizy (C)
wyjaśnić rolę sacharozy w organizmie (B)
podać inne przykłady disacharydów (A)
wyjaśnić pojęcie polisacharyd (B)
wymienić przykłady polisacharydów (A)
podać miejsca występowania skrobi i celulozy w przyrodzie
(A)
wyjaśnić znaczenie biologiczne i funkcje sacharydów (B)
zbadać właściwości skrobi (C)
wykryć obecność skrobi w badanej substancji (D)
opisać właściwości skrobi, glikogenu i celulozy wynikające
z różnicy budowy ich cząsteczek (D)
wymienić produkty hydrolizy skrobi i celulozy (A)
wyjaśnić różnicę między -deoksyrybozą a -rybozą (B)
wyjaśnić pojęcia: związek heterocykliczny, zasada purynowa
i zasada pirymidynowa (B)
wymienić przykłady związków heterocyklicznych (A)
napisać wzory: puryny, adeniny, guaniny, pirymidyny,
cytozyny, uracylu, tyminy (B)
napisać równanie reakcji glukozy z Cu(OH)2 (B)
wyjaśnić, jak powstaje wiązanie półacetalowe (B)
napisać wzór laktozy i maltozy (B)
wyjaśnić pojęcie wiązania - i -glikozydowe (B)
wyjaśnić różnicę w budowie sacharozy i maltozy (B)
wyjaśnić różnice właściwości sacharozy i maltozy (B)
wyjaśnić związek między budową cząsteczki sacharydu
a jego właściwościami redukującymi (B)
zaproponować doświadczenie, za którego pomocą można
odróżnić sacharozę od maltozy i glukozy (D)
zaproponować podział sacharydów ze względu na budowę
cząsteczek (C)
zaproponować doświadczenie pozwalające odróżnić skrobię
od celulozy (D)
napisać równania reakcji hydrolizy skrobi i celulozy (B)
opisać warunki hydrolizy skrobi i celulozy (A)
wyjaśnić tworzenie się nukleotydów (B)
opisać, jak zbudowana jest cząsteczka ATP (C)
narysować schematycznie cząsteczkę ATP (D)
10
32.
Kwasy nukleinowe
33.
EZ
Podsumowanie wiadomości
o wielofunkcyjnych
pochodnych węglowodorów
34.
Sprawdzian wiadomości
i umiejętności
35.
Izomeria optyczna
36.
Chiralność
37.
Izomery optyczne
wyjaśnić pojęcia: nukleozyd, nukleotyd, wiązanie
N-glikozydowe, wiązanie bezwodnikowe (B)
wyjaśnić pojęcie kwas nukleinowy (B)
opisać rolę kwasów nukleinowych (B)
wymienić rodzaje RNA (A)
zapisać wzory związków chemicznych należących do
odpowiedniej grupy pochodnych (B)
zapisać równania reakcji chemicznych przebiegających
z udziałem węglowodanów, hydroksykwasów
i aminokwasów (C)
5. Izomeria optyczna
wyjaśnić pojęcie izomeria optyczna (B)
wyjaśnić, na czym polega czynność optyczna związku
chemicznego (B)
opisać budowę polarymetru (B)
wyjaśnić pojęcie światło spolaryzowane (B)
wyjaśnić pojęcie chiralność (B)
wyjaśnić pojęcie związek chiralny (B)
zdefiniować pojęcie asymetryczny atom węgla (B)
zdefiniować pojęcie enancjomery (A)
zdefiniować pojęcie mieszanina racemiczna (B)
wskazać asymetryczny atom węgla w cząsteczce (C)
wybrać z podanych przykładów wzory substancji chiralnych
(C)
wskazać enancjomery (B)
odróżnić diastereoizomery (C)
wskazać formę mezo- (B)
6. Tworzywa sztuczne
opisać budowę cząsteczek DNA i RNA (C)
wyjaśnić różnice między rodzajami RNA (B)
wykonać obliczenia związane ze stechiometrią równań
reakcji chemicznych, którym ulegają wielofunkcyjne
pochodne węglowodorów (D)
rozróżniać substancje prawoskrętne i lewoskrętne (C)
napisać wzory perspektywiczny i projekcyjny związku
chiralnego (B)
wskazać wzory enancjomerów (D)
zdefiniować pojęcie diastereoizomery (B)
określić formę mezo- (B)
narysować wzory Fischera prostych związków chemicznych
(C)
określić konfigurację D i L oraz R i S (B)
narysować wzory odmian izomerycznych glukozy i podać ich
nazwy (C)
wyjaśnić pojęcia: epimery i anomery oraz podać przykłady
(B)
podać wzory chiralnych aminokwasów i hydroksykwasów
(D)
11
38.
Tworzywa sztuczne
EEk
39.
Polimery naturalne i
modyfikowane
EEk
40
Działanie substancji
chemicznych na organizm
człowieka
41.
Zagrożenia środowiska
przyrodniczego
EM
EZ
EEk
42.
Zanieczyszczenia
atmosfery
zdefiniować pojęcia: tworzywa sztuczne, tworzywa
napisać równanie reakcji polimeryzacji (B)
syntetyczne (A)
wskazać monomer, polimer i mer w równaniu reakcji
polimeryzacji (A)
wyjaśnić, na czym polega reakcja polimeryzacji (B)
wyjaśnić pojecie polikondensacja (B)
napisać wzory polimerów (C)
wymienić rodzaje tworzyw sztucznych (A)
napisać równanie reakcji polikondensacji (B)
podać przykłady tworzyw sztucznych (A)
podać wzory tworzyw polikondensacyjnych (B)
opisać właściwości tworzyw sztucznych (B)
zdefiniować pojęcia tworzywa termoplastyczne, termoi chemoutwardzalne (B)
zdefiniować pojęcia: tworzywa karbołańcuchowe i
tworzywa heterołańcuchowe (A)
wymienić zastosowania tworzyw sztucznych (B)
wymienić polimery naturalne (A)
wyjaśnić, na czym polega proces modyfikacji kauczuku (B)
wymienić właściwości kauczuku (B)
napisać wzory kauczuku i izoprenu (B)
opisać budowę cząsteczki trioctanu celulozy i triazotanu
wymienić pochodne celulozy (A)
celulozy (B)
opisać właściwości pochodnych celulozy (B)
podać zastosowania pochodnych celulozy (A)
7. Chemia w życiu społecznym, gospodarce i ochronie środowiska przyrodniczego
wymienić substancje, które powinny być zawarte w zdrowej opisać wpływ uzależnień na organizm ludzki (B)
diecie, oraz ich proporcje (A)
zaproponować metody zapobiegania przed uzależnieniami
(D)
wymienić najbardziej toksyczne metale (A)
opisać właściwości metali toksycznych (B)
wymienić rodzaje uzależnień (A)
zdefiniować uzależnienia (A)
opisać działanie wybranych substancji chemicznych na
organizm człowieka (B)
wyjaśnić pojęcie środowisko przyrodnicze (B)
uzasadnić zależność między rozwojem cywilizacji
a zagrożeniami (D)
wyjaśnić pojęcie dziura ozonowa (B)
zaproponować sposoby oceniania zagrożenia powietrza
wyjaśnić pojęcie efekt cieplarniany (B)
i wody (D)
wyjaśnić pojęcie kwaśne opady (B)
zaplanować sposoby ograniczania zanieczyszczeń powietrza
i wody (D)
przeanalizować problem zanieczyszczeń powietrza (ustalić,
dlaczego tak jest, jak być powinno i co należy zrobić, żeby
było tak, jak być powinno) (D)
wymienić źródła zanieczyszczeń atmosfery (A)
zbadać działanie tlenku siarki(IV) na rośliny, metale i tkaniny
(D)
zbadać wpływ wodnego roztworu tlenku siarki(IV) na stal
i wapienie (D)
12
EZ
EEk
43.
Zanieczyszczenia
hydrosfery
EM
EZ
EEk
44.
Zanieczyszczenia
litosfery
podać skład zanieczyszczeń powietrza (A)
zbadać pH wody deszczowej (D)
zinterpretować wynik pomiaru pH wody deszczowej (D)
wyjaśnić, co to jest hydrosfera (B)
wymienić czynniki powodujące zanieczyszczenie
hydrosfery (C)
podać źródła zanieczyszczeń hydrosfery (A)
wyjaśnić pojęcie eutrofizacja wód naturalnych (B)
zaproponować sposoby ograniczania zanieczyszczeń
atmosfery (D)
wyjaśnić pojęcie litosfera (B)
wymienić czynniki zanieczyszczające litosferę (C)
opisać wpływ nawozów sztucznych na użyźnianie gleby (C)
zbadać odczyn gleby (C)
zbadać właściwości sorpcyjne i jonowymienne gleby (D)
ocenić zagrożenia wynikające z zanieczyszczeń gleby (D)
zaplanować sposoby zapobiegania skażeniom gleby (D)
ocenić zagrożenia fizyczne dla środowiska przyrodniczego
(C)
ocenić zagrożenia biologiczne dla środowiska
przyrodniczego (C)
ocenić zagrożenia chemiczne dla środowiska
przyrodniczego (C)
zaplanować sposoby przeciwdziałania zagrożeniom
środowiska przyrodniczego (D)
wyjaśnić, co to są odpady przemysłowe i komunalne (B)
wyjaśnić, na czym polega utylizacja odpadów (B)
ocenić możliwość wykorzystania niektórych odpadów jako
surowców wtórnych (C)
wyjaśnić znaczenie segregacji śmieci dla ochrony
środowiska przyrodniczego (B)
wyjaśnić, na czym polega kompostowanie odpadów (B)
wymienić zalety i wady spalania śmieci (C)
opisać problem składowania odpadów promieniotwórczych
(D)
EZ
EEk
45.
Sposoby zapobiegania
skażeniom środowiska
przyrodniczego
EM
EZ
EEk
46.
Odpady przemysłowe
i komunalne oraz problem
ich zagospodarowania
EM
EZ
EEk
EEu
wskazać obszary nadmiaru i niedoboru wody w Polsce (A)
opisać procesy oczyszczania i uzdatniania wody (B)
zaplanować sposoby przeciwdziałania zanieczyszczaniu wód
(D)